不同鏈長直鏈糊精-維生素E復合物的制備及穩定性研究
王馨甜,邱洪偉,盧浩,盧曉雪,田耀旗*
1(食品科學與技術國家重點實驗室(江南大學),江蘇 無錫,214122)2(諸城興貿玉米開發有限公司,山東 濰坊,262299)
直鏈糊精是一種由葡萄糖單元通過α-1,4-糖苷鍵連接而成的線性多糖[1],與直鏈淀粉具有相似的結構,其疏水性空腔由亞甲基和糖苷氧基團構成[2],當溶液中存在合適尺寸的客體分子時,不規則卷曲狀的直鏈糊精能夠與客體分子形成左手單螺旋結構[3-4],因此可以用來包埋客體分子。目前通常使用環糊精作為包埋壁材,但環糊精空腔大小較為固定、成本較高,難以包埋大尺寸客體分子。而支鏈淀粉通過酶解脫支、醇沉分級得到一系列聚合度不同的直鏈糊精形成的螺旋空腔尺寸不固定,且不同鏈長直鏈糊精形成的螺旋空腔大小不盡相同[5-6]。近年來,以直鏈糊精為壁材包埋生物活性物質逐漸受到關注[7-8],但對不同鏈長直鏈糊精對客體分子包埋特性的研究甚少。
維生素E是一種脂溶性維生素,作為最主要的抗氧化劑之一[9],具有延緩衰老和消除自由基[10]等功能。然而,維生素E對熱和光的不穩定性嚴重限制了其在各領域的應用[11]。本文選用維生素E為客體,以蠟質玉米淀粉為原料,通過普魯蘭酶脫支,乙醇梯度溶解法分級得到幾種不同鏈長直鏈糊精,制備直鏈糊精-維生素E復合物,評價其耐熱、耐光穩定性,以期為選擇合適鏈長直鏈糊精包埋生物活性分子提供指導。
1 材料與方法
1.1 材料與試劑
蠟質玉米淀粉,杭州星普羅淀粉有限公司;普魯蘭酶(1 498 NPUN/g),美國Sigma試劑公司;無水乙醇、維生素E、無水磷酸氫二鈉、一水檸檬酸、己烷,國藥集團化學試劑有限公司。
1.2 儀器與設備
ME104E電子天平,梅特勒-托利多儀器(上海)有限公司;DF-101S集熱式恒溫加熱磁力攪拌器,鞏義市予華儀器有限責任公司;ICS—5000+離子色譜儀,美國賽默飛世爾科技公司;Waters 1525EF高效液相色譜儀,美國沃特世公司;TU-1900雙光束紫外可見分光光度計,北京普析通用儀器有限責任公司;IS10傅里葉紅外光譜儀,美國Nicolet公司;D8-Advance型X-射線衍射儀,德國Bruker公司;TGA2熱分析系統,瑞士梅特勒-托利公司;SCIENTZ-10 N冷凍干燥機,寧波新芝生物科技股份有限公司;ZF-1三用紫外分析儀,上海馳唐電子有限公司。
1.3 實驗方法
1.3.1 不同鏈長直鏈糊精的制備
參考CHANG[12]和HU等[13]的方法并加以優化。用pH 5.0~5.5的磷酸鹽緩沖溶液配制10%的蠟質玉米淀粉乳,高壓滅菌鍋處理40 min,冷卻至55 ℃,加入體積為淀粉乳體積2%的普魯蘭酶,保溫24 h,沸水浴10 min滅酶,離心(4 500 r/min,8 min)后,將上清液旋轉蒸發去除乙醇和大部分水,得到未分級的直鏈糊精(unfractionated linear dextrin,UNLD),真空冷凍干燥得到粉末;準確稱取2 g UNLD,加入100 mL乙醇與水體積比為2∶1的乙醇溶液,60 ℃恒溫水浴攪拌4 h,離心(4 500 r/min,20 min)棄掉上清液,收集沉淀;向沉淀中加入乙醇與水體積比1∶1的乙醇溶液,60 ℃恒溫水浴攪拌4 h,離心(4 500 r/min,20 min)后將上清液旋轉蒸發除去乙醇和大部分水,凍干得到的樣品命名為LD1∶1;繼續向沉淀中加入乙醇與水體積比1∶5的乙醇溶液,同樣的方法制備LD1∶5;沉淀用大量去離子水洗滌,干燥得到的樣品命名為LD>1∶5。
1.3.2 直鏈糊精鏈長及分子質量測定
取25 mg樣品分散于5 mL超純水中,在恒定磁攪拌的油浴中加熱,使其完全糊化,過0.22 μm的濾膜備用。高效陰離子交換色譜系統裝備脈沖安培檢測器,色譜柱型號為戴安CarboPAC PA200。流動相為150 mmol/L的NaOH溶液,流速為0.4 mL/min,進樣量為25 μL。平均聚合度(degree of polymerization,DP)計算公式(1)為:
(1)
式中:n,峰序號;A,峰面積,nC·min。
分子質量測定使用帶有保護柱的超水凝膠線性色譜柱(300 mm×7.8 mm,2 μm)。采用一系列不同分子質量的葡萄糖標準品(Mw2 700、9 750、135 030、300 600和2 000 000)作為標準。
1.3.3 不同鏈長直鏈糊精-維生素E復合物的制備
取1 g直鏈糊精分散到100 mL去離子水中,加熱糊化后冷卻至70 ℃,取0.1 g 維生素E用少量無水乙醇溶解,待直鏈糊精溫度冷卻至70 ℃時,逐滴加入維生素E-乙醇溶液,70 ℃下密封避光攪拌2 h以促進兩者復合,待復合結束后緩慢冷卻至室溫,離心(10 000 r/min,10 min)后得到的沉淀用V(無水乙醇)∶V(蒸餾水)=50∶50的混合液洗滌2次后冷凍干燥,即為LD-維生素E復合物。采用同樣的方法作空白實驗,得對照品的直鏈糊精。質量比為10∶1的直鏈糊精與維生素E物理混合即得物理混合物(LD+VE)。
1.3.4 直鏈糊精對維生素E負載量、包埋率的測定
1.3.4.1 標準曲線的繪制
精密稱取161.9 mg 維生素E樣品,用己烷溶解定容至100 mL,分別吸取維生素E標準溶液1、2、3、4和5 mL置于25 mL容量瓶中,用己烷定容至刻度,搖勻。以己烷為空白對照,在200~400 nm全波長掃描,確定最大吸收波長。
在最大吸收波長處(285 nm)測量吸光值,得到標準曲線回歸方程為:A=0.004 6ρ-0.002 9(R2=0.999 9),A為吸光值,ρ為維生素E含量(μg/mL)。
1.3.4.2 負載量、包埋率的測定
取上述LD-VE分散于己烷中,超聲處理15 min,離心(10 000 r/min,10 min)后將沉淀重新分散到己烷中,重復3次,合并上清液,采用紫外分光光度法測定維生素E含量[14]。
負載量計算公式(2)為:
(2)
式中:ω,維生素E負載量,μg/mg;ρ,維生素E含量,μg/mL;V,樣品溶液總體積,mL;N,樣品稀釋倍數;m0,樣品質量,mg。
包埋率按公式(3)計算:
(3)
式中:Y,維生素E包埋率,%;m1,LD-VE復合物質量,g;ω,維生素E負載量,μg/mg;m2,加入維生素E的質量,g。
1.3.5 直鏈糊精-VE復合物結構分析
1.3.5.1 傅里葉變換衰減全反射紅外光譜(attenuated total reflection flourier transformed infrared spectroscopy,ATR-FTIR)
取少量樣品平鋪于樣品臺上。實驗參數如下:掃描波長為4 000~400 cm-1,分辨率為4 cm-1,掃描次數為32次[15]。
1.3.5.2 X-射線衍射(X-ray diffraction,XRD)
掃描時采用NaI晶體閃爍計數器測量,掃描范圍3~40°,掃描速度4°/min[16]。采用Jade 5.0軟件進行分析。
1.3.6 熱分析(thermogravimetric analysis,TGA)
稱取4 mg左右的樣品置于瓷坩堝中,從30 ℃升溫至500 ℃,升溫速率為10 ℃/min。測定過程中,樣品處于氮氣氛圍中,氮氣流速為20 mL/min。通過對TGA曲線求導得到微商熱重分析(differentia thernmal gravity,DTG)曲線。
1.3.7 直鏈糊精-VE復合物的耐光穩定性分析
將樣品置于紫外燈(254 nm)下照射,分別在照射的第0、1、3、5、10、24、36和48 h取樣,采用1.3.4的方法測定剩余維生素E的含量。
1.4 數據統計分析
使用Origin 2018軟件對數據進行擬合和繪圖。使用SPSS 18.0進行方差分析和Duncan顯著性分析以確定不同樣品之間的顯著差異,P<0.05表示在統計學上具有顯著性差異。所有實驗平行測定3次,數據以平均值±標準差的形式呈現。
2 結果與分析
2.1 直鏈糊精鏈長測定
普魯蘭酶是一類淀粉脫支酶,能夠專一性切開支鏈淀粉分支點中的α-1,6糖苷鍵,形成分子質量分布廣的直鏈糊精UNLD。用乙醇梯度溶解法將UNLD分為3個組分:LD1∶1、LD1∶5和沉淀LD>1∶5。如圖1所示,分級后的直鏈糊精在DP 30~60部分呈現遞增趨勢。DP結果如表1所示,LD1∶1、LD1∶5和LD>1∶5的DP分別為14.53、16.20和25.25。當加入較高含量的乙醇時,短鏈溶解,長鏈沉淀[17]。因此,LD1∶1DP<6,DP 6~12和DP 13~24部分所占比例高于LD1∶5和LD>1∶5。隨著乙醇含量的降低,直鏈糊精長鏈部分在溶液中的溶解量增加,因此,LD1∶5長鏈部分(DP 25~36和DP ≥ 37)所占比例高于LD1∶1。沉淀LD>1∶5長鏈部分比例分別達到21.91%和21.68%,顯著高于LD1∶5。
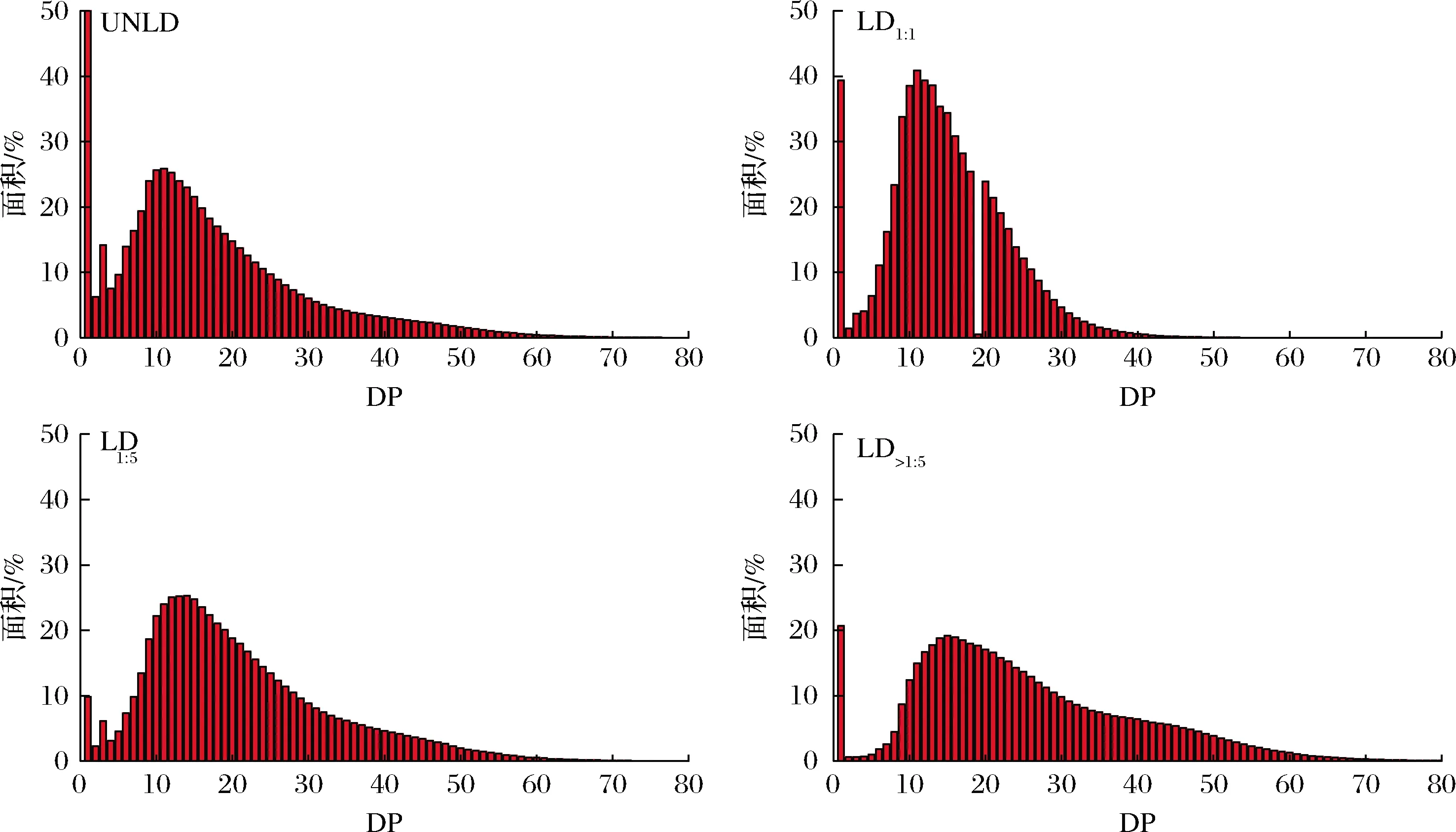
圖1 分級前后直鏈糊精鏈長分布

表1 分級前后直鏈糊精鏈長分布
LD1∶1、LD1∶5和LD>1∶5的重均分子質量(Mw)分別為1 450、1 971和2 436 Da。不同分子質量的直鏈糊精在同一乙醇溶液中溶解度不同,即分子質量與溶解度呈負相關。乙醇含量降低導致各組分分子質量增加,其順序為LD1∶1
2.2 直鏈糊精對維生素E的負載量和包埋率
不同鏈長直鏈糊精對VE負載量和包埋率如圖2所示。隨著直鏈糊精鏈長增加,包合物中維生素含量以及直鏈糊精對維生素包埋率都呈現遞增趨勢。當直鏈糊精的DP由14.53增加至25.25時,直鏈糊精對維生素E負載量從45.97 μg/mg提高至62.71 μg/mg,維生素E包埋率從39.07%增加至59.57%。因此,可以說明直鏈糊精的鏈長對維生素E負載量、包埋率有影響,且鏈長長的直鏈糊精對維生素E負載量和包埋率高。

圖2 不同鏈長直鏈糊精對維生素E的負載量和包埋率
2.3 直鏈糊精-VE復合物的結構分析
2.3.1 FTIR分析
如圖3所示,LD1∶1、LD1∶5和LD>1∶5在3 600~2 990 cm-1的寬吸收峰是由于-OH的伸縮振動引起的,而2 925 cm-1的峰與-CH2的碳氫不對稱伸縮振動有關[18]。1 016、1 076和1 147 cm-1處的3個強吸收峰分別對應C—C與C—O伸縮振動和C—H彎曲振動。
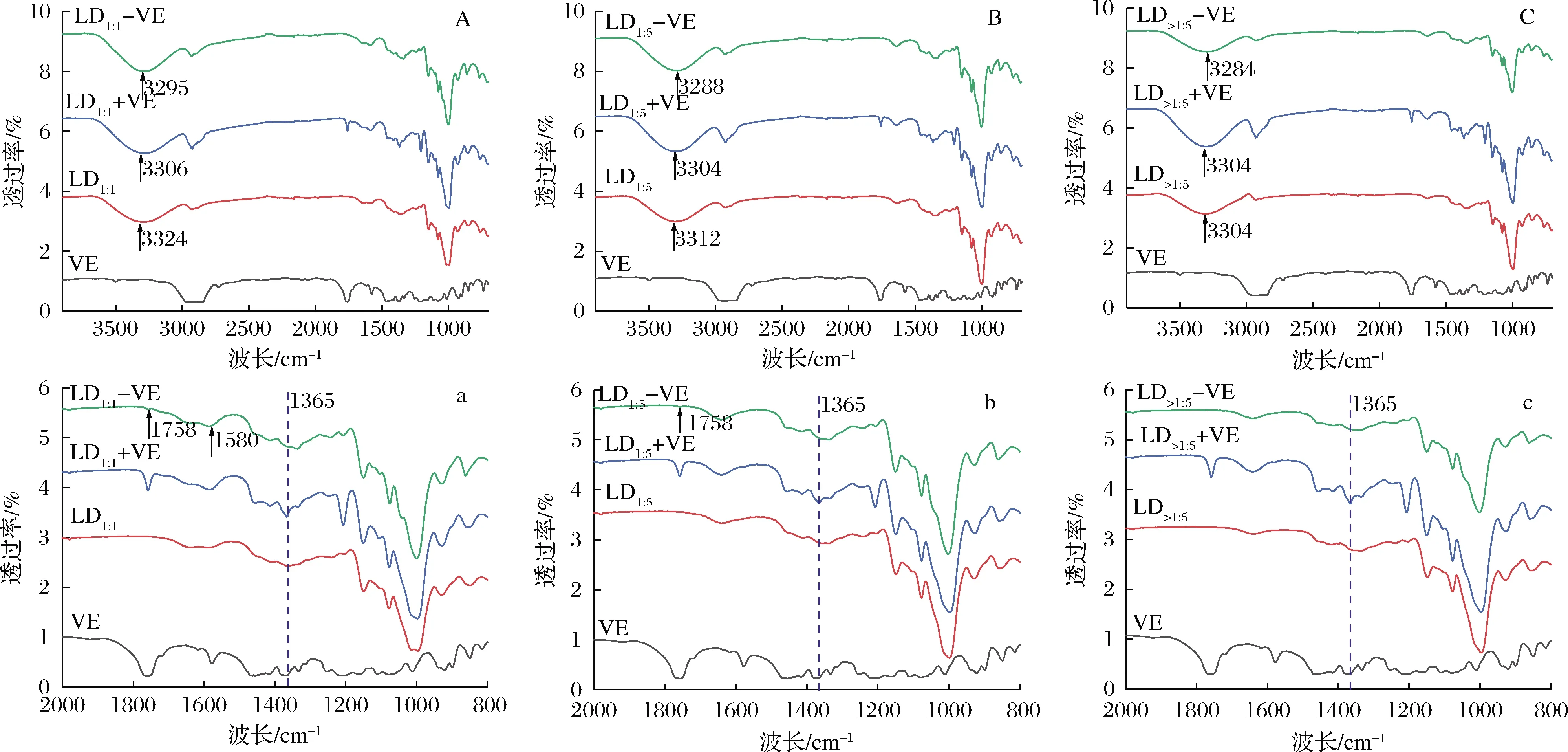
LD-VE-直鏈糊精與維生素E復合物;LD+VE-直鏈糊精與維生素E的物理混合物;圖中a,b和c分別為A,B和C細節放大圖

2.3.2 XRD分析
圖4為LD和LD-VE的XRD譜圖。LD1∶1、LD1∶5和LD>1∶5在5.6、14、17和22.3°附近出現衍射峰,表明直鏈糊精為較弱的B-型結構。維生素E的X-射線衍射圖譜呈現一個大而寬的晶胞,表明其具有非結晶性、無定形的特性。復合物在5.7、17、19.5和22°等處出現衍射峰,呈現較弱的B-+V-型結構。LD1∶1-VE、LD1∶5-VE和LD>1∶5-VE的相對結晶度分別為26.5%、33.7%和41.9%,說明鏈長較長的直鏈糊精與維生素E形成的結晶結構更緊密,與負載量結果一致。

圖4 不同鏈長直鏈糊精及其與維生素E復合物的XRD圖譜
2.4 直鏈糊精-VE復合物耐熱穩定性分析
采用TGA分析LD-VE耐熱穩定性,如圖5所示。LD1∶1呈現雙裂解峰,峰值溫度分別是233和298 ℃,LD1∶1-VE峰值溫度分別為249和305 ℃。LD1∶5和LD>1∶5的失重表現為2個階段,第1階段是結合水減少造成的失重,第2階段是直鏈糊精熱降解造成的失重。LD1∶5和LD>1∶5的裂解峰值溫度分別為312和318 ℃,復合物在熱降解階段后移形成更高的裂解溫度,分別為318和321 ℃。結果表明LD與維生素E復合提高了維生素E耐熱穩定性。

圖5 直鏈糊精與直鏈糊精-VE復合物的TGA分析
2.5 直鏈糊精-維生素E復合物耐光穩定性分析
維生素E中存在酚羥基和β-二酮基團,使其對光較敏感[14]。如圖6所示,隨著照射紫外線的時間的增加,所有樣品的維生素E保留率都有所下降,經過48 h的紫外光照射后,游離維生素E的保留率僅為59.52%,而復合后的維生素E保留率分別為78.73%(LD1∶1)、82.01%(LD1∶5)和89.19%(LD>1∶5),說明直鏈糊精對維生素E起到了保護作用,顯著提高了其耐光穩定性。鏈長長的直鏈糊精與維生素E之間的相互作用更強,復合物的結構更加緊密,從而具有更強的保護作用。

圖6 游離VE和不同鏈長直鏈糊精-維生素E復合物的光降解曲線
3 結果與討論
制備了不同鏈長直鏈糊精與維生素E復合物,發現直鏈糊精對維生素E的負載量和包埋率受直鏈糊精鏈長的影響,長鏈直鏈糊精對維生素E負載量和包埋率高于短鏈的直鏈糊精。直鏈糊精與維生素E通過氫鍵作用形成復合物,且鏈長長的直鏈糊精與維生素E形成的復合物更穩定。復合物的形成提高了維生素E的耐熱、耐光穩定性,長鏈直鏈糊精(LD>1∶5)對維生素E的保護效果優于短鏈(LD1∶1和LD1∶5),為不同鏈長直鏈糊精包埋疏水性客體分子提供了指導,有望擴大不同鏈長直鏈糊精在包埋領域的應用。

