初發多囊卵巢綜合征合并糖耐量減低患者臨床干預前后性激素及糖脂代謝指標變化情況分析
楊 茜,張俊飛,牛 帥,馬靜靜,周 雪,李志紅
保定市第一中心醫院:1.營養科;2.內分泌二科,河北保定 071000
多囊卵巢綜合征(PCOS)是育齡期女性常見的婦科內分泌疾病,主要臨床特征為胰島素抵抗(IR)、高雄激素血癥(HA),以多毛或痤瘡、月經周期不規律、不孕等為主要臨床表現[1-2]。相關研究表明,40%左右的PCOS患者伴有糖耐量異常(AGT),其中糖耐量減低(IGT) 發生率為30%左右,所以PCOS合并IGT已成為臨床研究的熱點[3]。目前,常通過改善糖脂代謝、降低雄激素水平、運動減重等手段對初發PCOS合并IGT患者進行治療,以改善性激素水平、糖脂代謝及妊娠結局[4-5]。目前研究多報道PCOS 患者治療前后性激素水平或IGT患者治療前后血糖糖脂代謝變化,少有初發PCOS合并IGT患者相關報道,本研究通過觀察初發PCOS合并IGT患者臨床干預前后血清卵泡生成素(FSH)、雌激素(E2)、促黃體生成素(LH)、睪酮(T)、空腹血糖(FPG)、空腹胰島素(FIN)、三酰甘油(TC)、總膽固醇(TG)水平變化情況,并分析PCOS患者發生AGT 的危險因素,為疾病遠期并發癥的預防及治療提供依據。
1 資料與方法
1.1一般資料 選取2018年2月至2020年2月于本院就診的初發PCOS合并IGT患者100例作為研究組,年齡23~38歲,平均(27.46±4.67)歲;初發PCOS不合并IGT患者50例,年齡24~36歲,平均(27.95±5.57)歲。PCOS診斷標準[6]:(1)無排卵或稀發排卵;(2)高雄激素臨床表現或高雄激素血癥;(3)超聲檢查結果提示卵巢發生多囊改變,至少一側卵巢體積≥10 cm3和(或)一側卵巢出現≥12個直徑 2~9 mm 的小卵泡;(4)排除庫欣綜合征、先天性腎上腺皮質增生等其他高雄激素病因。符合3 項中2項即可確診為PCOS。IGT診斷標準[7]:6.1 mmol/L≤FPG<7.0 mmol/L,且口服葡萄糖耐量試驗(OGTT)服糖后 2 h,7.8 mmol/L≤FPG<11.1 mmol/L,排除藥物因素、其他應激等引起血糖增高。研究組納入標準:(1)符合PCOS合并IGT診斷標準患者;(2)初發患者。排除標準:(1)原發性內分泌性疾病患者;(2)其他雄激素過多性疾病患者;(3)近3個月內接受過激素等藥物治療患者;(4)伴有其他婦產科疾病患者;(5)妊娠患者。另選取同期在本院體檢健康者50例作為健康對照組,年齡23~37歲,平均(27.80±5.12)歲。3組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會審查通過,所有患者均簽署知情同意書。
1.2方法
1.2.1治療方法 研究組患者采用個體化飲食干預及口服鹽酸二甲雙胍片等治療。制訂以低碳水化合物為核心的限能量食譜,每天攝入的總能量為實際體質量×(20~25)kcal×70%,依據個體情況酌情調整。宏量營養素(碳水化合物、蛋白質、脂肪)供能比例為碳水化合物20%~30%,蛋白質30%~40%,脂肪40%~45%,按此原則制訂個性化食譜。口服鹽酸二甲雙胍片(中美上海施貴寶制藥有限公司,國藥準字H20023370,規格:每片0.5 g),每次0.5 g,每天3次,隨餐服用,持續治療3個月。
1.2.2觀察指標 性激素水平:采集3組受試者肘靜脈血 5 mL,采用全自動生化免疫分析儀(美國雅培公司,型號:CI8200)測定FSH、LH、E2和T水平。糖脂代謝指標水平:采用葡萄糖氧化法測定FPG水平,采用化學發光法測定FIN水平, 采用全自動生化分析儀測定TG和TC水平,所有具體操作均嚴格按照說明書進行。
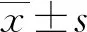
2 結 果
2.1干預前3組血清FSH、E2、LH、T、FPG、FIN、TC、TG水平比較 研究組血清FSH、LH、T、FPG、FIN、TC、TG水平明顯高于疾病對照組和健康對照組,血清E2水平明顯低于疾病對照組和健康對照組,差異均有統計學意義(P<0.05);疾病對照組血清FSH、LH、T水平顯著高于健康對照組,血清E2水平顯著低于對照組,差異有統計學意義(P<0.05),疾病對照組血清FPG、FIN、TC、TG水平與健康對照組比較,差異無統計學意義(P>0.05)。見表1。

表1 干預前3組血清FSH、E2、LH、T水平及FPG、FIN、TC、TG水平比較
2.2研究組患者干預前后血清FSH、E2、LH、T、FPG、FIN、TC、TG水平比較 研究組患者干預后血清FSH、LH、T、FPG、FIN、TC、TG水平明顯低于干預前,血清E2水平明顯高于干預前,差異均有統計學意義(P<0.05)。見表2。

表2 研究組患者干預前后血清FSH、E2、LH、T水平及FPG、FIN、TC、TG水平比較
2.3初發PCOS合并IGT的多因素Logistic回歸分析 以是否并發IGT作為因變量,將具有統計學意義的危險因素行多因素Logistic回歸分析,結果顯示,TG、FPG、FIN是初發PCOS合并IGT的危險因素(OR=2.957、2.278、2.759,P<0.05)。

表3 初發PCOS合并IGT的多因素Logistic回歸分析
3 討 論
40%~60%初發PCOS合并IGT患者表現為肥胖,并且伴有內分泌紊亂,主要包括胰島素抵抗、高雄激素血癥、促性腺激素的變化、高胰島素血癥、高LH水平,以及低水平或正常的FSH[8]。體內雄激素通過外周脂肪細胞的作用能夠轉化為雌酮,卵泡分泌的E2及持續無周期性分泌的雌酮作用于垂體及下丘腦,對LH的分泌為正反饋,LH處于無周期性持續高水平狀態,在月經周期中無LH峰,所以無排卵發生,從而導致內分泌紊亂[9-10]。PCOS合并IGT患者多伴有糖脂代謝異常,雄激素能夠增強脂蛋白酯酶的活性,抑制血清中低密度脂蛋白(LDL)的分解,使LDL和TG水平升高,并且雄激素能夠增加機體中TC的活性,使高密度脂蛋白(HDL)水平下降。相關研究表明,雄激素所引起的糖脂代謝異常可能是由于肥胖所引起的,特別是向心性肥胖[11]。向心性肥胖患者的內臟脂肪具有較強的脂肪生成與脂解作用,使TG合成速度增加、水平升高,并且它還能導致脂蛋白酶的活性發生改變,使膽固醇的合成加速[12-13]。PCOS 合并 IGT 患者的胰島素分泌相對增多,從而導致體內脂肪合成增多,引起高三酰甘油血癥、高膽固醇血癥,以及LDL、游離脂肪酸的增多,其機制可能與肝臟內胰島素代謝失常密切相關。IGT 患者多伴有較重的胰島素抵抗及FPG、FIN水平異常,并且能夠降低脂肪細胞膜上受體對胰島素的敏感性,使抗脂解的作用減弱,導致進入肝臟與血漿中的游離脂肪酸水平增多,并伴有脂蛋白酶活性下降,所以導致 TG、極低密度脂蛋白(VLDL)的清除能力下降。低密度脂蛋白膽固醇(LDL-C)是 VLDL 水解的終產物,所以VLDL 升高最終使 LDL-C 水平升高[14]。目前臨床上常通過改善糖脂代謝、降低雄激素水平等手段治療初發PCOS合并IGT,本研究采用個體化飲食干預及口服鹽酸二甲雙胍片治療初發PCOS合并IGT,分析臨床干預前后患者血清FSH、E2、LH、T水平及FPG、FIN、TC、TG水平變化,并預測 PCOS 患者發生 IGT 的危險因素[15-16]。
本研究結果表明,研究組血清FSH、LH、T水平及FPG、FIN、TC、TG水平明顯高于疾病對照組和健康對照組,血清E2水平明顯低于疾病對照組和健康對照組,差異均有統計學意義(P<0.05);疾病對照組血清FSH、LH、T水平明顯高于健康對照組,血清E2水平明顯低于對照組,差異有統計學意義(P<0.05),疾病對照組血清FPG、FIN、TC、TG水平與健康對照組差異無統計學意義(P>0.05),提示初發PCOS合并IGT患者伴有性激素、糖脂代謝均有異常。研究組患者干預后血清FSH、LH、T水平及FPG、FIN、TC、TG水平明顯低于干預前,血清E2水平明顯高于干預前,差異均有統計學意義(P<0.05),提示干預后能夠調節患者性激素水平、改善糖脂代謝。多因素Logistic回歸分析結果顯示,TG、FPG、FIN是初發PCOS合并IGT的危險因素(OR=2.957、2.278、2.759,P<0.05)。
本研究發現,治療前初發PCOS合并IGT患者性激素水平、糖脂代謝均有異常,干預后患者血清FSH、LH、T水平明顯升高,血清E2水平明顯降低,血清FPG、FIN、TC、TG水平明顯降低,提示調節性激素水平、改善糖脂代謝可能在初發PCOS合并IGT患者的病情改善中發揮積極作用。

