HDAC1(Rpd3)在疾病中的功能研究進展
吳文梅 李華琴 黃源 吳風麟 張榮信★
作者單位:1.廣東藥科大學生命科學與生物制藥學院/廣東省生物技術候選藥物研究重點實驗室,廣東,廣州510006
2.廣州新華學院,廣州,廣東510520
蛋白質修飾是指蛋白質在生物合成后所發生的化學修飾,也稱為翻譯后修飾(posttranslational modification,PTM)。迄今為止,在真核生物和原核生物中已經發現200 多種以上的PTM 類型,主要修飾包括乙酰化、磷酸化、SUMO 化、糖基化、泛素化、棕櫚酰化、脂化等[1?2]。乙酰化作為翻譯后修飾方式之一,近幾年在疾病中的功能研究取得了突破性進展。蛋白質的乙酰化修飾是指通過組蛋白乙酰基轉移酶(Histone acetyltransferase,HATs)將乙酰基輔酶A 轉移到賴氨酸的ε?氨基側鏈而產生的,這個過程可以被組蛋白去乙酰化酶(histone deacetylase,HDACs)逆轉。HDAC1(Rpd3)作為組蛋白去乙酰化酶家族成員之一,通過催化底物組蛋白賴氨酸的去乙酰化,使染色質結構更為緊密,或者與其他染色質調節蛋白相互作用形成共抑制復合體,改變蛋白質的空間結構,進而參與調控基因表達、細胞分裂、細胞分化和細胞周期等生命過程[3]。此外,HDAC1(Rpd3)還可介導非組蛋白底物賴氨酸位點的去乙酰化,在細胞信號通路中發揮著重要作用[4]。本文主要總結HDAC1 在疾病中的功能研究和HDACs 抑制劑在診斷、治療疾病中的應用情況。
1 組蛋白去乙酰化酶的分類和HDAC1 的結構及生物學功能
根據組蛋白去乙酰化酶的作用機制不同,可分為Zn+依賴的HDACs(包括HDAC1、?2、?3、?8、?4、?5、?7、?9、?6、?10、?11)和NAD+依賴的Sirtuin 家族組蛋白去乙酰化酶(包括SIRT1、?2、?3、?4、?5、?6、?7)(表1)[3]。在人體中,現已發現18 種Zn+依賴的HDACs,并根據其序列同源性和結構的不同共分為4 類(Ⅰ、Ⅱa、Ⅱb、Ⅳ),Ⅰ類HDACs 包括HDAC1、?2、?3 和?8,其中HDAC1 在酵母和鱗翅目昆蟲中的同源蛋白為Rpd3;Ⅱa 類HDACs 包括HDAC4、?5、?7 和?9;Ⅱb 類HDACs 包括HDAC6 和?10;Ⅳ類HDACs 只含HDAC11 一個成員。其余的HDACs,包括了轉錄因子TCF1 和LEF1。見表1。

表1 組蛋白去乙酰化酶的分類Table 1 Classification of histone deacetylation
HDAC1/Rpd3 是Zn+依賴的HDACs 家族中最大的一個亞家族,含有一個典型的組蛋白去乙酰化酶結構域,能夠催化組蛋白或者非組蛋白底物發生去乙酰化。
2 HDAC1 蛋白在疾病中的功能研究
2.1 HDAC1 和炎癥
炎癥是指機體在受到化學物質、病原體等有害刺激或物理損傷時組織或細胞產生的即時反應[5]。研究發現HDAC1 在炎癥發生的過程中是一個重要的炎癥調節因子。如在類風濕性關節炎(Rheumatoid Arthritis,RA)的研究發現HDAC1 參與了類風濕性關節炎的發病機制,RA 是一種慢性T 細胞介導的炎癥性自身免疫性疾病,在細胞特異性缺失HDAC1(HDAC1? cko)的小鼠中研究發現HDAC1?cko 小鼠對膠原誘導關節炎的發展具有抗性作用,能夠使炎癥細胞因子白細胞介素?17 和白細胞介素?6 顯著降低,且白細胞介素?6 處理的敲除HDAC1 的CD4+T 細胞顯示趨化因子受體CCR6 上調受損,說明HDAC1 在關節炎發病機制中起著關鍵作用,可成為治療RA 的靶點[6]。在肝臟脂肪變性的發病機制中,轉錄因子核因子κB(nuclear factor κB,NF?κB)的P50 亞基通過調節肝細胞中的HDAC1 表達促進肝臟脂肪變性,而敲低HDAC1基因可抑制HepG2 細胞的肝細胞脂肪變性[7]。此外研究發現組蛋白去乙酰化酶HDAC1通過翻譯后修飾如磷酸化、乙酰化修飾來參與炎癥過程。在腸道上皮細胞研究發現,HDAC1 能夠誘導NF?κB 的p65 蛋白位點Ser536 和C/EBPβ 位點Ser105 的磷酸化,參與的炎癥信號傳導[8]。對動脈粥樣硬化的研究發現,microRNA?34a 能夠降低HDAC1 的蛋白表達,從而使H3K9 乙酰化水平升高促進同型半胱氨酸引起動脈粥樣硬化[9]。以上研究說明對HDAC1基因的功能研究可為治療炎癥提供一個新的策略與手段。
2.2 HDAC1 和自噬
細胞自噬是真核生物機體中高度保守存在的、由溶酶體/液泡參與的對胞內物質進行降解的生理過程,細胞自噬發生異常與血管鈣化、糖尿病、腫瘤等一系列的疾病有關聯[10]。研究發現HDAC1 可以使循環GMP?AMP 合酶和賴氨酸去甲基化酶1A 發生去酰化后促進自噬的發生進而調節血管鈣化[11?12]。在糖尿病視網膜病變中,過表達組蛋白人源全長重組蛋白HIST1H1C 可上調HDAC1的表達,HDAC1 使組蛋白H4K16 發生去乙酰化,導致自噬相關蛋白上調,進而促進視網膜細胞自噬,為預防糖尿病視網膜病變提供一個新的治療靶點[13]。以上研究說明HDAC1 蛋白參與調控細胞自噬的發生,進而參與生命過程的發生發展。
2.3 HDAC1 和凋亡
細胞凋亡,又稱為Ⅰ型程序性細胞死亡,是需要多種Caspase 蛋白或者凋亡誘導因子的參與,凋亡異常可以影響細胞周期、生長發育和導致各種疾病[14]。在卵巢癌耐藥細胞SKOV3/DDP 中,對HDAC1 進行siRNA 干擾,可以降低表皮生長因子受體的mRNA 表達水平,同時促進癌癥細胞凋亡[15]。在結直腸癌細胞Caco2 中,轉染siRNA 的HDAC1 能夠顯著降低HDAC1 的mRNA 和蛋白水平,Bax、Cleaved caspase?3 蛋白水平升高,細胞凋亡率明顯升高,細胞內MMP?2、MMP?9 蛋白水平表達下降,細胞侵襲和遷移數目明顯減少[16]。在癌癥干細胞K562 和SW579 細胞中(慢性骨髓性白血病細胞系),利用CRISPR/Cas9 敲除HDAC1 能夠使組蛋白乙酰化水平和細胞周期阻滯增強,進而誘導細胞凋亡的發生,說明HDAC1 在維持K562 和SW579 細胞存活中極為重要[17?18]。了解HDAC1 參與細胞凋亡調控疾病的發生,有助于提高對疾病的治療和診斷。
2.4 HDAC1 和癌癥
癌癥,即惡性腫瘤,是一百多種相關疾病的統稱。形成的主要原因是由于身體內的細胞發生變異后不斷地增殖分裂,且不受身體的控制,最后形成腫瘤,惡性腫瘤會侵犯、破壞臨近的組織和器官[19]。在人類的癌癥中,HDAC1 被認為與某些類型癌癥的進展和預后干預有關。在卵巢癌細胞中,MiR?34a 通過調控HDAC1 抑制卵巢癌細胞增殖和順鉑耐藥性[20]。在非小細胞肺癌中,敲低HDAC1 可抑制細胞增殖,阻止細胞遷移,降低細胞侵襲,減少腫瘤血管生成,誘導細胞凋亡[21]。在乳腺癌細胞中,HDAC1 通過上調白細胞介素?8 觸發乳腺癌細胞的增殖和遷移[22]。此外,在細胞應激過程中,HDAC1能夠使腫瘤抑制因子p53 發生去已酰化,降低細胞對應激的反應[23]。在骨質疏松癥中,HDAC1 使成骨細胞分化和礦化相關蛋白GATA4 位點的K313發生去乙酰化,抑制CCND2 轉錄,降低了細胞活力,增加了線粒體依賴性的細胞凋亡[24]。除發揮乙酰化修飾功能外,HDAC1 能直接抑制缺氧誘導因子(Hypoxia inducible factor,HIF1α)的泛素化,進而激活HIF1α/血管內皮生長因子A(vascular endothe?lial growth factor A,VEGFA)信號通路,促進腫瘤血管生成,HDAC1/HIF1α/VEGFA 信號通路可能為結直腸癌提供一個新的治療靶點[25]。以上研究說明Rpd3/HDAC1 可作為癌癥治療的潛在候選位點。
3 HDACs 抑制劑在診斷和治療中的應用情況
人類眾多疾病中,特別是癌癥,HDACs 的表達通常是異常的,組蛋白去乙酰化酶抑制劑(histone deacetylase inhibitors,HDACIs)可有效逆轉腫瘤細胞的惡性表型,其不僅可以作用于靶向組蛋白,而且能夠通過影響靶向非組蛋白的乙酰化水平來調節細胞周期阻滯、血管生成、免疫調節、自噬和凋亡等一系列生命過程,可成為治療癌癥的有效靶點,應用前景廣泛[26]。HDACs 作用的底物眾多,目前已經鑒定到的包括轉錄因子(E2F、p53、c?Myc、NF?κB)、缺氧誘導因子1α、雌激素受體、雄激素受體、自噬相關蛋白3、分子伴侶蛋白90、α?微管蛋白、β?連環蛋白、視網膜母細胞瘤蛋白等[27]。由于HDACs 底物的復雜性和不單一性,使得HDACIs 在診斷治療過程中缺乏特異性,會對細胞產生副作用。
到目前為止,已有超過20 種HDACIs 進入臨床研究,根據其化學結構特征,可以將這些抑制劑可分為4 大類,包括羥肟酸、苯甲酰胺、環肽和短鏈脂肪酸,如伏立司他(Vorinostat)和曲古抑菌素A(trichostatin A,TSA)屬于羥肟酸類,羅米地辛屬于環肽類,其中探索最廣泛的是羥肟酸類化合物[28]。這些HDACIs 不僅可以使組蛋白乙酰化水平增加,還可以作用于不同的底物和蛋白來調節生命過程。在小鼠和人肺癌細胞系和基因工程小鼠肺癌模型中研究發現,Vorinostat 通過減少了癌細胞生長、細胞周期蛋白cyclin D1 和cyclin E 的表達,增加了p27 蛋白和組蛋白乙酰化的的表達水平,從而促進細胞凋亡,抑制癌細胞生長[29]。除參與細胞凋亡和細胞周期外,Vorinostat 也抑制人CD14(+)單核細胞來源的樹突狀細胞的分化、成熟和內吞作用,減少中樞神經系統炎癥和脫髓鞘,改善自身免疫性腦脊髓炎[30]。自噬也可作為HDACIs 的一個未知靶點,如在心臟可塑性的研究發現,TSA 通過降低HDAC1 和HDAC2 的表達,抑制細胞自噬的發生,從而減弱負荷和激動劑誘導的肥厚生長[31]。以上研究說明HDACIs 具有廣泛抑制HDACs 的功能,通過多種途徑參與疾病的治療(圖1)。
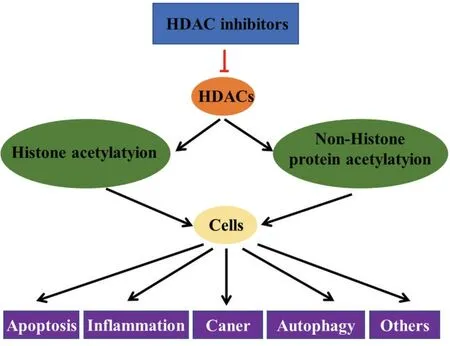
圖1 HDACs 抑制劑通過多種途徑參與生命過程Figure 1 Multiple pathways activated by HDACi
4 小結與展望
綜上所述,HDAC1 蛋白作為組蛋白去乙酰化酶家族成員之一,是調控基因表達的關鍵酶。對于HDAC1(Rpd3)的研究進展還有一些問題值得進一步闡明研究:①HDAC1 作為轉錄因子參考調控炎癥的發生,其下游的作用因子有哪些,這些基因與HDAC1 啟動子區翻譯后修飾的關系;②HDAC1 參與調控哺乳動物細胞自噬和細胞凋亡的發生,是否存在關鍵的節點;③HDAC1參與癌癥的發生,其能否通過影響其他蛋白的乙酰化修飾來其能作為抗腫瘤治療的靶蛋白有待深入探討;④HDAC1蛋白去乙酰化修飾與其他翻譯后修飾之間是否存在相互影響等;⑤HDAC 特異性抑制劑的開發能否利用計算機建模工具,如對接和分子動力學模擬,提供目標酶和抑制劑之間的分子水平的相互作用,減少細胞毒性。對于研究HDAC1 及其底物的去乙酰化修飾的功能研究和HDACs 抑制劑的開發必將闡明其在各個信號通路中的生物學作用,同時也為相關疾病的預防、診斷、治療奠下理論基礎。

