類風濕關節(jié)炎患者外周血腱糖蛋白C與CD4+T細胞亞群的關系
王 霞 謝戩芳 柏歡歡 張文琦 郝 楠
類風濕關節(jié)炎(rheumatoid arthritis, RA)是一種慢性進行性自身免疫性疾病,其特征為滑膜炎與血管翳形成,關節(jié)軟骨和骨破壞,最終導致關節(jié)畸形和功能喪失[1]。RA的發(fā)生、發(fā)展是諸多淋巴細胞異常作用的結果,其中CD4+T細胞亞群的失衡是導致RA發(fā)病的重要因素[2]。腱糖蛋白C(tenascin-C,TN-C)是一種與組織損傷和重塑相關的細胞外基質糖蛋白,在健康成人組織中的表達非常有限,而在急性炎癥刺激下可特異性表達上調,在慢性炎癥及組織重塑過程中持續(xù)的高表達,參與包括RA在內的多種疾病的發(fā)病[3~5]。然而,在RA中TN-C與CD4+T細胞亞群的關系尚不清楚。本研究主要通過觀察RA患者外周血TN-C的表達情況,分析其與CD4+T細胞亞群的關系。
資料與方法
1.研究對象:選取2019年1月~2020年1月山西醫(yī)科大學第二醫(yī)院收治的RA患者130例,其中男性41例,女性89例,患者平均年齡53.66±14.01歲。所有患者均符合2010年ACR/EULAR的RA分類標準,排除合并其他自身免疫疾病、有嚴重器官衰竭、感染以及腫瘤患者、嚴重精神類疾病無法正常溝通者[6]。選擇性別、年齡匹配的健康體檢者40例為對照組。
2.臨床資料:收集RA患者性別、年齡、腫脹關節(jié)數(shù)(SJC)及壓痛關節(jié)數(shù)(TJC)等一般資料,RF、抗CCP抗體、抗核周因子抗體(APF)、抗角蛋白抗體(AKA)、葡萄糖6磷酸異構酶(GPI)、紅細胞沉降率(ESR)、C反應蛋白(CRP)、CD4+T細胞亞群(Th17細胞、Treg細胞)等相關化驗指標。同時計算與疾病活動相關的DAS28-ESR評分,將RA患者分為緩解組28例(DAS28≤2.6)和活動組102例(DAS28>2.6)[7]。
3.血清TN-C水平的檢測:晨起空腹抽取所有受試者肘靜脈血5ml,離心分離血清。采用ELISA檢測血清TN-C水平,試劑盒購自美國Cloud-Clone公司。所有步驟均按照儀器規(guī)范和試劑說明書進行。
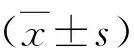
結 果
1.血清TN-C水平的比較:(1)RA患者與對照組血清TN-C比較:RA患者血清TN-C水平顯著高于對照組(50.04±8.10ng/ml vs 40.58±4.38ng/ml,P=0.000)。其中活動期RA患者血清TN-C水平高于緩解期(50.58±8.31ng/ml vs 48.05±7.08ng/ml),但差異無統(tǒng)計學意義(P>0.05,表1)。(2)RA患者自身抗體陽性組與陰性組TN-C比較:RA患者中RF、抗CCP抗體、APF、AKA和GPI的陽性數(shù)分別為91、89、76、72和24例,陽性率依次為70.0%、68.5%、58.5%、55.4%和18.5%;其中RF、抗CCP抗體陽性血清TN-C高于陰性患者(51.23±8.12ng/ml vs 47.25±7.45ng/ml,51.11±8.06ng/ml vs 47.71±7.79ng/ml,P<0.05),血清TN-C水平與APF、AKA、GPI等比較,差異無統(tǒng)計學意義 (P>0.05,表2)。

表1 RA組與對照組血清TN-C水平比較

表2 RA患者自身抗體陽性組與陰性組血清TN-C水平比較
2.ROC曲線分析TN-C價值:TN-C的AUC為0.89,敏感度為63.10%,特異性為95.00%,95% CI為0.79~0.91(圖1)。

圖1 血清TN-C水平的ROC分析結果
3.RA患者與對照組外周血CD4+T細胞亞群比較:通過 ROC曲線確定RA患者血清TN-C的臨界值為46.93ng/ml,根據(jù)該臨界值,將RA患者分為TN-C正常組(n=35)和TN-C升高組(n=95),并與對照組比較所對應的CD4+T細胞亞群計數(shù)及百分比。3組間Treg細胞計數(shù)及百分比、Th17/Treg比值比較,差異有統(tǒng)計學意義(P<0.01);與對照組比較,TN-C升高組Treg細胞計數(shù)及百分比降低,Th17/Treg比值升高(P<0.01),而TN-C正常組的Treg細胞計數(shù)及百分比、Th17/Treg比值比較,差異無統(tǒng)計學意義(P>0.05);與TN-C正常組比較,TN-C升高組Treg細胞計數(shù)及百分比降低,Th17/Treg比值升高(P<0.01,表3)。

表3 3組外周血Th17、Treg細胞及Th17/Treg比較[M(Q1,Q3)]
4.血清TN-C與CD4+T細胞亞群、臨床指標的相關性分析:Spearman相關分析顯示,RA患者血清TN-C水平與Treg細胞計數(shù)及百分比呈負相關 (r=-0.368、-0.237,P<0.01),與Th17/Treg比值呈正相關(r=0.229,P<0.05)。與Th17細胞計數(shù)及百分比、ESR、CRP、SJC、TJC、DSA28均無相關性(表4)。
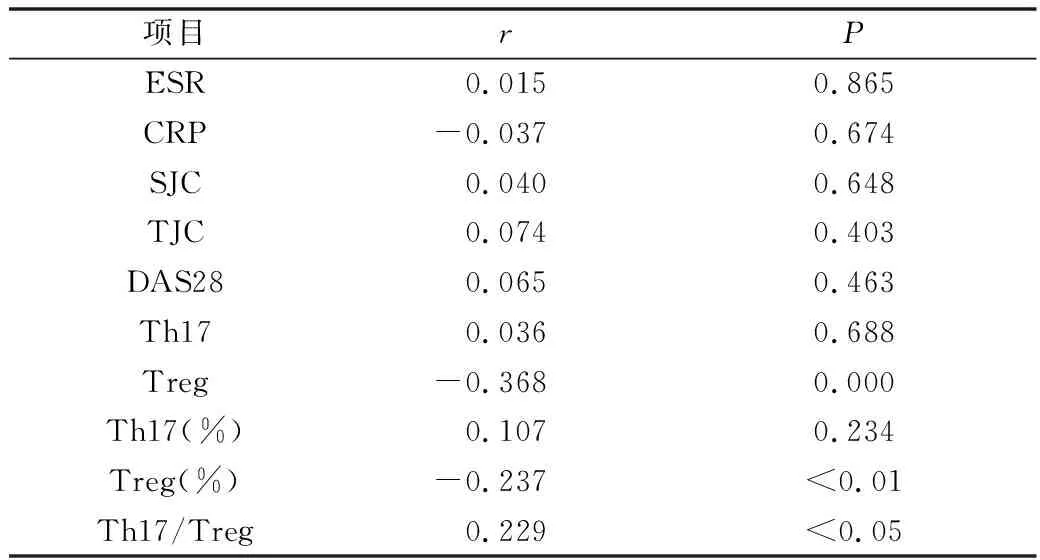
表4 RA患者血清TN-C相關性分析
結 果
RA是一種以慢性滑膜炎、關節(jié)進行性破壞為特征的自身免疫性疾病,具有病程長、致殘率高、易反復等特點。目前其發(fā)病機制尚不明確,免疫細胞功能紊亂參與RA發(fā)病已達共識,其中Th17細胞和Treg細胞免疫失衡為關鍵環(huán)節(jié)[8]。然而,導致這種失衡的始動因素和調控機制目前尚不清楚。因此,探究RA發(fā)病機制,尋找新的有效治療方法始終是國內外研究關注的熱點。
TN-C是一種存在于細胞外基質的糖蛋白,是腱糖蛋白家族中發(fā)現(xiàn)最早且最重要的成員,可因mRNA的選擇性剪接導致性質及分子量的變化而發(fā)揮不同的生物學功能。TN-C在健康成人組織中幾乎不表達,但在血管形成、傷口愈合、腫瘤發(fā)生及炎癥等過程中表達增加[9]。TN-C的表達受多種生長因子、細胞因子、血管活性多肽、細胞外基質蛋白及生物力學因素的調節(jié)[10]。研究發(fā)現(xiàn)RA患者滑液中TN-C水平較健康成人及骨關節(jié)炎患者明顯升高[11]。進一步研究發(fā)現(xiàn),RA滑膜成纖維細胞及巨噬細胞中TN-C mRNA的水平較其他細胞明顯升高,提示此兩種細胞可能與TN-C的合成有關[12]。另有研究發(fā)現(xiàn),在小鼠的關節(jié)腔內注入TN-C后可以誘導滑膜炎癥的形成,同時TN-C缺陷型小鼠較野生鼠來說炎癥的嚴重程度更輕且更容易從關節(jié)炎癥中康復[13]。此外,體外培養(yǎng)的滑膜組織中加入TN-C可促進IL-6、IL-8、TNF-α等細胞因子的產生[14]。本研究發(fā)現(xiàn),RA患者血清TN-C高表達,這與既往研究結果相似[15]。然而,活動期RA患者血清TN-C水平僅略高于緩解期,且未發(fā)現(xiàn)血清TN-C與RA患者急性期反應物(ESR、CRP)呈相關性,提示TN-C可能通過與炎癥無關的機制在RA的發(fā)病機制中發(fā)揮作用,或者是由于筆者研究的樣本量較少,仍需擴大樣本量開展進一步研究予以證實。通過ROC曲線分析TN-C診斷價值,AUC 為0.89,敏感度為63.10%,特異性為95.00%。敏感度雖不及RF、抗CCP抗體,但其特異性顯著增強,在RA臨床診斷上或許可當作一種潛在的輔助檢測項目。
相關研究表明,TN-C主要在RA中作為一種損傷相關分子模式與相應受體結合發(fā)揮作用。TN-C的纖維蛋白原樣球狀結構域可與滑膜成纖維細胞及巨噬細胞表面的TLR4結合,通過細胞內信號轉導途徑誘導多種促炎性因子如IL-6、IL-8、TNF-α的產生,而促炎性因子的產生又可促進TN-C的釋放,由此形成一個惡性炎癥循環(huán),介導持續(xù)性滑膜炎癥和組織破壞[16]。TN-C的表皮生長因子樣重復結構域及纖連蛋白Ⅲ結構域3~8的TN-C片段可誘導糖胺多糖釋放和聚蛋白多糖酶活性,導致軟骨基質的降解[17]。臨床研究發(fā)現(xiàn),RA患者血清TN-C表達水平與多普勒超聲關節(jié)骨侵蝕評分相關[18]。RF、抗CCP抗體是目前RA臨床診斷、病情嚴重程度及預后常用指標,此外抗CCP抗體陽性比陰性RA患者易發(fā)生嚴重的關節(jié)骨破環(huán)。本研究發(fā)現(xiàn),RF、抗CCP抗體陽性患者血清TN-C水平分別高于陰性患者,提示TN-C可能對RA骨侵蝕早期診斷和病情評估具有較高的價值。目前有關TN-C在RA中作用機制的研究尚處于初級階段,僅涉及與細胞表面受體的作用。既往研究表明,TN-C與其他細胞外基質蛋白及細胞間黏附因子相互作用在細胞移動、細胞外骨架形成等方面有重要意義[19]。RA中TN-C的作用有待于開展分子生物學方面的研究,同時TN-C的臨床意義也需開展更多臨床實驗予以證實。
隨著TN-C相關研究的不斷深入,TN-C可能通過與樹突狀細胞(dendritic cells, DCs)表面受體結合,促進病理性Th17細胞分化,誘導IL-17的合成[20]。Machino-Ohtsuka等[21]研究發(fā)現(xiàn),TN-C通過激活DCs和Th17細胞分化加重自身免疫性心肌炎。Mina等[22]研究發(fā)現(xiàn),TN-C可誘導支氣管上皮Th2細胞釋放大量IL-4、IL-13,導致哮喘的發(fā)生。也有研究表明,三陰性乳腺癌患者高表達的TN-C與預后不良相關,與CD8+T細胞呈負相關。本研究中與對照組、TN-C正常組比較,TN-C升高組Treg細胞及百分比降低,Th17/Treg比值升高。此外,Spearman相關分析顯示,RA患者血清TN-C水平與Treg細胞計數(shù)及百分比呈負相關,與Th17/Treg比值呈正相關。以上研究可知,Treg細胞數(shù)量變化、Th17/Treg比值失衡能引起機體免疫反應的異常,導致RA的發(fā)生。此外,TN-C可能在調節(jié)Treg細胞分化和Th17/Treg免疫平衡中發(fā)揮重要作用。
綜上所述,RA 患者血清TN-C高表達,外周血Th17/Treg失衡,TN-C可能通過影響Th17/Treg免疫平衡參與 RA 過程,但二者之間的機制有待于進一步研究。

