肉芽腫性小葉性乳腺炎研究進展
蘭柳逸,馮秦玉,周 瑞,袁芊芊,廖亦秦,鄭樂葳,吳高松
武漢大學中南醫院甲狀腺乳腺外科(武漢 430071)
肉芽腫性小葉性乳腺炎(granulomatous lobular mastitis,GLM)又稱特發性肉芽腫性乳腺炎,是一種臨床少見的乳腺慢性炎性疾病[1],其特征性表現為以乳腺小葉為中心的非干酪樣肉芽腫形成,伴淋巴細胞及中性粒細胞浸潤。GLM好發于育齡婦女,多數患者有哺乳史,并與高泌乳素血癥有關[2],近20年發病率在我國呈明顯上升趨勢。GLM病程長期反復,急性及慢性炎癥可同時出現,如乳房痛性或無痛性腫塊、膿腫、竇道或瘺管形成以及皮膚紅腫破潰,有時伴隨同側腋窩淋巴結腫大[4]。GLM病因及發病機制目前尚不明確,主要認為與自身免疫、細菌感染等因素有關。其臨床表現及影像學特征缺乏特異性,易與乳腺結核、炎性乳癌及乳腺導管擴張癥等混淆,組織病理學是診斷的“金標準”,細菌學培養有助于鑒別其它病因明確的肉芽腫性乳腺炎。
1 流行病學特點
GLM是一種罕見的乳腺疾病,其人群患病率尚未確定。Baslaim等在沙特阿拉伯進行了一項10年的回顧性研究,發現106名患有良性乳腺疾病的女性(乳房痛、纖維囊性變、纖維腺瘤、導管擴張、單純乳腺囊腫、急性和慢性炎癥)中,經組織病理學證實只有1.8%為GLM[3]。流行病學資料顯示地中海地區國家(如土耳其、西班牙、埃及等)以及發展中國家(如中國、印度、伊朗等)屬高發地區,白種人發病率低,除了環境致病因素外,可能還存在潛在的遺傳易感性[4-6]。在我國GLM存在臨床診斷不足的情況,常被誤診為漿細胞性乳腺炎。
絕大多數GLM患者為女性,僅個別病例報告為男性,男性乳房發育通常是誘發因素[7]。本病在妊娠期發病較為少見,尚未見哺乳期發病的報道,常在停止哺乳1年以上、4年以內出現癥狀[8-11]。未孕未育的患者罕見,常與泌乳素升高有關,多為藥物或垂體瘤導致的高泌乳素血癥[2,12-13]。
2 病因與誘因
GLM的組織學表現類似于肉芽腫性甲狀腺炎和肉芽腫性睪丸炎,這三種疾病的病因尚未明確,可能與自身免疫、細菌或病毒感染等因素有關。目前的觀點大多認為,GLM的發病機制可能為物理或化學刺激等因素引起的乳管通透性增加,管腔內分泌物如陳舊性乳汁等進入乳腺小葉內間質,引起的間質組織局部炎癥反應,繼而誘導免疫活性細胞浸潤導致遲發型超敏反應,最終形成局部肉芽腫[1,8]。國內外學者對GLM與棒狀桿菌的關系研究較多,但棒狀桿菌對GLM的致病作用仍存在爭議。
2.1 肉芽腫性小葉性乳腺炎與自身免疫
Kessler等首次報道GLM時即提出該病具有自限性[1]。Cohen等認為該病是自身免疫性疾病的局灶性病變[14],且糖皮質激素和免疫抑制劑對GLM的治療有一定效果[15]。病理免疫組化結果顯示GLM常為T淋巴細胞為主的炎性細胞浸潤。最近有學者發現IL-8、IL-17等炎性細胞因子參與了GLM的發病過程[16],進一步研究證實人類白細胞抗原(human leukocyte antigen,HLA)在GLM患者中的表達較高[17]。臨床上,部分GLM患者合并有其他免疫性疾病,如皮膚結節性紅斑病、多發性關節炎等,表明GLM與自身免疫關系密切,提示GLM的發病過程可能存在IV型超敏反應[20-21]。Ⅳ型超敏反應又稱遲發型超敏反應,是T細胞介導的,以單核巨噬細胞、淋巴細胞浸潤為主的慢性炎癥反應,并不存在自身相關抗體,目前尚未發現GLM相關的自身抗體可佐證這一推測,GLM患者的抗核抗體譜和類風濕因子均無明顯特異性[22]。
參與GLM發病的誘因包括乳房鈍性外傷、哺乳障礙或乳汁淤積、口服避孕藥、高泌乳素血癥等[3,23-25]。GLM的發病機制可能包含以下過程(圖1)。
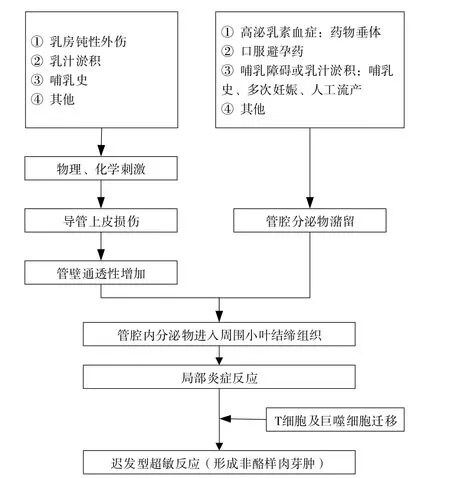
圖1 GLM發病機制及路徑Figure 1. Pathogenesis and path of GLM
2.1.1 管腔內分泌物潴留
多次妊娠、人工流產以及哺乳史是引起GLM的高危因素,均會導致不同程度的乳汁淤積。對于未孕未育的女性,常伴有不同原因引起的高泌乳素血癥,刺激乳汁分泌并在乳管內聚集。引起高泌乳素血癥的原因有垂體腺瘤及藥物,如抗精神病類藥物(如利培酮等強效D2受體拮抗劑)、抗抑郁癥藥物(如氟西汀等選擇性5 -羥色胺再攝取抑制劑)等[13,26-27]。口服避孕藥使性激素水平發生變化,導致乳腺對循環中正常水平的泌乳素的敏感性增加[28]。同時導管或腺泡上皮細胞出現化生、變性,繼而脫落入管腔內分解破壞。當乳管通透性增加時,這些具有免疫原性的物質外溢至小葉周圍間質,引起T細胞介導的免疫反應和肉芽腫形成[22,29]。
2.1.2 乳管通透性增加
多種物理、化學刺激可引起乳管通透性增加。乳房鈍性外傷直接損傷導管上皮細胞導致陳舊性乳汁等自乳管滲出。母乳喂養以及乳汁淤積也會造成微小創傷,使乳管通透性增加,管腔內容物進入小葉間質,從而引起肉芽腫性炎癥,少量分泌物就可引發GLM[30]。GLM可發生在妊娠期而病情遷延至哺乳期,但尚未見在哺乳期發病的報道[9,31]。可能的機制是妊娠晚期及哺乳期泌乳所需的組織結構已完成發育,肌上皮細胞變扁拉長,形成對腺泡、腺泡管和小導管的包繞,小葉間的結締組織顯著減少,成為薄層的小葉間隔,管腔內充滿分泌物,腺泡增大,細胞呈立方或扁平[32]。盡管乳汁分泌旺盛,但不易外移到間質。
2.1.3 其他誘因
GLM誘因還包括心理與飲食因素。前者能夠影響女性性激素的分泌,從而導致內分泌系統的紊亂,引發相關疾病[33]。生活節奏加快及精神壓力增大導致焦慮人群的增加,可能是近年GLM發病率升高的原因之一。不少患者在大量食用螃蟹、鱔魚、蝦等水產品后發病,這類食物具有一定的催乳作用,且蝦、蟹等甲殼類水產品作為國際公認的八大類食品過敏原之一,在一定程度上可能誘發免疫功能紊亂[34],但兩者的相關性仍需更多研究證實。
2.2 肉芽腫性小葉性乳腺炎與棒狀桿菌
2001年Paviour等首次在12名乳腺炎患者的乳房組織、膿液或深部傷口拭子等標本中發現了革蘭氏染色陽性的棒狀桿菌,患者均處于非哺乳期,其中9名患者的病理學表現符合GLM[35]。2003年Taylor等從GLM患者的病灶中檢測到棒狀桿菌(Corynebacterium)占41.2%,與組織病理學特征相似的對照組相比,棒狀桿菌感染患者更易出現發熱、中性粒細胞增多、竇道形成和雙側病變[36]。Yu等通過實時熒光定量PCR發現 57.89%標本中有kroppenstedtii菌屬(C. kroppenstedtii,CK)生長,推測CK在發病機制中起到一定作用[37]。2011年Renshaw等報道了囊性中性粒細胞肉芽腫性乳腺炎(cystic neutrophilic granulomatous mastitis, CNGM)[38],臨床表現與GLM相似,但其鏡下有特征性形態學改變:以乳腺小葉為中心的亞急性炎性反應病變,中央可見透明空泡樣小囊腔(直徑約200 ~800 μm),囊壁由中性粒細胞構成,外層被由大量組織細胞、淋巴細胞、漿細胞和多核巨細胞組成的肉芽腫性結構圍繞[39-40]。CNGM是乳腺肉芽腫性病變中的一種獨特類型,它與細菌感染密切相關且具有獨特的組織學形態,因此部分學者建議單獨命名。
棒狀桿菌參與GLM發病有三種可能機制:①始動因素,棒狀桿菌直接誘發肉芽腫形成;②輔助因素,協同免疫原性物質共同參與了遲發型超敏反應;③過客因素,也稱為無關因素,與GLM發病無關,棒狀桿菌為繼發性感染,可能加重臨床癥狀。
3 診斷
3.1 臨床表現
GLM的臨床表現多樣。Co等回顧性分析了102例GLM患者,中位年齡為33歲(20 ~54歲),炎性腫塊或膿腫的中位大小為37 mm(6 ~92 mm),55.9%的患者表現為痛性腫塊,28.4%為無痛性腫塊,15.7%為膿腫[41]。一項納入3 060名GLM患者的系統評價顯示,患者平均年齡36歲(19 ~49歲),乳房腫塊為最常見的臨床表現(80%),平均大小為5cm(3 ~9 cm),66%的患者伴疼痛[42]。Azizi等研究了來自伊朗的474名GLM患者,大多數有妊娠史(90.7%)及哺乳史(82.7%),平均妊娠次數為1.8次,平均母乳喂養時間為2.7個月(0 ~12.25 月),患者常見表現為疼痛(69.8%)和乳房腫塊(69.4%),出現皮膚病變、乳頭內陷和乳頭溢液的比例分別為39.2%、17.7%和15.6%,4.6%的患者伴隨關節疼痛[43]。GLM可表現為膿腫形成伴或不伴皮膚瘺管、竇道(6.6% ~54.0%)[44-45]。
3.2 影像學表現
GLM的影像學檢查并無特異性,但其有助于鑒別惡性腫瘤,評估病變范圍,術前定位病變部位和數目。乳腺超聲可作為GLM首選的檢查手段,超聲表現與其病程發展有關。最常見的超聲表現為不規則低回聲腫塊、管狀回聲及多發膿腔,血流豐富。病灶纖維化明顯時,病灶后方可見明顯聲影[46]。超聲有助于發現膿腫及竇道形成,同時還可以動態監測GLM病情緩解或進展。
在乳房X線檢查(乳腺鉬靶)中,GLM多表現為局灶性不對稱致密影,邊緣模糊,罕見鈣化,伴或不伴皮膚增厚及實質扭曲[47-48]。由于患者發病年齡較輕,乳腺實質較為致密,使得病灶的檢出較為困難,易誤診為乳腺癌。GLM發病多為生育期的年輕女性,但對于40歲以上患者,應通過其他檢查排除乳腺癌。
MRI常見表現為腫塊不均勻強化,或是邊緣強化、伴有節段性分布或局灶性的非腫塊性病變[49]。有融合或邊界清晰的微小病變,伴T2高信號和邊緣強化,可能為微膿腫[46,50]。GLM在彌散加權成像上ADC序列信號減低,與炎性乳腺癌鑒別價值不大[51-52]。張超杰等發現MRI 增強成像對 GLM病灶范圍評估的準確性可達 88.9%,遠高于B超或B超聯合鉬靶評估的準確率[53]。
3.3 病理學表現
GLM大體標本多為界限不清的腫塊,切面灰白灰黃、質韌,可見多個大小不等的膿腔,以及紫紅色壞死樣組織,周圍呈黃白色粟粒樣,擠壓可見膿液流出,病變范圍大者可形成竇道,與皮膚破潰口相通[54]。
組織病理學上,表現為以乳腺小葉為中心的非干酪樣肉芽腫,可見上皮樣細胞及朗格罕氏巨細胞,肉芽腫周圍以中性粒細胞浸潤為主,可見淋巴細胞、漿細胞以及少量嗜酸性粒細胞。病變呈多灶性分布,大小不等,伴或不伴微膿腫。GLM的炎癥通常局限于或至少以乳腺小葉為中心,少累及主導管[55-56]。除常規病理外,細菌染色(革蘭氏染色、抗酸染色)和真菌染色(PAS、GMS)均為陰性。
4 鑒別診斷
組織病理學為診斷的“金標準”。細針穿刺細胞學(fine needle aspiration cytology, FNAC)檢查得到的細胞數較少,難以做出準確的診斷。Hovanessian等研究證實FNAC僅對21%的病例具有診斷價值,必須進一步切開活檢或行空芯針穿刺活檢(core needle biopsy, CNB)[10]。CNB的準確度可達94% ~100%,推薦采用CNB進行術前病理組織學檢查[4,10]。GLM需要同臨床表現及病理診斷相似的疾病進行鑒別診斷,包括乳腺癌及其他慢性乳腺炎癥。
4.1 乳腺導管擴張癥或導管周圍乳腺炎
乳腺導管擴張癥(mammary duct ectasia,MDE)或導管周圍乳腺炎(periductal mastitis,PDM)可見于各年齡段婦女,多見于圍絕經期婦女,少見于未生育婦女。以乳頭溢液為初期表現,常可伴有乳頭內陷,腫塊常位于乳暈旁。超聲檢查可見明顯的導管擴張,內可見細密光點,加壓可見流動征。導管造影可見導管擴張、迂曲、阻塞、變形。MDE/PDM是慢性炎癥和纖維化導致的乳腺導管擴張,病變主要累及乳頭和乳暈區的大導管,不以乳腺小葉為中心[57]。該病病因不明,可能與乳頭異常發育、乳管阻塞、吸煙以及細菌感染(如非結核分枝桿菌)有關,用抗分枝桿菌的三聯藥物治療有效[58-59]。
4.2 乳腺癌
GLM的鑒別診斷必須排除乳腺癌,后者常表現為乳房單一腫塊,邊界不清,質韌硬,可伴有同側腋窩淋巴結腫大,彩超檢查可見邊界不清的低回聲腫塊,腫塊內部可見血流信號[60]。乳腺X線檢查有助于鑒別,表現為密度增高的腫塊影,邊界不規則,或呈毛剌征,易發現可疑鈣化,顆粒細小、密集。炎性乳腺癌(inflammatory breast cancer, IBC)臨床表現可類似GLM,但IBC具有較高的侵襲性,病情進展迅速,抗生素治療無效[61]。粗針穿刺組織學活檢有助于確診。
4.3 結核性肉芽腫性乳腺炎
結核性肉芽腫性乳腺炎多見于體弱的中青年婦女,多有結核病史。病變范圍廣泛,無規律,乳房有一個或多個腫塊,破潰后可形成竇道,愈合緩慢,伴盜汗、潮熱、消瘦等癥狀。分泌物或膿液做抗酸染色可見結核桿菌,實驗室檢查可見血沉增快,皮膚結核菌素試驗強陽性。病理上可見典型的結核性肉芽腫性結節,即干酪樣壞死。病變不以小葉為中心,肉芽腫性結節周邊可見上皮樣細胞及少量多核巨細胞,抗酸染色可見結核桿菌[62]。
4.4 乳暈下膿腫
乳暈下膿腫(Zuska病)也可見肉芽腫形成,所以也稱為乳暈下肉芽腫性炎。本病累及主乳管,發生在乳頭和乳暈的正下方,病變總在乳暈周圍,范圍很小。Zuska病發生于非哺乳期,多見于15 ~60歲婦女,尤其未婚少女,多半有乳頭內陷、內翻等乳頭發育不良畸形,偶見乳頭正常者。臨床表現為乳暈下腫塊、疼痛,常在乳暈旁或附近破潰,形成瘺管的外口,常反復發作,病程長。組織學上可見角化鱗狀上皮,炎癥局限于導管周圍。
5 治療
5.1 隨訪觀察
Davis等隨訪了2006年至2019年間120名GLM患者,其中112例GLM患者自行痊愈,平均自愈時間5個月(0 ~20個月)[63]。Hur等根據癥狀的嚴重程度對50例GLM患者進行分層管理,對8名病情相對較輕的患者僅隨訪觀察,88%獲得緩解,其中5例患者為單發或多發的小病灶,超聲測量大小為1 ~2 cm, 1例為較大腫塊(5 cm)隨后發展形成膿腫[64]。對于以局限性的乳房腫塊為主,腫塊較小、癥狀輕微患者可以在明確腫塊性質后進行隨訪觀察,密切監測病情進展。
5.2 手術治療
手術治療包括膿腫切排、病灶擴大切除以及乳房根治性切除。研究認為廣泛的手術切除復發率低,可作為首選方法。病灶局限、無膿腫、竇道等復雜性病變時手術切除最有利,Kiyak等對15例GLM(無膿腫、瘺管或彌漫性病變)患者進行了廣泛局部切除,中位隨訪時間為34.8個月,僅出現1例復發(6.6%)[65]。Elzahaby 等采用擴大切除炎性腫塊和周圍病變導管系統的手術方式,28例(93.3%)患者恢復快,創面愈合良好,美容效果良好,中位隨訪時間為 19個月(8到44個月),2例出現術后并發癥。其中1例為糖尿病患者,經抗生素治療和頻繁換藥后好轉,另1例為局灶性復發,遠離原有病灶,腫塊小,無疼痛,僅隨訪觀察,數月后自行消退[66]。Ahmed等對15例腫塊較大(占整個乳房20% ~50%)、藥物治療無效或不能耐受糖皮質激素治療的患者進行根治性乳房整形術,同時對側進行縮乳術以獲得對稱的美觀效果,13例患者中有2例(15%)在16個月和24個月復發,10名(77%)患者對手術結果感到滿意[67]。在全乳切除術后進行全乳房重建時最好使用自體組織而不是硅膠植入物,后者可能會增加因異物反應導致疾病復發的風險。Yabanoglu等回顧性分析77例患者治療方法、復發率和治愈率,其中保守治療44例,均接受糖皮質激素治療,平均約6個月治愈,有9例復發;手術治療33例,包括手術腫塊切除31例、單純乳房切除術1例、乳房切除術及假體植入1例,平均1個月治愈,無復發,平均隨訪時間為16.57 ~18.57個月[68]。單純手術治療伴隨著過大的手術切口及過多的切除范圍,對乳房外形造成損害,難以獲得滿意的手術效果,常需要聯合藥物治療縮小病灶范圍。Lei等研究了手術治療、口服糖皮質激素及二者聯合在GLM治療中的作用,發現三種治療方法的完全緩解率分別為90.6%、71.8%和94.5%,復發率分別為6.8%、20.9%和4.0%,說明激素聯合手術優于單用激素或手術治療[69]。對于復雜性病變,應聯合多種治療方式,根據患者的治療反應決定最佳的治療手段和順序。
5.3 藥物治療
藥物治療常被推薦為GLM一線的初始治療,或作為手術切除后的輔助治療,以降低復發率。
5.3.1 糖皮質激素
糖皮質激素是最主要的藥物治療手段,DeHertogh等于1980年首次提出,在此之前普遍采用手術治療[70]。Aghajanzadeh等建議每天口服強的松片(5 mg/片) 30 ~60 mg(按 0.75mg·kg-1·d-1計算),持續 4 周后開始減量。根據癥狀的緩解情況,在 3 ~6 周內完成減量至停藥[45]。若選擇甲潑尼龍片,則起始劑量為20 mg/d,通常每1 ~2周依次減量至16 mg/d、12 mg/d、8 mg/d、4 mg/d,直至癥狀完全緩解或穩定[71]。每天早晨飯后口服,半小時后服法莫替丁等抑制胃酸藥物,晚上服用維 D 鈣,癥狀緩解可逐漸減量。長期糖皮質激素治療會導致體重增加、高血壓、葡萄糖耐受不良、消化性潰瘍、庫欣綜合征甚至感染加重等不良反應[51]。因此,治療GLM的激素劑量應盡可能低,治療時間應與病情變化相適應。
局部糖皮質激素治療可有效減少治療的副作用,對于以皮膚改變為主的GLM,可選擇局部糖皮質激素治療。有研究證實使用潑尼松龍(0.125%)涂抹于病灶處,每天2次,連續4天,隨后間隔3天,以1周為一個周期,持續涂抹至癥狀消失。半數以上患者患乳的炎癥癥狀可明顯消失,瘺管開口和(或)皮膚破潰愈合,無明顯的激素相關不良反應[72-73]。
5.3.2 抗生素
對處于急性炎癥期的患者使用抗生素治療緩解癥狀,抗生素在GLM中作用有限,應根據病原學檢查結果和藥敏試驗選擇合適的抗生素,經驗性抗生素可選擇對革蘭氏染色陽性菌有效的左氧氟沙星和阿奇霉素[74]。
5.3.3 免疫抑制劑
對于糖皮質激素耐藥以及無法耐受長期激素治療的患者,甲氨蝶呤(methotrexate,MTX)或硫唑嘌呤有一定效果,有研究證實MTX與激素合用對控制病情進展有協同作用,聯合使用可減少激素用量[15]。MTX的使用劑量每周為7.5 ~15 mg,單藥治療持續1年,癥狀緩解后逐漸減量。治療期間應密切觀察不良反應,如肝腎功能損傷、骨髓抑制、間質性肺炎、葉酸缺乏、胃腸道反應等[15]。
5.3.4 溴隱亭
合并高泌乳素血癥的患者溴隱亭聯合糖皮質激素治療有效[2],若患者合并垂體瘤需采用手術切除或溴隱亭抑制治療。對于服用抗精神病藥物引起的高泌乳素血癥患者需與精神科醫生多學科會診后調整精神病類藥物或是考慮溴隱亭治療。
6 臨床分型
GLM病程長期反復,本團隊根據癥狀和體征將其分為三種類型:腫塊型、膿腫型以及復雜型。
腫塊型GLM表現為單純腫塊,質硬,無疼痛,皮膚無炎癥表現,易與乳腺癌混淆。此型Ⅰ期手術治療效果最佳,多采用局部廣泛切除,切除范圍小,且復發率低。部分病灶局限的患者僅隨訪觀察也可獲得緩解,藥物治療療效尚不確定。
膿腫型GLM的特征性表現為膿腫或微小膿腫形成,伴疼痛,出現皮膚炎癥,皮膚紅腫、增厚,皮溫升高,常伴隨腋窩淋巴結腫大,可合并結節性紅斑等全身癥狀,此型需與炎性乳腺癌相鑒別。與一般化膿性乳腺炎不同,常規抗生素治療常常無效,糖皮質激素治療有助于緩解疼痛,縮小病變范圍,但容易出現激素依賴或耐藥,停藥或減量后病情可能反跳,此型藥物治療需密切關注患者對治療的反應以及疾病進展。單純膿腫切排容易造成膿腫擴散,導致切口遷延不愈,大量膿腫形成可穿刺引流后進行局部病灶切除。
復雜型GLM出現急慢性多種表現,有竇道或瘺管形成,常累及皮膚形成潰瘍。乳腺外形毀損,疼痛程度常與嚴重程度不相符。此型病變嚴重、病情復雜,易合并細菌感染,手術治療可迅速緩解癥狀但術后外形常常不佳。
對于合并結節性紅斑等全身癥狀的患者,需手術和藥物聯合治療,手術時機和手術范圍的選擇非常重要,盡管目前尚無統一的定論,但手術基本原則為徹底清除病灶、去除病因以及保護乳房外形。
7 結語
GLM是一種良性乳腺疾病,近年來國內發病率明顯增高。其治療方案仍缺乏統一共識,治療方式的選擇應考慮患者的意愿以及藥物依從性。過去對大多數患者采取廣泛手術切除,近年來,保守治療如口服糖皮質激素或隨訪觀察被推薦為一線治療。糖皮質激素治療與高復發率有關,治療時間長并可能導致一系列副作用,對于難治性GLM仍建議選擇手術。手術治療能迅速緩解癥狀,目前手術方式多采取擴大切除,導致瘢痕形成、乳頭回縮、乳頭位移等外形改變,對于病變廣泛的患者更會嚴重損傷乳房外形,因此需要改進GLM的手術方式,在保證低復發率的前提下保護乳房外形。臨床實踐中應密切監測患者對治療的反應以及預后情況。
目前GLM的診斷及治療缺乏充分的循證醫學證據,臨床上對本病認識不足常常誤診、誤治,因此,提高對GLM的認識、制定臨床診斷標準及規范診療行為是目前亟待解決的重要問題。

