未成年患者經心內膜植入永久起搏器的病因分析及隨訪觀察
林小花 張建成 張彥
心臟起搏是指暫時或長期(永久)地周期性發放低能量電脈沖刺激心臟,使之發生激動,以治療竇性停搏、竇性心動過緩、房室阻滯等嚴重心動過緩。 目前未成年人植入起搏器的比例不到起搏器植入總數的 1%[1]。 本研究共收集了我院 17例經心內膜植入永久起搏器的未成年患者基本信息、病因、臨床表現、心電圖、心臟彩超、胸部正側位片等相關數據,分析起搏器植入術前、術中及術后相關數據,評估起搏模式和起搏部位對心臟結構及功能的影響。
1 資料和方法
1.1 一般資料
納入 2002年 1 月 30 日至 2017年 10 月 5 日在福建省立醫院住院且需經心內膜植入永久起搏器的未成年患者 17例。 其中,男 8例、女 9例,年齡 5 個月~18(9.61 ±5.85)歲,身高 70~175 (131.35 ±33.97)cm,體重 5.0~62.5 (31.75 ±18.94)kg。 植入起搏器的原因(病因)中,7例為病毒性心肌炎后遺留的三度房室阻滯,6例為復雜先天性心臟病術后出現的三度房室阻滯,2例為不明原因所致的三度房室阻滯,2例為不明原因所致的病竇綜合征伴擴張型心肌病。 先天性心臟病手術類型:室間隔缺損修補術2例,室間隔合并房間隔缺損修補術2例,法洛四聯癥矯治術2例。
1.2 研究方法
收集全部患者植入起搏器前后的心電圖檢查結果、心臟彩超檢查結果、植入起搏器的類型、術后隨訪資料(包括心電圖、心臟正側位片、心臟彩超及起搏參數等)。
1.3 統計學處理
用SPSS 21.0 軟件進行統計分析。 計數資料采用例數和百分比(%)表示,計量資料以表示;服從正態分布的計量資料組內前后自身對照采用配對樣本t檢驗,組間比較采用方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 術前心電圖特點
17例患者術前心房率 34~107(67.12 ±22.53)次/min,心室率 34~ 75(48.82 ± 11.30) 次/min。15例(88.2%)患者提示三度房室阻滯;QRSε波時限≥120 ms患者2例(圖1);QRSε波時限 <120 ms 患者13例,其平均心房率(70.60 ±21.51) 次/min,平均心室率(49.87 ±11.37)次/min。 2例患者(11.8%)提示竇性停搏,24 h 心電圖提示最長間歇分別為11.4 s(圖2)、8.3 s,最慢心率依次為 12、25 次/min。
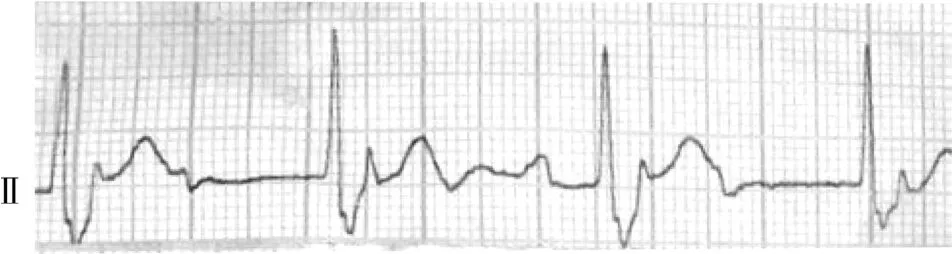
圖1 1例三度房室阻滯(QRSε波時限≥120 ms)患者術前體表心電圖Fig.1 Preoperative surface ECG of a patient with third-degree atrioventricular block(QRS duration≥120 ms)
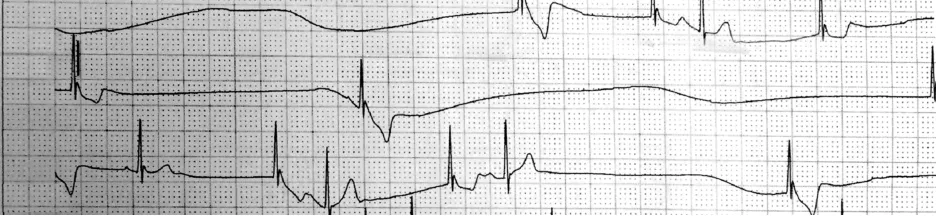
圖2 1例竇性停搏最長間歇11.4 s 患者術前CH1 導聯動態心電圖Fig.2 Preoperative ambulatory electrocardiography in lead CH1 of a patient with the longest sinus arrest interval of 11.4 s
2.2 術前心臟彩超特點
2例(11.8%)全心擴大,室壁運動欠佳,伴二尖瓣及三尖瓣中度反流;3例(17.6%)左室輕度擴大,其中伴左心房輕度擴大1例;2例(11.8%)右心擴大;10例(58.8%)心臟未見擴大,其中輕度二尖瓣伴三尖瓣反流3例,二尖瓣輕到中度反流1例,無反流6例。
2.3 永久起搏器植入類型及手術情況
起搏方式:10例(58.8%)VVI(R)起搏,7例(41.2%)DDD(R)起搏,DDD(R)起搏中VAT 起搏1例。 17例患者中,1例患者術中因原發病死亡,另16例患者起搏頻率60~110(75.13 ±13.98)次/min。VVI(R)起搏患者中,主動固定于右室心尖部5例,主動固定于右室間隔部5例。 DDD(R)起搏患者中,主動固定于右心耳+右室心尖部2例,主動固定于右心耳+右室流出道間隔部1例,主動固定于右房間隔部+右室間隔部1例,被動固定高位右房+主動右室間隔部1例,主動固定于右心耳+右室間隔部1例,主動固定于左心耳+右室間隔部1例。
2.4 術后隨訪情況
術后對13例患者定期進行門診起搏器程控隨診,隨訪時間3 個月~15年(平均3.1年)。 術后13例患者活動耐量均較術前明顯改善,心電圖提示起搏感知帶動良好,均未見起搏器囊袋感染、出血以及電極導線脫位等并發癥。
隨訪病例中術后1年、 2年、 3年右室起搏閾值、阻抗、靈敏度均無變化。 2例患者分別于術后7年及14年因起搏器電池耗竭行起搏器電池置換術,余隨訪患者均暫未更換。
術后隨訪的13例患者中,全心擴大1例、左心增大2例、左室增大1例,余心腔大小均恢復正常,左室射血分數(LVEF)大致同術前,未見明顯心功能惡化。
13例患者中,7例為VVI(R)起搏模式,6例為DDD(R)起搏模式。 心臟彩超檢測數據顯示,采用VVI(R)起搏模式的病例術后右心房內徑(RAD)和左心室內徑(RVD)均明顯擴大(P均<0.05);其余各項心臟指標術后與術前間的差異均無統計學意義。 見表 1。
心室心尖部(5例)與室間隔(8例)兩個部位起搏對心臟左室舒張末期內徑(LVED)、RVD 及LVEF均無顯著影響。 見表2。
術后胸片檢查顯示起搏器電極均在位,起搏器功能正常。 起搏電極導線均預留了一定長度,以適應未成年人身體生長的需求。 見圖3。
表1 不同起搏模式患者植入術前后的心臟彩超指標對比 Tab.1 Comparison of preoperative and postoperative echocardiographic indexes in patients with different pacing modes
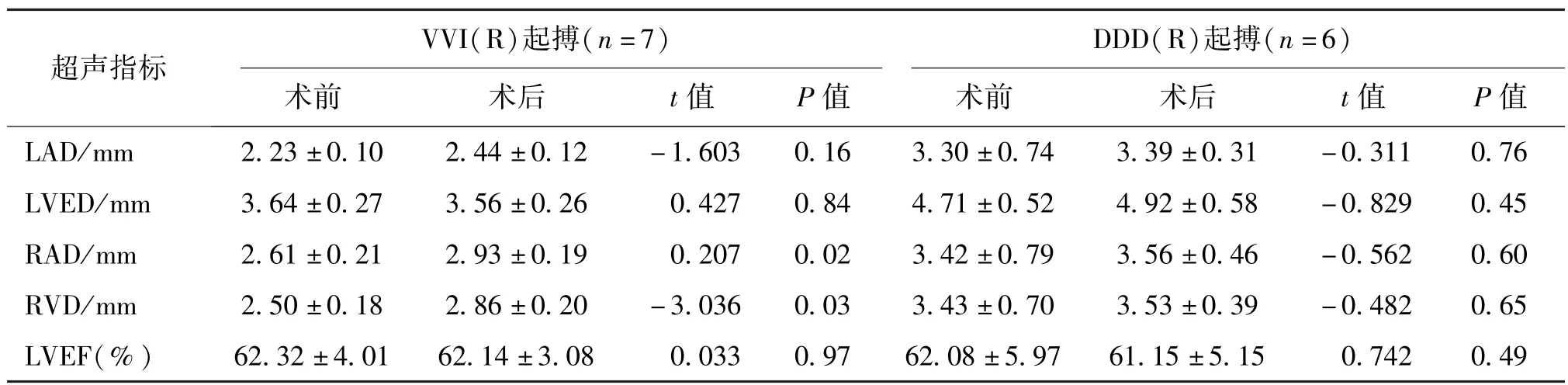
表1 不同起搏模式患者植入術前后的心臟彩超指標對比 Tab.1 Comparison of preoperative and postoperative echocardiographic indexes in patients with different pacing modes
VVI(R)起搏(n=7)超聲指標DDD(R)起搏(n=6)術前 術后 t 值 P 值 術前 術后 t 值 P 值LAD/mm 2.23 ± 0.10 2.44 ± 0.12 -1.603 0.16 3.30 ± 0.74 3.39 ± 0.31 -0.311 0.76 LVED/mm 3.64 ± 0.27 3.56 ± 0.26 0.427 0.84 4.71 ± 0.52 4.92 ± 0.58 -0.829 0.45 RAD/mm 2.61 ± 0.21 2.93 ± 0.19 0.207 0.02 3.42 ± 0.79 3.56 ± 0.46 -0.562 0.60 RVD/mm 2.50 ± 0.18 2.86 ± 0.20 -3.036 0.03 3.43 ± 0.70 3.53 ± 0.39 -0.482 0.65 LVEF(%) 62.32 ± 4.01 62.14 ± 3.08 0.033 0.97 62.08 ± 5.97 61.15 ± 5.15 0.742 0.49
表2 心尖部起搏與室間隔起搏術前及術后心臟彩超相關指標對比 Tab.2 Comparison of preoperative and postoperative echocardiographic indexes in apical pacing and septal pacing
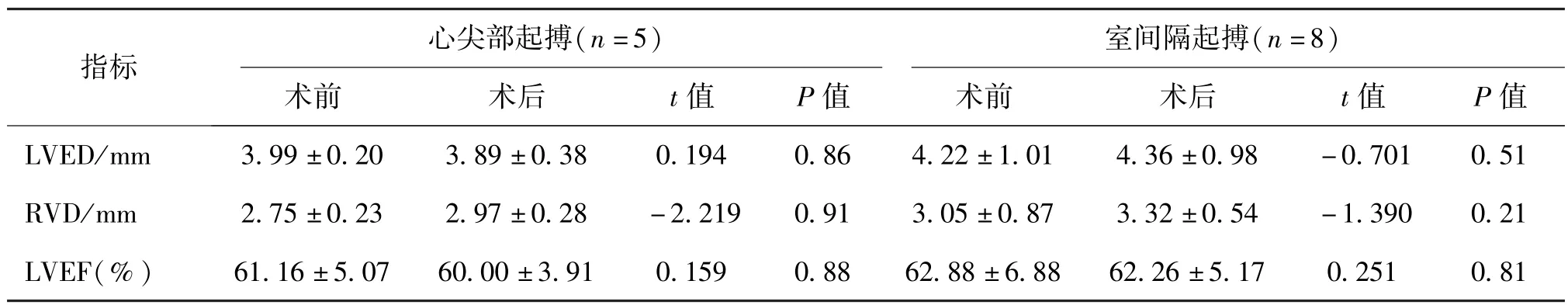
表2 心尖部起搏與室間隔起搏術前及術后心臟彩超相關指標對比 Tab.2 Comparison of preoperative and postoperative echocardiographic indexes in apical pacing and septal pacing
心尖部起搏(n=5)指標室間隔起搏(n=8)術前 術后 t 值 P 值 術前 術后 t 值 P 值LVED/mm 3.99 ± 0.20 3.89 ± 0.38 0.194 0.86 4.22 ± 1.01 4.36 ± 0.98 -0.701 0.51 RVD/mm 2.75 ± 0.23 2.97 ± 0.28 -2.219 0.91 3.05 ± 0.87 3.32 ± 0.54 -1.390 0.21 LVEF(%) 61.16 ± 5.07 60.00 ± 3.91 0.159 0.88 62.88 ± 6.88 62.26 ± 5.17 0.251 0.81
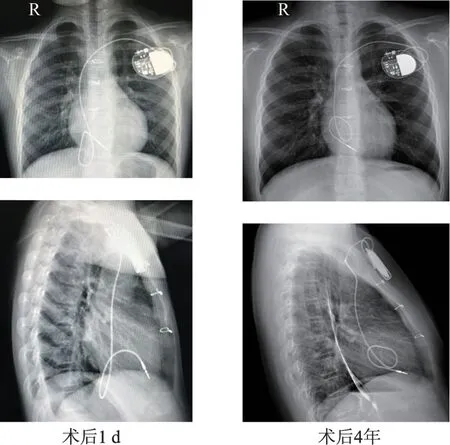
圖3 1例未成年患者經心內膜植入VVI(R)起搏器術后1 d與術后4年心臟正側位片Fig.3 Heart anterolateral radiographs of a minor patient one day and 4 years after endocardial VVI(R)pacemaker implantation
3 討論
本組資料顯示,未成年患者永久起搏器植入的主要病因為病毒性心肌炎導致的三度房室阻滯、復雜先天性心臟病術后出現的三度房室阻滯,而病竇綜合征罕見。 流行病學研究表明,在病毒流行期病毒性心肌炎發病率約為5%,新生兒、兒童中的發病率約為0.36%,其導致的高度及三度房室阻滯經治療后部分患者仍不可恢復,需植入永久起搏器,為未成年人起搏器植入的首要原因[2]。 而復雜先天性心臟病術后發生的高度房室阻滯則為未成年人起搏器植入的另一個主要病因。 導致阻滯的先天性心臟病,主要為室間隔缺損,其次為矯正性大動脈轉位[3]。 先天性完全性房室阻滯則更為罕見,有研究表明,新生兒中的發病率僅在(1/15 000)~(1/22 000)[4]。 本研究中先天性心臟病術后致房室阻滯患者中,66.7%為室間隔缺損修補術后,而33.3%為法洛四聯癥矯治術后。 本研究中11.8%為不明原因高度房室阻滯患者,目前暫不能排除先天性因素所致;病竇綜合征患兒(11.8%)病因尚不清楚,可能原因為隱匿性病毒性心肌炎累及的竇房結病變或先天性的竇房結發育異常,有待進一步明確。
永久起搏器有經心內膜和經心外膜兩種植入途徑。 心內膜起搏具有創傷小、導線不易磨損、起搏閾值低、使用壽命長等優勢。 近年來,隨著心內膜起搏器應用研究的不斷進展,對患者年齡(嬰幼兒)、體重( <10 kg)的限制不斷被打破[5]。 本研究中17例患者起搏器植入途徑均為經靜脈心內膜永久起搏,手術成功的患者中年齡最小的僅2 周歲,體重12.5 kg,術后未發生起搏器相關并發癥。
目前最常用的兩種起搏模式是DDD(R)起搏和VVI(R)起搏。 研究發現DDD(R)起搏影響心臟射血分數,使射血分數下降,從而影響心功能。 汪漢等[6]研究表明,DDD(R)起搏比 VVI(R)起搏更能降低房顫的發生率,同時更能縮小左房直徑及LVEDD,但兩類起搏方式的遠期生存率無明顯差異[7]。 本 研 究 使 用 VVI (R) 模 式 起 搏 10例(58.8%),DDD(R)模式起搏 7例(41.2%)。 VVI(R)組手術前后的RAD、RVD 間的差異有統計學意義(P<0.05),但 LVEF、LAD 及 LVED 間的差異則無統計學意義,心功能未見惡化。 一方面,與接近心臟生理性起搏的房室同步性DDD(R)起搏比較,VVI(R)起搏方式房室起搏不同步,更易導致血流動力學改變,引起右室重構,使右室及右房內徑增大。 另一方面,未成年人仍處于生長發育階段,隨著年齡的增長,心腔內徑會發生生理性增大。 未成年人,尤其是年齡較小的患兒,心腔狹窄、靜脈管腔細小,易導致靜脈血管栓塞,造成DDD(R)起搏兩根電極導線難以通過。 因此,對于年齡較小的患兒,多數植入單電極導線起搏器VVI(R)。 隨著更適合用于兒童的細導線的出現,近年來未成年人雙腔起搏器植入逐漸趨于低齡化。 使用單腔起搏器的患兒待身體發育成熟,時機恰當時可升級更換成雙腔起搏器,從而減少心血管栓塞并發癥。
有研究表明,心臟永久起搏器植入術后并發癥的發生率在 8.2%~ 17.4%[8],而未成年人的發生率更高,主要包括電極導線、囊袋、手術操作相關等并發癥。 Welisch 等[5]的研究顯示,植入永久起搏器的患兒電極相關并發癥發生率為18%,早期心臟穿孔的發生率為5%~7%。 囊袋相關并發癥臨床上最常見,主要表現為囊袋的積血、感染以及破裂。手術操作相關并發癥包括誤穿刺鎖骨下動脈、氣胸、冠狀靜脈口夾層及冠狀靜脈注入氣泡。 Lalu等[9]研究發現,氣胸的發生與鎖骨下靜脈穿刺相關,發生率為0.66%~1.8%。 本組患者起搏器植入時導線均預留了適當長度,多采用主動電極固定,82.3%的患者選擇在胸大肌下制作囊袋,隨訪至今均尚未發生囊袋、電極導線等相關并發癥,術后程控起搏參數均良好。

