醫用回旋加速器常見固體靶金屬核素應用優勢與生產實施
張海瓊,胡 楠,劉 宇,李 方,巴建濤,*
(1.中國醫學科學院 北京協和醫院 核醫學科,北京 100730;2.疑難重癥及罕見病國家重點實驗室,北京 100730;3.中國醫學科學院 罕見病研究中心,北京 100730;4.核醫學分子靶向診療北京市重點實驗室,北京 100730)
PET/CT與PET/MR在惡性腫瘤等疾病的診斷中應用廣泛,已成為精準醫療的重要研究手段。早期,PET/CT與PET/MR常用的放射性核素為18F與11C,但這2種核素具有物理半衰期短、長生物半衰期前體標記困難等局限,已不能滿足臨床發展的需求。
2013年,國際原子能機構(IAEA)與歐洲核醫學協會(EANM),以及核醫學與分子影像學會(SNMMI)聯合發布了肽受體放射性核素治療(PRRT)實用指南[1]。針對可通過簡易鍺-鎵發生器裝置生產的正電子放射性核素68Ga與反應堆生產的177Lu,美國FDA于2016年批準68Ga標記的DOTATATE用于神經內分泌腫瘤成像,隨后于2018年批準177Lu標記的DOTATATE用于治療生長抑素受體陽性的胃腸胰腺神經內分泌腫瘤,這被認為是美國大型市場的一種模式轉變,在國際上產生了深遠的影響[2]。另外,這兩種核素均可很好地標記前體PSMA,在前列腺癌的診療中具備獨特優勢[3],已成為核醫學領域的研究熱點。但在鍺-鎵發生器生產68Ga的過程中,存在母核68Ge的殘留干擾以及產率隨時間延長而下降的問題[4],限制了其批量生產。此外,因68Ga物理半衰期僅為68 min,只能標記小分子與多肽,致使其臨床轉化受限。
為實現診斷與治療并重,達到生產與轉化共進,醫用回旋加速器采用固體靶研發與生產半衰期更長的新型正電子核素成為新的需求。處于核醫學領先地位的歐美國家,已有多個醫學研究中心具備豐富的中高能醫用回旋加速器固體靶金屬核素生產與轉化經驗[5-7]。經過長期實踐,國際原子能機構推薦了2種固體靶金屬正電子核素(64Cu和89Zr)和1種鹵族核素124I[8],這3種固體靶核素均表現出與單克隆抗體相匹配的半衰期,且有較好的正電子發射效率,具有突出的臨床應用優勢。金屬正電子核素44Sc因與電子核素47Sc具有一致的藥物代謝與動力學,可實現診療一體化,在臨床應用前已有相應研究[9],引起了核醫學領域的關注。這些核素的生產都需要采用中高能量醫用回旋加速器質子束轟擊固體靶,而固體靶的技術復雜、費用昂貴,國內僅有少數醫療單位安裝了固體靶醫用回旋加速器,也僅有少數機構具備正電子金屬核素64Cu與89Zr的生產能力[10-11],而有關44Sc核素的生產目前尚未見相關報道。
北京協和醫院引入的GE-PETtrace800,具有成熟的64Cu與89Zr生產工藝[7,12],也具有44Sc生產成功的研究先例[13],具有為開展44Sc-47Sc診療一體化研究提供診斷核素的可能。
本文將介紹醫用放射性核素的來源,重點探討固體靶金屬核素的應用優勢,進一步對核心固體靶金屬核素的生產與實施方案進行研究,以期為國內醫療機構固體靶金屬核素的生產與場地設計應用提供參考。
1 醫用放射性核素選擇與應用優勢
1.1 醫用放射性核素來源
醫用放射性核素可來源于核裂變反應堆、回旋加速器以及發生器等,其中裂變反應堆生產是醫用同位素的重要來源,經過特定的分離與純化流程,滿足核醫學對放化純度的要求,用于顯像或治療。最典型的131I在甲狀腺癌治療[14]與腎上腺髓質SPECT顯像[15]等領域已得到廣泛應用。回旋加速器生產是醫用放射性核素的另一主要來源,國內自主研發的30 MeV的固體靶回旋加速器已用于同位素的批量生產[16],2018年中國原子能科學研究院研發的回旋加速器CYCIAE-100,其能量與質子束流分別可達100 MeV和520 μA,是國際上現有功率最高、能區最好的固體靶正電子核素生產設施[17],有望生產更多新型的正電子核素。因產額的要求,該類加速器多采用外部離子源,相空間接收度內由外部離子源注入到中心區的負氫離子被射頻系統俘獲,在回旋加速器的真空室內經過磁場回旋偏轉、高頻系統反復加速[18],最后經束流引出系統的碳膜剝離電子,產生用于轟擊靶的質子束流[19]。根據靶材料的屬性,分為氣體靶、固體靶與液體靶,常見的18F與13N為液體靶生產,而11C與15O通過氣體靶生產,本文著重要討論的醫用金屬放射性核素64Cu、89Zr及44Sc主要通過固體靶生產。在相對偏遠地區的醫療機構,很難實現反應堆生產供藥,亦不具備加速器生產能力,但基于反應堆或加速器生產得到的長半衰期母核,通過發生器淋洗的方式,為其核醫學的開展提供了可能性。經典核素99Tcm與正處于研究熱點的正電子放射性核素68Ga均可采用發生器生產[4]。通過反應堆、加速器以及發生器生產的醫用放射性核素示于圖1。
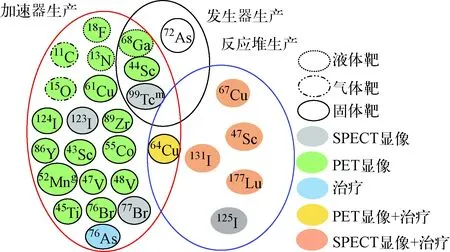
圖1 醫用放射性核素生產與應用分類Fig.1 Classification of medical radionuclide production and application
綜合分析圖1中經加速器生產的核素的射線類型、豐度(發射率)、物理半衰期、射線能量等物理特性,可見:123I是較純凈的γ射線源,能量與SPECT顯像用經典核素99Tcm(140 keV)相近,是較理想的SPECT顯像核素;124I/123I與86Y/90Y符合診療一體化理念,因而具有廣闊的發展前景;55Co、47V、48V、45Ti以及76Br均為正電子核素,可用于PET顯像,但目前相關研究較少,除生產困難外,較高的正電子能量在人體組織中的穿透距離較遠,影響了腫瘤的精確定位;52Mng雖然能量適中,但正電子發射率低,且對于顯像,物理半衰期過長;76As是發射率適中的電子核素,但其物理半衰期(26.4 h)在腫瘤治療中相對較短。64Cu、89Zr以及44Sc這3種可通過醫用回旋加速器固體靶生產的金屬核素的物理特性列于表1。
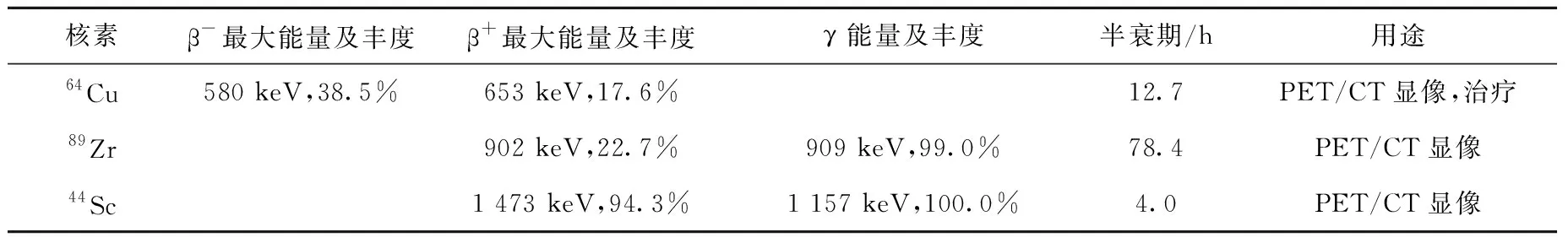
表1 醫用回旋加速器生產的常見固體靶金屬核素Table 1 Common solid target metal radionuclide produced by medical cyclotron
64Cu同時釋放β-與β+射線,理論上64Cu可用于PET/CT顯像以及核素治療,但因其物理半衰期只有12.7 h,在核素治療中不具優勢,但與傳統顯像核素18F(109 min)與68Ga(68 min)相比,其在中等分子質量的前體標記中具有突出優勢。89Zr作為正電子核素可用于PET/CT顯像,其物理半衰期為78.4 h,在抗體標記上具有絕對優勢,較長的物理半衰期也為異地生產與運輸帶來便利。44Sc的物理半衰期處于18F與64Cu之間,是一種β+射線發射概率極大的正電子核素,可用于PET/CT顯像。89Zr與44Sc這2種正電子核素均伴隨γ射線,采用(β++γ)三重符合技術,可提高光子靈敏度,縮短采集時間[20]。綜上所述,64Cu、89Zr及44Sc具有優越的物理性能,其臨床應用與轉化具有更多的可能性。
1.2 固體靶金屬核素應用優勢
1) 擴展臨床應用范圍
固體靶金屬核素(64Cu與89Zr)產額高且應用豐富,具有傳統氣體靶與液體靶核素無法替代的相對優勢。傳統中低能醫用回旋加速器只能經液體靶生產18F和13N,或通過氣體靶生產11C及15O。常用的18F標記的氟代脫氧葡萄糖(18F-FDG)在全身腫瘤檢測中表現出明顯優勢,但其并非腫瘤特異性顯像劑,固體靶金屬正電子核素可彌補這一示蹤劑的局限性。在核素標記靶向藥物中,通常標記過程復雜,標記時間長,11C、13N、15O、18F這些短半衰期正電子核素在分子質量大、代謝慢的靶向藥物標記中存在先天缺陷,而中長物理半衰期的固體靶金屬核素,如64Cu和89Zr等,在抗體類及其他納米藥物等長壽命靶向物的標記中表現出非常高的物理契合度與成功率。結合68Ga(常為發生器生產)在小分子與多肽標記中的優勢,從68Ga到64Cu,再到89Zr,整體上實現了從小分子到大納米粒子的長跨度標記(短、中、長物理半衰期核素與對應配體的標記范圍示于圖2),因此固體靶金屬核素擴展了放射性藥物的臨床應用范圍,豐富了臨床應用。此外,固體靶生產金屬放射性核素還具有產額高的優勢,以89Zr為例,文獻報道其可通過液體靶和固體靶生產,在20 μA這一相同運行條件下,產率分別為(4.36±0.48) MBq/(μA·h)[21]和69.77 MBq/(μA·h)[22],可見固體靶生產實現了產率的量級增長。基于固體靶金屬核素產額高的特性,在1次加速器轟擊中有望開展更多臨床試驗,為更多患者提供診療服務。

圖2 短、中、長物理半衰期核素與對應配體標記范圍示意圖Fig.2 Schematic diagram of radionuclides with short, medium and long physical half-life and corresponding ligand labels
2) 促進治療領域發展
固體靶金屬放射性核素(64Cu與89Zr)可更好地服務于靶向治療與免疫治療等新型治療領域。對于腫瘤早期的患者,除手術根治者外,一般對放化療也較敏感,而對于癌癥晚期患者以及復發性患者,多表現出腫瘤倍增時間短、轉移快且增殖率高的臨床特性,遺傳突變的加速導致傳統的腫瘤治療手段失效,靶向治療與免疫治療在后期治療中表現出絕對優勢,且對正常組織的影響較小,成為主要醫治手段。靶向治療是在分子水平上,針對已經明確的靶點,采用靶向抗體藥物對腫瘤的生長與擴散進行干擾阻斷。靶向治療前,固體靶生產的中長物理半衰期的金屬核素64Cu與89Zr等,通過標記合適的大分子抗體,可有效監測抗體與相關靶點的特異性結合情況,為療效與預后評估提供指導。而免疫治療是通過調節機體免疫細胞活性,讓失活的免疫細胞活躍起來,以此間接消滅腫瘤細胞。PD-1、PD-L1及CTLA-4抑制劑作為常用的免疫治療藥物,與靶向藥物類似,均屬于生物代謝過程慢的大分子。常規醫用放射性核素18F與68Ga因物理半衰期短,難以滿足大分子標記與絡合的需求,而固體靶生產的中長物理半衰期的金屬核素如64Cu和89Zr等,有利于與長生物半衰期的大分子抑制劑標記,用于免疫治療前的PET成像,通過最大標準攝取(SUVmax)值進行臨床療效評估,這一新型無創性評估方法,甚至優于病理診斷[23]。因此,固體靶金屬核素研發可有效促進靶向治療與免疫治療的發展,為癌癥晚期患者帶來更多的希望。
3) 具備診療一體化應用價值
固體靶金屬核素(44Sc)具備診療一體化臨床應用價值。在核醫學領域,除采用SPECT和PET技術實現對腫瘤、乏氧、基因以及細胞凋亡顯像外,一些放射性核素通過發射帶電粒子(α、β以及俄歇電子)可實現對惡性腫瘤細胞的靶向輻照,達到治療腫瘤的目的。通常情況下,診斷用放射性金屬核素與治療用金屬核素是不同的元素,如68Ga/177Lu。而固體靶金屬核素的生產豐富了醫用放射性核素種類,可制備化學性質及動力學性質完全相同的放射性藥物,用于診斷和治療,更好地實現診療一體化。如,固體靶生產的診斷核素44Sc與由反應堆生產的治療核素47Sc(半衰期為3.35 d的低能β核素,能量與豐度分別為439 keV和68.4%)具有相同的化學與動力學特性,構成了完整的核醫學診療一體化體系,具有強大的診療潛力[24];另外44Sc與177Lu及90Y也可形成廣義的診療配對,具有一定的臨床研究價值。
2 固體靶金屬核素的生產與實施
2.1 正電子藥物制備區布局與防護
正電子藥物制備場所主要由正電子核素制備區域、正電子藥物合成分裝區域、正電子藥物質量控制區域3大部分組成。為保證工作流程連續完整,有效減少周圍公眾和職業人員所受的照射,3個區域不可過于分散。在有限的空間內,盡可能考慮3個區域的功能銜接合理性和核素傳輸的便捷性。固體靶加速器機房不同靶位生產的核素與制備室中對應的熱室之間通過專用通道傳輸,藥物質量控制間與正電子放射性藥物制備室相鄰,便于檢驗。根據GB 18871—2002的要求,工作場所分為控制區與監督區[25],正電子藥物合成封裝與質量控制區域屬于控制區,監督區包括緩沖間、一更/二更間與二更緩沖間,用于污染檢測。

圖3 正電子核素制備區Fig.3 Production site of positron nuclide
為加強固體靶金屬核素的生產與臨床轉化,北京協和醫院在建的正電子藥物生產工程部署于醫學轉化大樓,正電子核素制備區位于地下5層(大樓的最底層)。正電子核素制備區布局設計如圖3所示,主要包括2個回旋加速器機房、控制間、輔助設備間、氣瓶間、空調機房、強弱電機房、工作人員通道、氣體通道、核素自動傳輸通道等。正電子制備生產區為高輻射、開放性放射性工作場所,回旋加速器機房設計有獨立的新風和排風系統,排風機出口高于房屋建筑排風筒,設高效活性炭過濾裝置以最大限度減少對職業人員的影響。
設計初期包含2臺回旋加速器,其中1臺為中能回旋加速器,用于日常18F藥物的生產。固體靶金屬核素由于需要合適的能量以及合適的核反應截面,計劃采用高能回旋加速器生產,基于國內市場多種回旋加速器的能量范圍(15~20 MeV),采用中位能量18 MeV以及最大單束流工作流強100 μA進行防護設計預評價。通過研究特定墻體厚度與運行狀態時的環境輻射水平發現,在空間為6.1 m×4.9 m×2.6 m高能固體靶回旋加速器室中,可達到輻射防護最優化。采用普通混凝土(密度為2.35 g/cm3)與10 mm鉛+60 mm含硼聚乙烯分別作為機房墻體屏蔽與機房防護門屏蔽,根據《輻射防護手冊》[26]與國標要求[27],計算加速器機房在無局部屏蔽時四周外0.3 m處的γ射線與中子劑量率與防護門的中子輻射劑量,結果列于表2。由表2可知,加速器機房周圍最大劑量率為防護門外0.3 m處的6.11×10-2μSv/h。表2中屏蔽材料及厚度的設計滿足輻射防護劑量率閾值2.5 μSv/h的要求[28]。假如工作人員與公眾1年內在防護門外0.3 m處的滯留時間分別為960 h與60 h,根據年有效劑量率計算公式(式(1))[26]可得,工作人員與公眾年有效累計劑量分別為5.87×10-2mSv/a和3.67×10-3mSv/a,均低于《電離輻射防護與輻射源安全基本標準》[25]對放射性工作人員(<5 mSv/a)與普通公眾(<1 mSv/a)的輻射劑量限值。
Ha=(Hn+γtq)×10-3
(1)
式中:Ha為年有效劑量,mSv/a;Hn+γ為關注點處中子和γ總劑量率最大值,μSv/h;t為人員停留時間,h/a;q為居留因子。
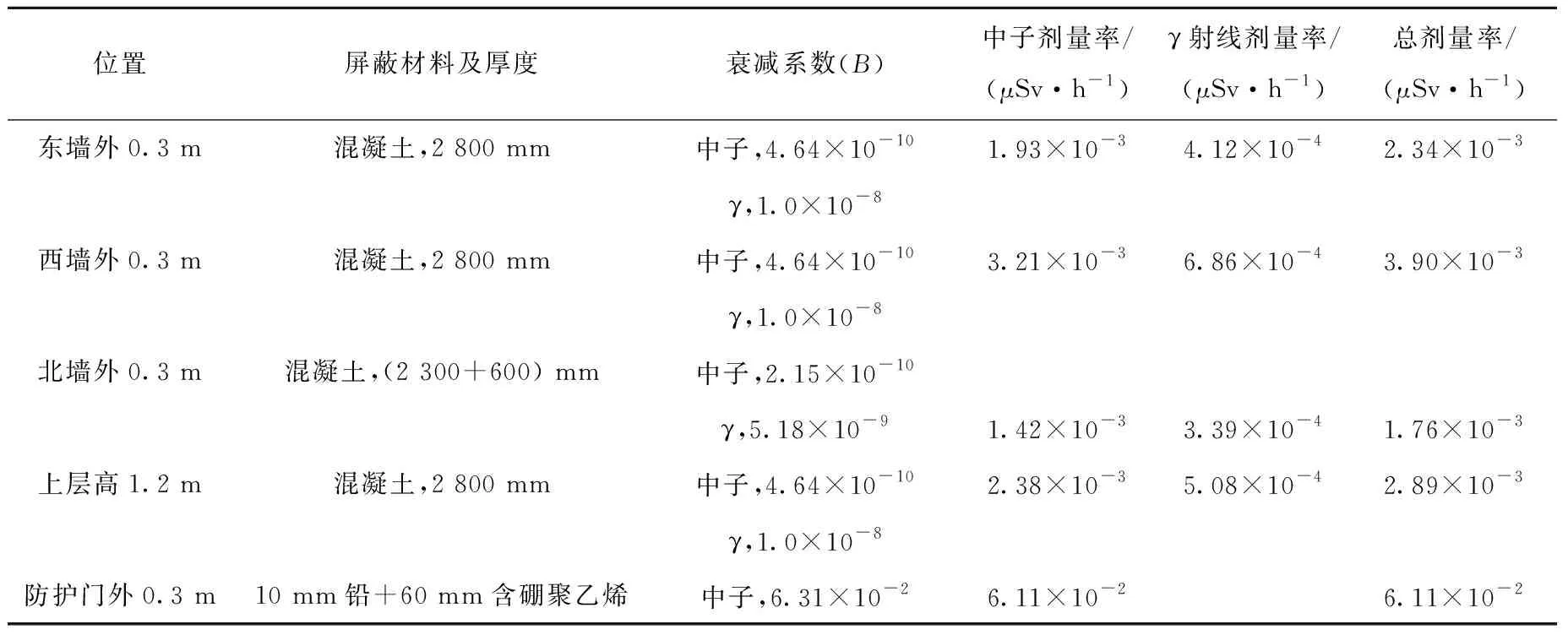
表2 回旋加速器機房屏蔽分析及劑量估算Table 2 Shielding analysis and dose estimation of cyclotron room
2.2 固體靶核素生產計劃
北京協和醫院配備的能量為16.5 MeV的PETtrace800醫用回旋加速器的內部結構示于圖4,主要性能列于表3。該加速器在合適的能量區間內適合生產18F、11C、13N、15O等傳統核素,以及68Ga、89Zr、64Cu、44Sc、123I、124I等固體靶核素。該制備系統的所有操作均可實現自動化,流程可重復度高,完全符合《藥品生產質量管理規范》的要求,還可減少操作人員在核素生產中的輻射暴露。為實現自動化操作,配備了全自動固體靶制備系統,包括PTS照射單元、金屬核素靶梭、鹵素靶梭、EDS靶梭輸送/存儲單元、PRF靶梭電鍍/純化模塊、EVP碘蒸發/升華模塊、冷卻系統以及控制系統等。同時,配備了BBS系列屏蔽熱室模塊以高度適配自動化固體靶制備系統,用于金屬放射性核素的生產、轉移及合成。所有自動化模塊根據廠家標準進行設計,獨立制備室主要完成68Ga、89Zr、64Cu、123I、124I等固體靶核素藥物的標記、分裝,也可實施44Sc核素及相關藥物的研究,并于放射性藥物實驗室進行質量控制、放射性活度檢測以及藥物分裝。根據臨床與試驗需求,設計了3條通道分別用于正電子藥物從放射性藥物實驗室到PET/CT給藥注射室、PET/MR給藥注射室與小動物實驗區放射性活性實驗室的運輸。

圖4 醫用回旋加速器PETtrace800內部結構Fig.4 Inner structure of medical cyclotron PETtrace800
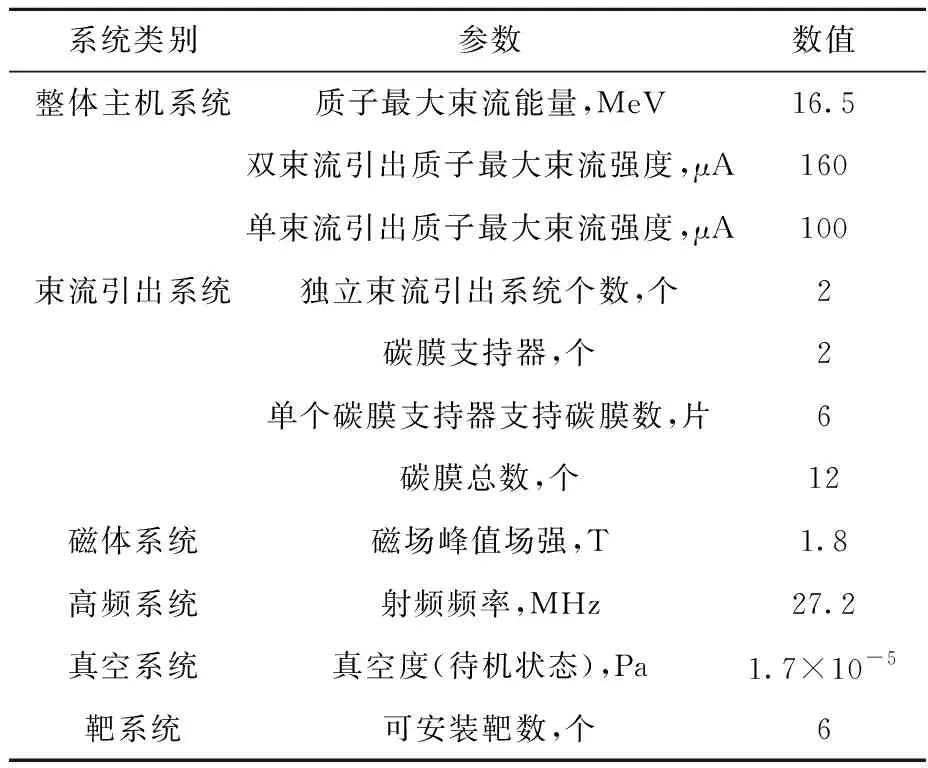
表3 PETtrace800核心配置與性能Table 3 Core configuration and performance of PETtrace800
64Cu[29]、89Zr[30]及44Sc[24]各具獨特的臨床應用價值,在固體靶金屬核素研發中占有重要地位,因此這3種核素是后期固體靶金屬核素生產的重要任務。20世紀90年代,美國波士頓大學根據64Ni(p,n)64Cu反應[31],采用富集的64Ni作為原材料生產純凈度較高的64Cu,成為PETtrace800常規生產64Cu的直接方式。89Y、90Zr、natZr與natSr均可作為原材料用于89Zr的生產,89Y和natZr可通過加速器質子轟擊靶產生89Zr,而90Zr和natSr分別需要中子及α束流轟擊生產89Zr[22]。PETtrace800基于生產成本、工藝與反應產額的考慮,根據89Y(p,n)89Zr反應,回旋加速質子到15 MeV時引出質子轟擊89Y箔,以實現89Zr常規生產的最大反應截面。PETtrace800雖沒有直接配備44Sc全自動化生產模塊,但PETteace系列產品基于44Ca(p,n)44Sc反應,在國外場地存在試驗成功的先例[13],這可為研究44Sc的生產提供設計支持。該生產會帶來一定的雜質,如44Scm、47Sc和48Sc,為此考慮將富集的[44Ca]CaCO3作為原材料,同時進一步研究高富集原材料的回收以降低生產成本。
3 總結
本文介紹了一種場地設計完備、功能區布局與輻射防護設計合理的方案,可實施64Cu、89Zr及44Sc等固體靶金屬核素的生產與研究。這些核素具有良好的物理特性,相對于經典核素18F及68Ga,表現出不可替代的優勢:64Cu的中長物理半衰期特性可實現從多肽到納米粒子的廣范圍分子量標記;具有長物理半衰期的89Zr主要用于大分子抗體標記,可為靶向治療以及免疫治療的方案制定與療效評估提供數據支持;44Sc與47Sc具有相同的藥物代謝與動力學和化學特性,可實現診療一體化。核素種類豐富、產額高,是回旋加速器固體靶金屬核素生產的兩大優勢,將有效推動核醫學產研結合與臨床轉化,促進核醫學學科的發展。

