茶樹CsLOG基因家族的鑒定和表達模式分析
田松群,姚新轉,張寶會,呂立堂,*
(1.貴州大學農業生物工程研究院/生命科學學院,山地植物資源保護與保護種質創新教育部重點實驗室/山地生態與農業生物工程協同創新中心,貴州 貴陽 550025;2.貴州大學茶學院,貴州 貴陽 550025)
茶樹是一種重要的經濟作物[1],側枝上的芽葉是其主要的生產器官,豐富的葉芽數量是獲得高產量和高質量的關鍵因素[2]。茶樹的頂端優勢很明顯,抑制了側芽的生長,且茶樹生長發育受干旱、冷脅迫等環境影響,制約茶園生產發展[3]。
細胞分類素(CKs)在消除頂端優勢、促進腋芽生長和促進枝條生長發育中有重要作用[4]。LONELY GUY(LOG)是植物激素細胞分裂素(CK)激活酶,在植物的生長發育、響應環境脅迫中有重要作用[5,6]。研究表明,LOG酶指導莖節細胞分裂素的合成,促進腋芽生長[7]。植物細胞分裂素在植物中以具有生物活性的游離堿形式存在,如iP、tZ形式[8,9],結合物則活性較低或無活性,充當儲存來源[10]。內源性細胞分裂素的合成酶有異戊烯基轉移酶(IPT)和特異性磷酸氫水解酶(LOG)[11],IPT首先合成CKs初始產物異戊烯基腺苷和順式玉米素核苷-5-磷酸,轉化為沒有生理活性前體物質;LONELY GUY(LOG)是一種在細胞分裂素特異性磷酸酯水解酶反應中將N6位修飾的腺嘌呤AMP衍生物轉化為腺嘌呤游離堿(細胞分裂素)和5-磷酸核糖的酶[12],從而把前體物質轉化為具有活性的細胞分裂素[13]。
目前,已鑒定9個擬南芥LOG基因、11個水稻LOG基因[14],13個毛白楊LOG基因家族成員[8]。通過qRT-PCR對擬南芥莖、莖生葉等組織器官LOG表達情況分析,發現7個LOG基因在根和莖中表達,LOG8表達量最高[14]。基因功能研究表明,擬南芥LOG7抑制細胞分裂素的激活,影響莖尖分生組織的生長,LOG7、LOG3和LOG4則對初生根生長發揮作用;有研究表明:LOG多突變體使得芽和根系生長嚴重受阻,其具有維持根尖缺陷分生組織的作用[15];Chickarmane等研究表明AtLOG4在頂端和花序分生組織的表皮層中表達,AtLOG7在結節原基中表達,表明LOG可能起到在分生組織中指導細胞分裂素合成作用[16];在水稻中,LOG功能的缺失會迅速終止側生分生組織的產生[17];紫花苜蓿MtLOG1、MtLOG2與根瘤原基發育和側根形成有關[18];Filippo Moramarco等研究結果推測,BP1253新型LOG響應氧脅迫[19]。但目前對LOG響應生物及非生物脅迫的研究還很少。
茶樹生長受到干旱、低溫等多種逆境脅迫。關于茶樹LOG家族基因及其逆境相關的研究尚未報道。本試驗對茶樹LOG家族基因進行基因組鑒定,并用鑒定到的茶樹、擬南芥以及楊樹LOG基因構建進化樹,進一步對其基因結構和啟動子順式作用元件等生物信息進行分析,分析各組織及其逆境下的表達差異,為茶樹LOG家族基因及其抗逆響應中的功能研究奠定基礎。
1 材料與方法
1.1 茶樹 LOG 家族基因的篩選與序列分析
從茶樹(http://tpia.teaplant.org/)和擬南芥(https://www.arabidopsis.org/)數據庫中獲取茶樹和擬南芥的全基因組數據、DNA、CDS、啟動子序列、染色體定位信息[14]。以擬南芥9個LOG基因蛋白序列作為種子序列在TPIA數據庫中進行BLASTP比對,篩選并獲得假定的茶樹LOG基因家族序列[11,14]。利用Pfam數據庫(http://pfam.janelia.org/)和NCBI保守域數據庫(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)將所有獲得的推定的茶樹LOG基因序列進行保守結構域的鑒定,剔除冗余序列,最終得到茶樹LOG基因。LOG基因的命名基于其與擬南芥基因同源度及染色體順序命名。用ExPASy Compute pl/Mw工具(http://web.expasy.org/compute_pi/)計算蛋白質的分子量(Mw)和等電點(pI)[20]。用PSORT工具(http://psort1.hgc.jp/form.html)植物來源預測蛋白質亞細胞定位。
1.2 系統進化樹和蛋白質保守基序分析
在MEGA-X軟件中,使用近鄰連接方法(Boostrap=1000)構建系統發育樹[13,14]。通過MEME(http://meme-suite.org/)進行保守結構域分析,motif數目設置為15個,motif寬度范圍設置為6~50氨基酸[21]。
1.3 染色體分布和啟動子順式作用元件分析
利用 HMM 3.0 軟件中的 perl 腳本從茶樹的基因組注釋信息中獲取CsLOG基因在染色體上的起始位置信息。在茶樹數據庫截取CsLOG基因上游2kb基因序列,并通過PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)對順式作用元件進行分析[22],最后利用 Tbtools 進行可視化。
1.4 表達模式分析
根據鑒定出的茶樹CsLOG基因的編號,在TPIA(http://tpia.teaplant.org)數據庫上下載它們在茶樹不同組織(包括頂芽、嫩葉、成熟葉、老葉、花、莖、根)、鹽脅迫、PEG誘導的干旱脅迫、茉莉酸甲酯處理和冷脅迫后的轉錄組數據(TPM值),利用TopHat和Cufflinks進行轉錄組reads的全基因組映射(Mapping),計算各個CsLOG基因的FPKM值歸一化處理并使用Office軟件制圖[23]。
2 結果與分析
2.1 茶樹LOG基因家族成員鑒定及理化性質預測
將比對的候選基因提交到SMART、Pfam、NCBI-CDD等在線網站進行保守結構域驗證,共鑒定到13個茶樹LOG基因,并根據基因在染色體的位置及其同源關系將其命名。進一步對茶樹LOG基因編碼的蛋白質進行理化性質分析(表1),結果顯示:茶樹LOG蛋白平均含有210個氨基酸殘基,其中CsLOG2a最短,含有153個氨基酸殘基;相對分子量為17.1(CsLOG2a)~24.52(CsLOG6a)kD之間;理論等電點(pI)介于4.62(CsLOG1a)~8.38(CsLOG1b)之間,同時發現 pI<7的CsLOG蛋白達到 84.6%(11個),表明大部分CsLOG蛋白富含酸性氨基酸。11個基因成員定位在細胞質和細胞核中,另外,LOG7a同時定位到細胞質和線粒體基質中,其余2個基因CsLOG5b和CsLOG5c定位到線粒體基質外,表明這3個基因可能在細胞中行使不同的功能。
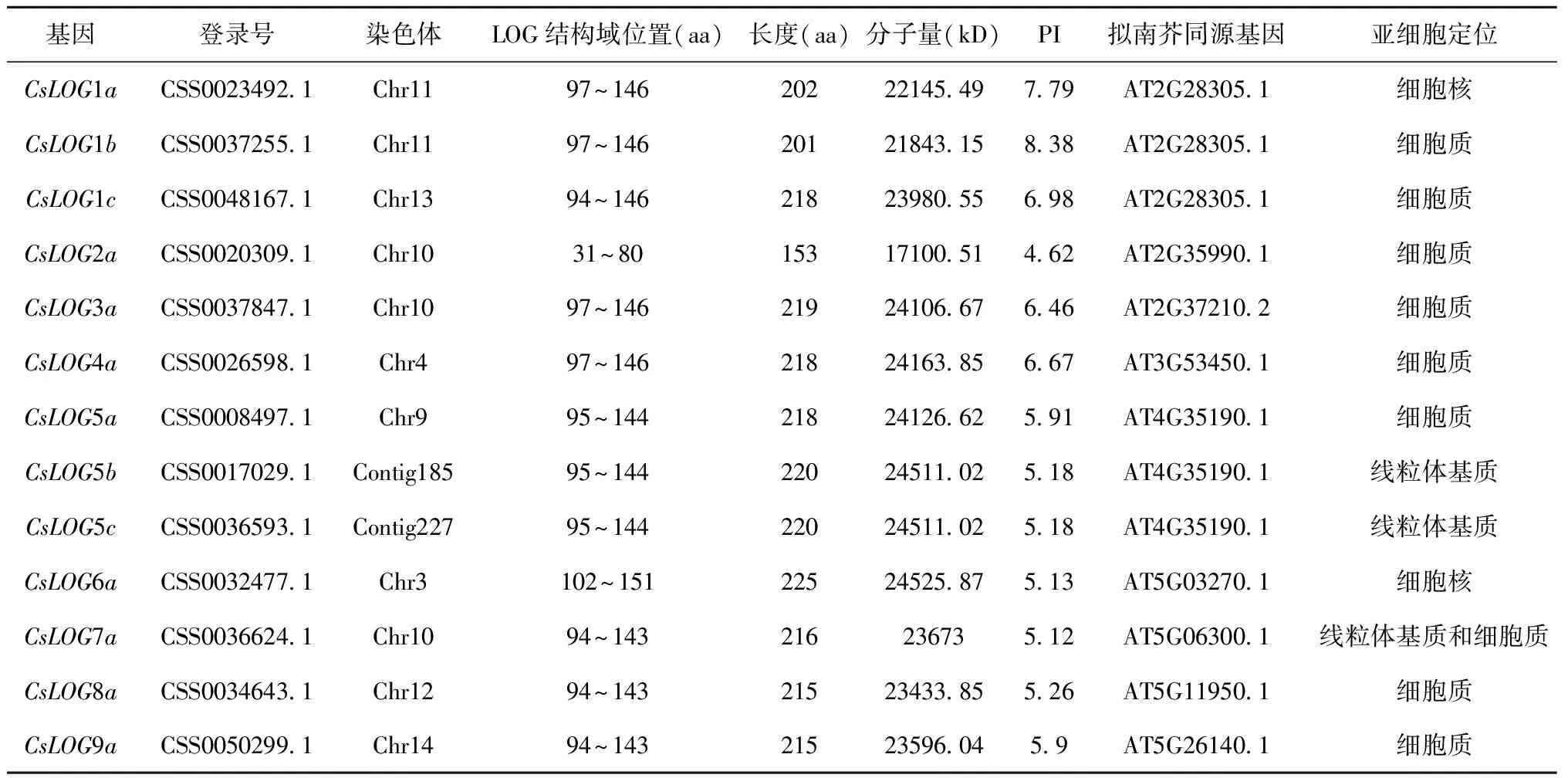
表1 茶樹CsLOG基因家族基因的特征
2.2 茶樹LOG系統進化、基因結構和保守結構域分析
為明確茶樹LOG家族成員的分類,將擬南芥LOG基因和楊樹LOG基因的蛋白序列和茶樹CsLOG蛋白進行多序列比對并構建進化樹。結果發現茶樹CsLOG基因和擬南芥、楊樹同源性很高,表明LOG基因物種分化非常保守,蛋白序列的相似性表明這三個物種的LOG基因可能具有相似的生物學功能。根據擬南芥和楊樹的同源基因分類,將茶樹LOG家族分為兩個亞族(G1、G2)(圖 1)。CsLOG6a、CsLOG8a、CsLOG9a和擬南芥AtLOG8、AtLOG9為一簇(G1),具有很高的同源性,其余基因成員為一簇(G2)。根據系統進化樹分析,LOG基因不僅在茶樹、擬南芥及楊樹中都存在,且同源性較高,表明LOG基因在物種分化過程中具有較高的保守性,進化時間也要早于茶樹、擬南芥和楊樹的分化時間。
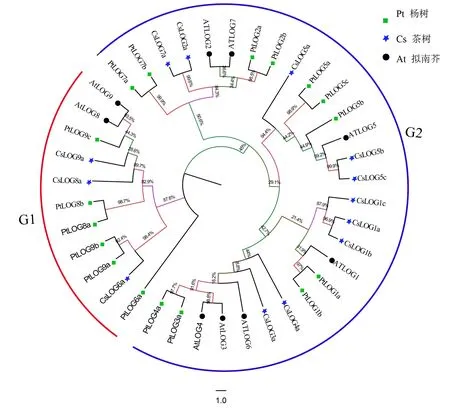
圖1 茶樹,楊樹和擬南芥LOG基因家族的系統進化樹Fig.1 Phylogenetic tree of LOGs in tea, poplar and arabidopsis
為深入了解茶樹LOG家族基因的功能,利用茶樹LOG基因組DNA序列和CDS序列對其基因結構進行分析(圖 2)。利用MEME軟件對茶樹LOG家族基因的保守基序組成和數目進行分析,鑒定到7個比較保守的motif(motif 1~7),另外每個基因都含有motif 1、motif 3、motif 4和motif 6。
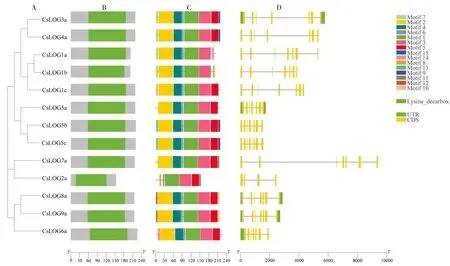
圖2 茶樹LOG基因的系統進化(A),保守功能結構域(B),保守蛋白基序(C)和基因結構(D)Fig.2 Phylogenetic relationships (A), conserved functional domain(B), the conserved protein motif(C), and basic gene structure (D) of LOGs in tea
2.3 染色體定位和啟動子順式作用元件分析
根據茶樹基因組染色體注釋信息,將鑒定到的CsLOG基因進行染色體定位(圖3)。結果顯示,茶樹LOG基因未分布到7條染色體(1、2、5、6、7、8和15號);2個CsLOG(CsLOG5b,CsLOG5c)基因不能定位到染色體上,其它11個CsLOG基因不均等地定位到不同染色體上,染色體最多含有3個LOG基因,為10號染色體,11號染色體含有2個,其余均僅含有1個CsLOG基因。說明CsLOG基因在染色體上并非均勻分布。
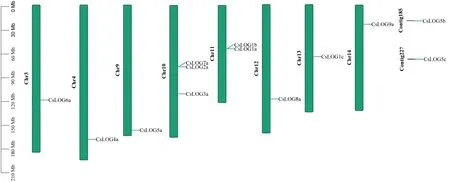
圖3 茶樹CsLOG基因在染色體上的定位Fig.3 Localization of CsLOGs in chromosome of tea plant
本研究利用茶樹LOG基因上游2000 bp的基因組序列,對CsLOG基因順式作用元件進行分析(圖4)。結果顯示,CsLOG啟動子中鑒定出含有多個與光相關的元件,如G-box、Box 4、MYB類和TGACG-motif等。同時,與激素響應相關元件的種類較多,如脫落酸(ABA)、茉莉酸甲酯(MeJA),生長素(auxin)等。另外還預測到大量響應非生物脅迫的順式作用元件:干旱響應元件MBS,厭氧誘導ARE,低溫,鹽脅迫DRE元件,低溫響應元件LTR和防御和應激反應元件TC-rich repeats(圖4),這些元件的存在表明LOG是植物反應的重要調控因子。CsLOG3a、CsLOG1a、CsLOG2a和CsLOG9a等中呈多個富集現象,如CsLOG5b有干旱響應元件兩個。對它們啟動子中所含的順式作用元件進行統計分析,可以看出,CsLOG中富含大量響應激素類及非生物脅迫等的作用元件,說明CsLOG與茶樹的生長發育及逆境脅迫響應密切相關。
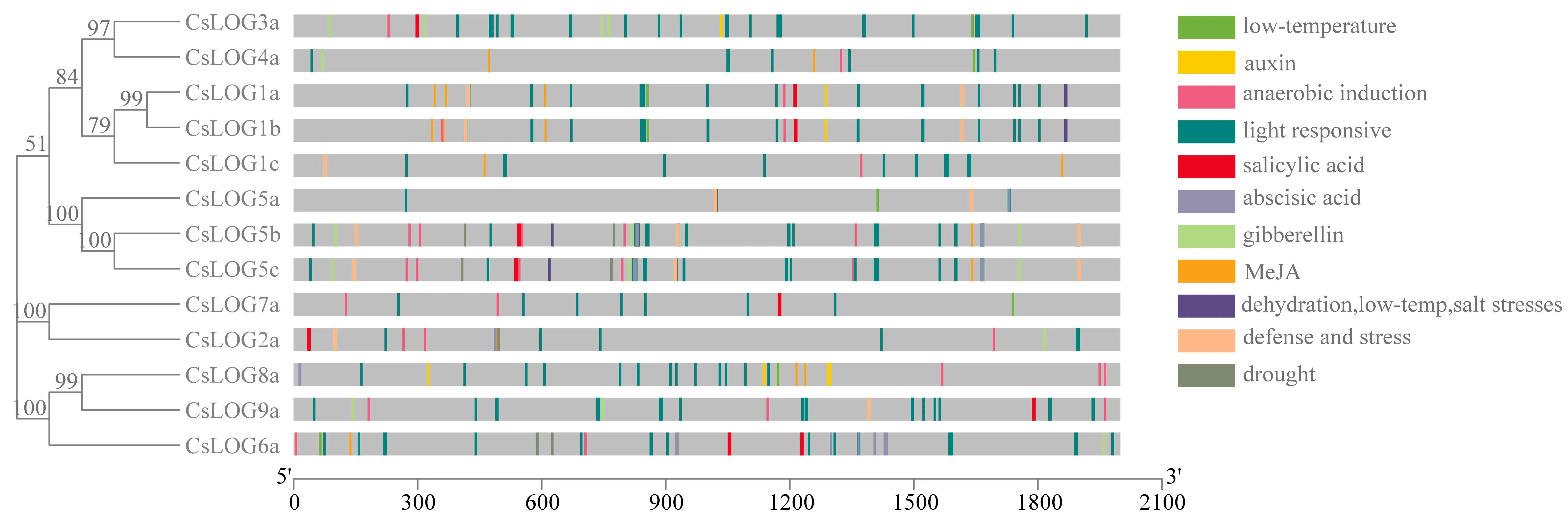
圖4 CsLOG 基因的順式作用元件分析Fig.4 Prediction on cis-acting elements in CsLOGs注:low-temperature低溫脅迫;auxin生長素響應;anaerobic induction厭氧誘導;light responsive光響應;salicylie acid水楊酸響應;abscisic acid脫落酸響應;gibberellin赤霉素響應;MeJA茉莉酸甲酯響應;dehydration, low-temp, salt stresses脫水低溫鹽脅迫;defense and stress防御與應激脅迫;drought干旱誘導。
2.4 CsLOG基因在茶樹中的表達模式分析
為進一步明確CsLOG在茶樹中的組織表達特異性,我們從TPIA中下載它們在茶樹頂芽、嫩葉、成熟葉、老葉、根、莖、花和果等8個組織轉錄組TPM表達數據,并對它們進行分析。結果顯示(圖5),CsLOG1(a/b/c)、CsLOG5a、CsLOG8a及CsLOG9a、在各個組織中表達較為顯著。在老葉中CsLOG1(a/b/c)表達高;嫩葉及成熟葉CsLOG5a表達量最高;頂芽CsLOG5a、CsLOG6a和CsLOG9a相對表達量高;花CsLOG(8a、9a)表達較顯著,莖中CsLOG(5a、9a)表達高。以上結果表明,LOG基因在芽、葉和花中表達差異明顯。CsLOG2a、CsLOG3a、CsLOG4a及CsLOG7a等4個基因具有花表達特異性,CsLOG5(b/c)、CsLOG3a、CsLOG4a、CsLOG2a及CsLOG7a在成熟葉中檢測不到表達。這說明不同的CsLOG基因可能在茶樹的不同組織部位發揮作用。
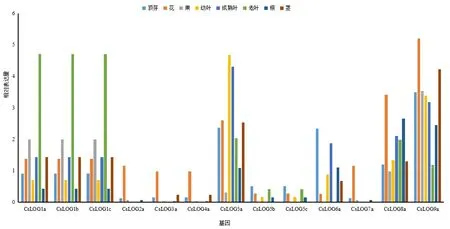
圖5 茶樹 CsLOG基因在頂芽、花、果、幼葉、成熟葉、老葉、根和莖表達模式Fig.5 Expressions of CsLOGs in apical buds, flowers, fruits, young leaves, mature leaves, old leaves, roots, and stems of tea plant
對CsLOG基因在干旱、鹽、冷及茉莉酸甲酯脅迫處理后的表達數據進行分析,結果顯示,在干旱脅迫下,與其他基因的表達水平相比,CsLOG5a、CsLOG8a和CsLOG9a的表達量較高,其中上調基因(CsLOG5a和CsLOG9a),下調有CsLOG1(a/b/c),CsLOG6a和CsLOG8a;CsLOG2a和CsLOG7a不受干旱脅迫處理的調控(圖6A)。
在鹽處理下,CsLOG5a、CsLOG9a基因的表達量在鹽脅迫中上調,CsLOG8a上調,在處理48h后下調,CsLOG1(a/b/c)、CsLOG6a個基因下調;CsLOG2a、CsLOG7a不受鹽脅迫的調控(圖6B)。
在冷處理下,CsLOG5a和CsLOG8a的表達量被誘導微下調再上調,CsLOG1(a/b/c)持續下調,CsLOG2a、CsLOG3a、CsLOG4a和CsLOG7a不受冷處理的調控(圖6C)。
在茉莉酸甲酯誘導下,7個基因CsLOG1(a/b/c)、CsLOG3a、CsLOG4a、CsLOG5a、CsLOG6a表達量被誘導上調,而CsLOG5b、CsLOG5c和CsLOG9a表達水平下調,其中CsLOG8a在處理24 h前被下調,48 h上調。同時發現CsLOG2a和CsLOG7a表達變化不受MeJA處理的調控(圖6D)。
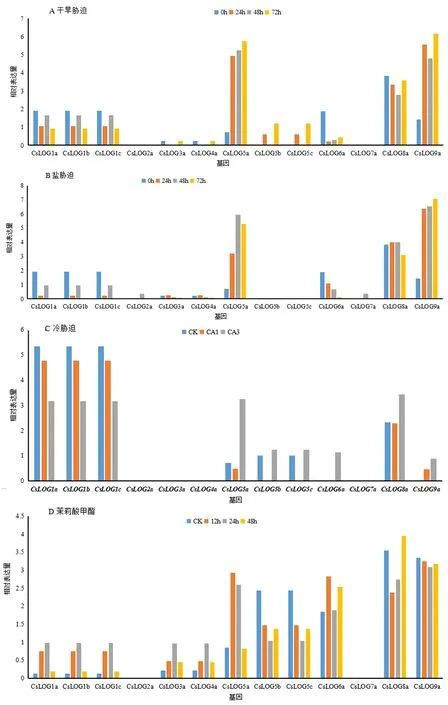
圖6 CsLOG基因在不同脅迫處理的表達模式Fig.6 Expressions of CsLOGs under various stress treatments
3 討論與結論
LOG基因家族已在多個物種中被鑒定。其中,楊樹13個[8],桃7個成員[8],水稻有10個[12],大白菜17個[13],擬南芥9個[14],紫花苜蓿有6個[18],草莓9個基因成員[25]。本研究基于全基因組共鑒定出13個茶樹CsLOG基因。11個基因成員定位在細胞質和細胞核中,與擬南芥AtLOG定位結果一致[14,24],LOG7a同時定位到細胞質和線粒體基質中,其余兩個基因CsLOG5b和CsLOG5c定位到線粒體基質外,說明這三個基因可能在細胞中行使不同的功能。基因結構和保守基序分析發現,除LOG2a保守基序所在位置靠近N端以及內含子數少外,LOG基因結構高度保守。motif1為MHxRKAxMxFxALPGGYGTxxEE是LOG保守結構域[14,22],為LOG蛋白特征序列,決定LOG蛋白功能[26]。
本研究表達模式分析發現茶樹CsLOG基因表現組織特異性。CsLOG9a、CsLOG5a、CsLOG8a、CsLOG1(a/b/c)在各個組織中表達較高。相對于其他組織CsLOG6a頂芽中表達最高,具有明顯的組織特異性;嫩葉及成熟葉中CsLOG5a表達量最高;老葉終CsLOG1(a/b/c)表達最高;花中CsLOG8a和CsLOG9a表達最高。綜上表明,LOG基因在頂芽、葉和花表達較高,結果與擬南芥大部分基因在根和莖中表達有差異[14],芽的生長會促進后期花的發育,茶樹LOG基因可能參與芽及葉的生長,而后促進茶樹花生成。研究表明,細胞分裂素激活酶LOG是植物芽及根尖分生組織活性的重要調節劑[16]。組織特異性分析結果表明,CsLOG5a、CsLOG6a分別在葉及芽中特異性表達可能參與茶樹葉芽的發育及調控作用。
茶樹CsLOG基因參與響應干旱、冷脅迫、鹽脅迫和茉莉酸甲酯脅迫響應等。研究證明LOG與環境脅迫響應相關,微生物中與LOG二型蛋白同源的結核分枝桿菌BpLOG酶與氧化應激負調控相關,BpLOG突變菌株對氧化應激敏感性低于野生型[19]。高等植物中,草莓FvLOG9個基因家族成員受干旱、高溫和高鹽脅迫調控,其中FtLOG1、FtLOG2、FtLOG5、FtLOG6和FtLOG9在各個組織中表達量均顯著高于其他基因[25]。CsLOG基因啟動子順式作用元件分析CsLOG基因含有多種光調控相關元件,與草莓LOG基因家族一致[25],可以推測光照與茶樹細胞分類素的含量密切相關[27];CsLOG5a和CsLOG9a含有低溫,防御與應激等非生物脅迫響應相關元件,在不同脅迫處理下,除低溫處理外CsLOG5a和CsLOG9a的相對表達量高。茶樹CsLOG基因不同脅迫的差異表達,推測CsLOG基因參與干旱、冷脅迫、鹽脅迫和茉莉酸甲酯脅迫響應。這些結果表明CsLOG廣泛參與茶樹的生長發育和非生物逆境脅迫響應。
生物化學研究明確LOG基因編碼細胞分裂素激活酶,植物研究表明LOG基因在植物芽發育中具有重要調節作用[15,16],本研究基于茶樹基因組鑒定出13個CsLOG基因,并分析其生物信息學特征,表達模式分析顯示CsLOG5a,CsLOG6a可能參與茶樹葉芽發育,CsLOG5a、CsLOG9a在不同脅迫下相對表達量較高,它們可能在茶樹生長發育及逆境脅迫響應中發揮重要功能。然而茶樹LOG基因家族對激素及其逆境脅迫響應的具體機制尚不明確,需要進一步探究其原理。

