腸道菌群影響非酒精性脂肪性肝病的機制及應對策略
王玉櫟,劉暢,牛辰,吳健,2,3
1. 復旦大學基礎醫學院病原生物學系, 上海 200032; 2. 復旦大學附屬中山醫院消化科,上海 200032; 3. 復旦大學上海醫學院上海市肝病研究所, 上海 200032
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是一類包含非酒精性單純性脂肪肝(nonalcoholic fatty liver,NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)及其相關肝硬化等臨床病理癥候群。NAFLD是在排除長期大量飲酒和其他肝損因素所引起,以甘油三酯等在肝細胞中蓄積為病理改變的代謝性疾病。NAFLD病因多樣,可能同時受到脂毒性、氧化應激、炎癥、胰島素抵抗(insulin resistance,IR)、表觀遺傳修飾等多種因素影響[1]。流行病學資料顯示,NAFLD已成為最常見的肝臟疾病之一,全球患病率為25.2%[2],亞洲患病率為27.4%[3],而我國平均患病率為15%,有些地區高達29%[4]。對于NAFLD的發生機制,比較流行的是“多重打擊”學說[5],在各種因素相互作用下,形成“脂質積蓄→肝脂毒性→代謝紊亂→炎癥應答→胰島素抵抗→代謝紊亂加重”的惡性循環。腸道菌群失調可參與對肝臟的多重打擊,在NAFLD發病過程中起關鍵作用。腸道與肝臟通過門靜脈相連,腸道細菌及其代謝物可以通過門靜脈進入肝臟,影響其病理生理過程。因此,腸道菌群的改變及其代謝產物被認為是腸肝對話的分子基礎或信息載體[2,6]。目前,對NAFLD發病機制的認識仍較為有限,且尚無有效治療藥物。NAFLD的干預措施側重于飲食和生活方式的改變,但由于患者依從性差,治療效果不滿意。在NAFLD的發展過程中,NASH進一步發展成肝纖維化以及肝硬化,干預NASH也就成為治療NAFLD的突破點。目前可用于治療NASH的藥物僅限于胰島素增敏劑(如吡格列酮)和維生素E。這兩種藥物在早期Ⅱ期臨床試驗中顯示對部分人群有效[7]。隨著對NAFLD患者腸道菌群的深入研究,學者們提出了一些干預腸道菌群的治療新策略,比如補充益生菌及益生元、糞菌移植(fecal microbial transplantation,FMT)、腸道菌群靶向療法(microbiome-targeted therapies,MTT)等[8]。調節、改造、重建腸道菌群或能成為NASH治療中的一種個性化干預手段。因此,深入探索腸道菌群的改變是研究NAFLD發生發展機制的重要組成部分,也是挖掘新治療手段的工具。本綜述重點介紹腸道菌群異常時影響NAFLD發生發展的過程和機制,并針對這些異常探討潛在的干預措施。
1 腸道菌群與菌群失調
腸道菌群是一組生存在腸道、與宿主共生的微生物群。腸道菌群數量眾多,總量達10萬億~100萬億,以細菌為主,并包括古細菌、真菌、原蟲、病毒等[9-10]。菌種的數量和類型處于動態平衡,是人體內穩態的一部分。細菌豐度和組成從胃到結腸遞增,表現出更高的多樣性,并且受到遺傳、年齡、生活方式、藥物和飲食的影響[8]。它們與人體共生,在食物消化及營養吸收過程中發揮重要作用,例如可以分解復雜多糖,合成多種維生素,參與膽汁酸的腸肝循環等[11]。細菌的產物在機體建立自主免疫過程中也發揮重要作用。嬰兒在出生時會獲得母體糞便或會陰菌群,初乳和母乳也是活細菌的豐富來源,具有菌群重建、免疫系統發育、食物新陳代謝和營養供應等重要的有益作用[12]。腸道菌群多樣性隨著年齡的增長而逐漸降低,老年人因衰老、體力、胃腸功能下降、營養失衡以及過度使用抗生素,其腸道菌群發生改變[13]。有研究表明,這種腸道菌群多樣性的變化會引起促炎代謝物如氧化三甲胺(trimethylamine N-oxide,TMAO)的產生,其與衰老并發的認知衰退、精神障礙等有關[14]。研究腸道菌群的常用方法主要有:16S核糖體RNA(ribosomal RNA,rRNA)基因測序、DNA全基因組測序、基因組學等。可用實時熒光定量聚合酶鏈反應(real-time fluorescent quantitative polymerase chain reaction,real-time qPCR)檢測目的基因mRNA轉錄水平,還可以通過蛋白質組學、代謝組學、液相色譜法等方法研究細菌代謝產物及微生物的組成。分離健康成人或患者糞便微生物進行特定菌系的比較也是常用手段[7,12-13,15-16]。
菌群失調是指正常的腸道菌群數量或構成比即內穩態被破壞,環境、免疫或宿主因素改變都可能導致菌群失調[17]。菌群失調可能會直接影響脂肪因子、促炎和抗炎細胞因子以及脂肪酸β-氧化的水平[12]。大量研究表明,腸道菌群在體重調節、能量代謝、炎癥和免疫應答等諸多病理生理過程中發揮重要作用,提示腸道菌群可能在NAFLD發生、發展中起重要作用[1,7,18-21]。
2 腸道菌群影響非酒精性脂肪性肝病的機制
2.1 NAFLD相關的腸道菌群異常
大量研究表明,NAFLD患者會出現腸道菌群組成比例改變或菌群失調,有研究發現NAFL兒童糞便樣本中γ-變形菌(γ-Proteobacteria)和普雷沃菌(Prevotella)數量明顯較多。在NAFL組中,厚壁菌和擬桿菌的比例比健康人群低,而乳桿菌屬在健康人群中比例較高,提示菌種間的比例失調[1]。還有研究報道,NASH患者中糞便擬桿菌、大腸桿菌、瘤胃球菌增多,而有益菌群如乳桿菌、雙歧桿菌減少[22]。糞便膽汁酸(bile acid,BA)檢測可反映兩條膽汁酸代謝通路,即“甘氨酸、絲氨酸和蘇氨酸代謝”與“牛磺酸和次牛磺酸代謝”的途徑改變。參與牛磺酸和甘氨酸代謝的細菌埃希桿菌屬(Esherichia)、嗜膽菌屬(Bilophila)和紅細菌屬(Rhodbacter)在NASH患者糞便中明顯富集[23]。與疾病早期的患者相比,NASH進展伴中度纖維化(F≥2)患者的腸道菌群有明顯不同[18]。另有研究顯示,60%的NAFLD患者其發病與感染高產酒精肺炎克雷伯菌(high alcoholKlebsiellapneumoniae,HiAlc-Kpn)相關,從NASH患者糞便分離出HiAlc-Kpn菌株移植到小鼠體內會誘發小鼠NAFLD[24]。這說明腸道菌群的改變參與NAFL、NASH發生以及其向肝硬化進展的病理過程。因研究對象及手段的差異,不同研究所發現的菌群比例變化結果常不一致。
菌群易位(bacterial translocation,BT)指胃腸道內寄生菌穿過黏膜,進入通常無菌的組織或器官[18]。從器官活檢標本、患者外周血中提取特定細菌的DNA 片段,擴增后測序,可確定有無腸道細菌易位。NAFLD起始和發展過程中,腸道黏膜屏障受損,腸道通透性增加,誘發腸道菌群易位,進而越來越多的細菌代謝產物、細菌成分和其他化合物等可通過門靜脈進入肝臟,引起炎癥反應、氧化應激和脂質堆積,最終導致脂肪性肝損傷和肝纖維化加速[7]。有研究通過原位雜交發現,高脂飼料(high fat diet,HFD)模型小鼠肝臟中有細菌存在;進一步使用相對分子質量為5×105的異硫氰酸熒光素葡聚糖(fluorescein isothiocyanate dextran,FITC-Dextran)進行活體探針共聚焦顯微鏡成像及小鼠血清FITC-Dextran熒光強度測定,發現腸道通透性明顯增加,說明腸道通透性增加會引起更多細菌及細菌代謝產物進入肝臟[25]。而NASH患者肝臟內是否有細菌存在還有待證實,故認為細菌產物影響NAFLD的作用更為明確。菌群易位也是腸道免疫狀態改變的影響因素之一[18]。促炎細胞因子,如α干擾素(interferon-α,IFN-α)、IFN-γ和白細胞介素-6(interleukin,IL-6),已被證明可以干擾腸道屏障通透性,允許腸腔抗原通過腸道屏障[19],菌群易位也會導致門脈或肝內內毒素水平增加,病原體相關模式分子(pathogen-associated molecular pattern,PAMP)在門靜脈循環中積聚,從而促進肝臟炎癥和NASH的發展,形成惡性循環[22]。細菌易位增加還會產生過量脂多糖(lipopolysaccharides, LPS),刺激內皮細胞Toll樣受體4(Toll-like receptor-4,TLR4)和樹突狀細胞TLR9,誘導炎性小體和促炎細胞因子產生,進一步破壞腸道黏膜通透性和降低肝臟的胰島素敏感性,從而增加內臟和皮下脂肪[20]。
2.2 腸道菌群異常對NAFLD發病過程的影響
2.2.1 影響膽汁酸代謝及法尼醇X受體、G蛋白偶聯膽汁酸受體信號通路通過干擾膽汁酸代謝,菌群異常可間接影響回腸和肝臟中的法尼醇X受體(farnesoid X receptor,FXR)和G蛋白偶聯膽汁酸受體1(G protein-coupled bile acid receptor 1,Gpbar1,又稱Takeda G protein-coupled receptor 5,TGR5)發揮作用,進而引起肝臟脂質代謝紊亂、炎癥和纖維化[12]。腸道菌群異常會改變膽汁酸的組成和比例,其中次級膽汁酸如FXR拮抗劑脫氧膽酸(deoxycholic acid,DCA)的相對含量顯著增加,而初級膽汁酸如FXR激動劑鵝去氧膽酸(chenodeoxycholic acid,CDCA)的相對含量顯著降低[26]。同時腸道處于炎癥狀態,其屏障功能紊亂會降低腸道FXR的表達。FXR拮抗劑增加及FXR低表達會引起肝臟脂質堆積和血漿甘油三酯升高,并影響極低密度脂蛋白(very low-density lipoprotein,VLDL)的清除過程[21]。膽汁酸增多還會誘導巨噬細胞TGR5信號,導致促炎細胞因子的產生[27]。TGR5可激活腺苷酸環化酶-cAMP和表皮生長因子受體(epidermal growth factor receptor,EGFR)-src激酶途徑,src激活引起蛋白激酶C(protein kinase C,PKC)的激活。因此,依賴PKC的TGR5激活導致核因子-κB(nuclear factor-κB,NF-κB)激活,促炎細胞因子IL-1β、IL-6和腫瘤壞死因子(tumor necrosis factor,TNF-α)表達增加,加重了肝臟的炎癥免疫反應[28]。
2.2.2 影響脂肪累積研究發現,伴隨著腸道菌群失調,NAFLD和肥胖使機體從飲食中獲取能量的能力增強,增加了脂肪累積。將高脂飼料所致肥胖小鼠的糞便微生物移植給正常飼料喂養的普通小鼠,發現它們比移植正常飲食小鼠糞便微生物的小鼠獲得了更多的脂肪沉積[23]。腸道菌群構成的變化會導致機體吸收更多的脂質,促進脂肪酸的生物合成[1]。腸道菌群還可以通過短鏈脂肪酸(short chain fatty acids,SCFAs)或膽汁酸誘導或抑制血管生成素樣蛋白4(angiopoietin-like protein-4,AGTPL-4)介導脂蛋白脂酶(lipoprotein lipase,LPL)活性,進而影響肝外脂肪的分解及肝內脂肪的蓄積[21]。改變腸道菌群的構成可以緩解NAFL向NASH發展。近期研究發現,乳酸菌可通過減少宿主腸道脂肪酸吸收從而減輕肝臟脂肪累積[29]。
2.2.3 誘發或促進胰島素抵抗普雷沃菌和尋常型桿菌(Bacillusvulgaris)在胰島素抵抗患者中檢出率增加[30],提示腸道菌群變化與胰島素抵抗有關。研究表明細菌壁外膜上的LPS可通過TRL4作用于脂肪細胞和巨噬細胞,釋放多種炎癥細胞因子,從而誘發胰島素抵抗[4]。胰島素敏感度下降使血液中葡萄糖的利用率下降,β胰島細胞處于代償性高分泌狀態,導致高胰島素血癥。而高胰島素血癥進一步損害肝臟中的胰島信號通路,形成惡性循環[31]。胰島素抵抗會引起血糖水平紊亂、損害糖原合成,將葡萄糖作為脂肪合成的底物[30];還可促進甘油三酯(triacylglycerol,TG)積聚,引起肝細胞損傷、炎癥及纖維化[32],從而加重NAFLD。
2.2.4 影響膽堿代謝腸道菌群失調會改變膽堿代謝,降低宿主膽堿的生物利用度[33]。革蘭氏陰性γ蛋白細菌和產芽孢菌(Erysipelotrichi)的水平升高會導致膽堿缺乏、TMAO產生增加,并引起脂肪變性[8]。膽堿生物利用度的降低可導致機體無法合成磷脂酰膽堿(phosphatidylcholine,PC),而PC對VLDL的組裝和分泌極為重要[23]。PC缺乏會促使脂肪酸合成,從而導致甘油三酯增加。缺乏PC的脂滴表面活性會降低,容易形成較大脂滴,并難以被脂蛋白脂酶分解[21]。總之,菌群失調會影響一碳代謝,減少宿主的膽堿庫,使機體處于膽堿缺乏狀態, VLDL分泌減少,導致肝臟脂肪堆積[33]。這也是蛋氨酸膽堿缺乏飼料(methionine/choline-deficient diet,MCD diet)引起脂肪性肝炎的機制。
2.2.5 細菌代謝產物對機體的影響菌群失調或菌群組成紊亂后,許多腸道微生物成分或代謝物,如肽聚糖[7]、三甲胺[21]、次級膽汁酸[27]、短鏈脂肪酸[12]、支鏈氨基酸[27]、乙醇[22]等發生改變,進入血液循環系統,發揮促炎、改變基因表達、代謝修飾和毒性等多重作用,并調節肝臟脂肪合成,影響NAFLD的發生和進展[27]。
高脂飲食降低了食物多樣性,纖維素攝取減少導致腸道來源的SCFAs分泌減少,而SCFAs是維持穩態的重要因素[34]。SCFAs可以激活L細胞(腸道內分泌細胞的一種)表面G蛋白偶聯受體(G protein-coupled receptor,GPCRs)GPR41和GPR43,通過多種途徑影響NAFLD的發生[12]。當SCFAs中丁酸比例下降時,脂肪因子(adipokine)的釋放增加,碳水化合物反應原件結合蛋白(carbohydrate response element-binding protein, ChREBP)和膽固醇調節原件結合蛋白-1(cholesterol-regulatory element-binding protein-1, SREBP-1)的活性因失去丁酸的抑制作用而增強,從而促進脂肪合成及脂質沉積[12,35]。SCFAs對抗炎、維持腸上皮屏障的完整性很重要[34]。SCFAs的減少使其難以抑制特定病原菌的繁殖,機體胰島素敏感性降低,導致腸道黏膜通透性增加,加劇了NAFLD的發展進程[36]。
研究發現NASH患者的腸道菌群中產酒精性菌,如HiAlc-Kpn、溶細胞素陽性糞腸球菌增加[37-38]。這兩類細菌的過度生長使乙醇產量增加,腸黏膜屏障破壞使乙醇進入血液循環中,進一步加重肝臟炎癥、活性氧(reactive oxygen species,ROS)釋放和腸道高通透性[39]。酒精在腸道代謝的副產品乙醛也可通過損壞細胞間緊密連接的完整性而削弱腸屏障,導致細菌易位和內毒素血癥[22]。腸道通透性的增加促使更多代謝產物及病原微生物進入血液循環,枯否細胞和肝星狀細胞被激活,炎性細胞因子大量釋放,加重NASH及肝臟纖維化[1]。腸道菌群異常與NASH發病關系的研究已取得顯著進展,然而因NASH發病機制的多樣性,或因研究手段所限,往往缺乏直接證據證實兩者間的因果關系。圖1 總結了腸道菌群在NAFLD/NASH發生、發展中的作用。
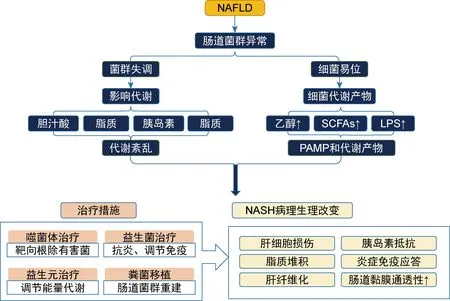
NAFLD會導致腸道菌群異常。菌群失調易引起膽汁酸、脂質、胰島素、膽堿代謝紊亂,與細菌PAMP和代謝產物共同作用于機體,進一步引發NASH病理生理改變。
3 治療新策略
3.1 微生物組靶向療法
微生物組靶向療法(microbiome-targeted therapies, MTT)通過使用抗生素、益生菌、益生元或FMT等手段,糾正或重建腸道菌群,達到治療腸道或其他疾病的目的[40],是治療NAFLD的新策略。商品化的鏈球菌、乳桿菌、雙歧桿菌可以改善抗炎環境,有助于腸上皮細胞的生長和存活,并可通過調節免疫系統和宿主防御來對抗病原菌[32]。乳酸桿菌和雙歧桿菌作為可安全食用的益生菌,能夠降低血膽固醇[15]。補充益生元如乳果糖、寡果糖、菊糖可刺激胃腸肽釋放,具有調節機體食欲和能量代謝的作用[41]。但值得注意的是,有研究發現給予TLR5基因敲除(TLR5-deficient,T5KO)小鼠富含可溶性纖維素菊糖(7.5%)飲食時,小鼠的膽紅素升高。說明過量攝入菊糖可能會引起肝臟損傷,因此應當在醫生指導下適當補充益生元,以免對身體造成危害[42]。表1 總結了常用益生菌、益生元干預NAFLD或NASH的臨床研究現狀。FMT是一種全面調節腸道菌群的方式,已被證明能夠有效恢復健康的菌群組成[7],并可用于治療艱難梭菌相關性腹瀉和偽膜性結腸炎,以及其他慢性腸道炎癥性疾病,如潰瘍性結腸炎、Crohn氏病等[32]。有研究表明,進行FMT后,HFD小鼠腸道菌群紊亂得到糾正,腸道緊密連接蛋白(Zonula occludens-1,ZO-1)增加,NASH明顯減輕[50]。但FMT治療NASH患者的臨床研究還未見有報道。
3.2 選擇性干預特定菌群(噬菌體治療)
使用特殊菌群或細菌產物干擾NASH也可能成為新的治療手段或藥物研發方向。有報道稱使用黏液阿克曼菌(Akkermansiamuciniphila)可改善肝功能、減輕氧化應激、抑制炎癥、使腸道菌群正常化,并逆轉高脂飲食引起的代謝紊亂[23]。一些次級膽汁酸產生菌如乳桿科菌(Lactobacillaceae)和毛螺科菌(Lachnospiraceae)表現出降低膽固醇的潛力,可以改善高脂飲食下的代謝異常狀態[51];還有研究發現,由細菌產生的特定膽汁酸可以調節腸道菌群結構,恢復菌群的平衡狀態[7]。
通過研究細菌組成及豐度變化,在確定特定細菌影響NAFLD發生、進展的機制或二者具有因果關系后,可使用靶向特定細菌的噬菌體根除該細菌,消除其對NAFLD患者康復的不利影響,且不會影響其他細菌的正常功能[38]。例如使用噬菌體靶向根除HiAlc-Kpn后可有效緩解NAFLD模型鼠的細菌性自動釀酒綜合征及NASH[24]。Nature發表1項研究稱,對酒精性肝炎患者FMT誘導的小鼠肝病模型,使用以溶細胞糞腸球菌為靶點的噬菌體能降低肝臟中的溶細胞素,并消除小鼠的酒精性肝損傷[38]。說明噬菌體治療可以特異性地消除某種細菌,為精確修飾腸道菌群提供了一種可靠的方法。
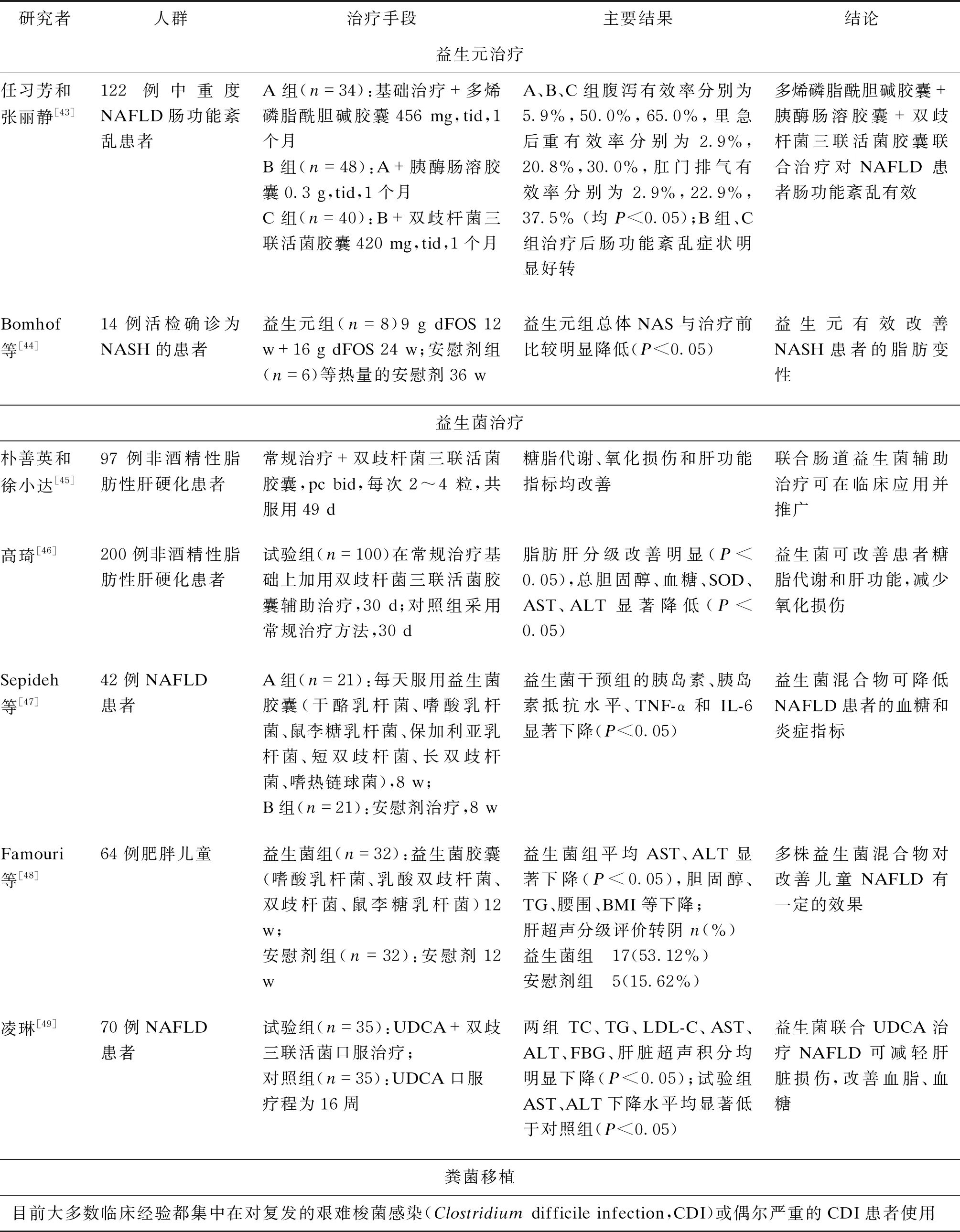
表1 微生態靶向干預NAFLD的部分臨床試驗研究報告
4 結語
腸道菌群異常會進一步影響NAFLD的發生、進展,甚至形成惡性循環。如何利用腸道菌群改變或阻斷NASH的發展進程,尋找細菌及細菌產物作為潛在靶點對干預NASH十分關鍵。益生菌、益生元、FMT、噬菌體治療等都是有前景的新策略[52]。然而,特定的微生物菌株或菌群是否與NASH發生有因果關系,并成為其治療手段還未在機制上得到肯定。整個腸道菌群不能成為精準控制的目標,菌株間的協同效應也缺乏探索。目前研究受到的限制包括:缺乏檢測完整腸道菌群及細菌易位的非侵入性方法,腸道特定細菌分離困難且培養要求嚴格等。但令人振奮的是,腸道菌群對于治療NASH有巨大的潛能,深入探索腸道菌群組成或將為NAFLD帶來新的診斷手段和個性化治療方法。

