‘黃樽’薄葉金花茶組培苗生根與移栽技術研究
吳麗君,游云飛,陳 達,陳文榮,李文芳
(1.福建省林業科學研究院,福建 福州 350012; 2.福建省洋口國有林場,福建 順昌 353211;3.國家林業和草原局南方山地用材林培育重點實驗室,福建 福州 350012;4.福建省森林培育與林產品加工利用重點實驗室,福建 福州 350012)
金花茶組植物(CamelliaSect.nitidissimaChi)是山茶科山茶屬植物中唯一開金黃色花的珍稀觀賞植物[1-4],素有“植物界的大熊貓”“茶族皇后”之美稱[1],具有較高的觀賞價值和育種價值;金花茶花、葉富含茶多酚、黃酮等對人體有益的天然營養物質,藥用價值高[5]。
隨著金花茶觀賞、藥用價值的不斷開發和利用,金花茶人工種植面積逐年增長,種苗供不應求。組培快繁是植物良種快繁的主要技術途徑,組培苗生根率和移栽成活率是組培產業化的重要技術指標。山茶科植物,組培生根及移栽成活率低[6]一直是金花茶組培產業化的瓶頸[7]。黃曉娜等[7]研究了金花茶試管苗瓶外生根技術,但生根成活率遠低于生根率;李桂娥等[8]通過生長調節劑處理芽苗促進了金花茶組培苗不定根的發生,但操作復雜,難以普及推廣。筆者以‘黃樽’薄葉金花茶(C.chrysanthoides‘Huangzun’)[10-12]為材料,在優選培養基的基礎上,優化和提升生根培養和移栽技術,為金花茶組培產業化提供參考。
1 材料與方法
1.1 材料選取與處理
以‘黃樽’薄葉金花茶繼代苗為原材料。‘黃樽’薄葉金花茶是福建省林業科學研究院于2017年通過審定的金花茶良種[9-11],省林木良種編號:閩R-SV-CC-027-2017。
選用培養60 d以上的繼代苗,切取帶頂芽、苗高2.0 cm以上的單芽為生根試驗材料。每個單芽含3枚以上舒展葉片,葉長0.5 cm以上,葉片轉綠或淺綠,苗徑0.5 mm以上。金花茶組培苗葉片較大,為方便操作,接種時將苗基部1.0 cm以下的葉片切除。
1.2 基本培養基與植物生長調節劑組合的篩選
采用L9(33)設置基本培養基(1/2 B5、3/4 B5、B5)、ABT(0、0.5、1.0 mg/L)、吲哚丁酸(IBA)(0、0.5、1.0 mg/L)處理正交組合形成9種生根培養基[12]。每種培養基接芽苗30株,重復3次,轉接60 d,統計生根率。培養基均附加15 g/L白糖、瓊脂6.0 g/L,調制其pH為5.8[8]。
1.3 培養基質與附加物組合的篩選
以1/2 B5+ABT 0.5 mg/L+IBA 0.5 mg/L為基本培養基,2種培養基質[V細河沙∶V蛭石=1∶1(河沙蛭石基質)、瓊脂]與2種附加物(白糖、活性炭)形成5種組合,即:①瓊脂6.0 g/L+白糖0 g/L;②瓊脂6.0 g/L+白糖15 g/L;③瓊脂6.0 g/L+白糖15 g/L+活性炭3.0 g/L;④河沙蛭石基質+白糖0 g/L;⑤河沙蛭石基質+白糖15 g/L,調制pH為5.8[8]。每個組合接芽苗30株,重復3次,芽苗轉接60 d,統計生根率,觀察芽苗根系生長情況。
組合④的制備:將粒徑1.0~2.0 mm細河沙經清水淘洗濾干,與粒徑2.0~3.0 mm蛭石按體積比1∶1均勻混合制成河沙蛭石基質,用上述基本培養基溶液浸泡混合基質約30min后,濾去多余水分,裝入培養瓶,經高溫高壓(溫度121 ℃、壓力1.1 kg/cm2)滅菌30 min[12]。組合⑤的制備參照④。
芽苗接種在河沙蛭石基質上,應先用接種針在基質上打出小孔,再將芽苗插入基質孔中,插入深度以苗高的1/3~1/2為宜;接種后,輕輕敦實基質,確保芽苗基部與基質接觸良好。
1.4 補充白糖、K2HPO4
以組合④,即河沙蛭石基質+1/2 B5+ABT 0.5 mg/L+IBA 0.5 mg/L為生根培養基,培養35 d(此時部分芽苗基部發根),分別補充經滅菌的⑥白糖15.0 g/L、⑦K2HPO415.0 mg/L、⑧白糖15.0 g/L+K2HPO415.0 mg/L、⑨CK(對照組,不補充白糖和K2HPO4)形成4種處理。每個處理芽苗30株,重復3次。
生根培養60 d后,4種處理的生根苗經7~10 d煉苗后,移栽到移栽專用基質(V細河沙∶V蛭石=3∶1)上;栽后采用塑料薄膜和遮光率75%的遮陰網覆蓋,保持拱棚內空氣濕度85%、溫度(24±4) ℃,直至小苗長出新葉,再逐漸打開遮陰網和薄膜[7,12]。
移栽前調查生根率、黃化率、平均莖粗;移栽60 d后,統計移栽成活率[11]。
1.5 生根培養條件
培養室溫度為(24±2) ℃;生根培養前15 d,光照度150~300 lx;培養15~35 d,光照度1 200~1 500 lx;培養35~60 d,光照度1 800~2 300 lx;移栽前煉苗,可充分利用自然散射光,避免陽光直接照射[12]。
1.6 數據分析
數據采用SPSS軟件分析,Tukey法多重比較。
2 結果與分析
2.1 基本培養基與植物生長調節劑組合對生根率的影響
9種(組合)培養基的生根率見表1,其方差分析結果為F培養基=70.3>F0.01(8,16)=3.89,P培養基=0.000 1;表明培養基對生根率的影響達極顯著水平。依據生根率極差值(RABT>R基本培養基>RIBA)推斷,對生根率影響大小依次為ABT、基本培養基、IBA。多重比較表明培養基2號和3號的生根率分別為42.2%和41.1%,與其他培養基生根率達極顯著差異。因此,較優的培養基為1/2 B5+ABT 0.5~1.0 mg/L+IBA 0.5~1.0 mg/L。培養基7號、8號和9號的芽苗生根率低且葉片厚質化,這可能與基本培養基B5含較高濃度鹽有關[13]。

表1 基本培養基與植物生長調節劑組合對生根率的影響
2.2 培養基質與附加物組合對生根率的影響
不同培養基質與附加物組合對生根率的影響情況見表2。5個組合中,平均生根率最高是組合④,其次為⑤,分別為84.4%和68.9%;平均生根率最低是組合③,為33.3%。河沙蛭石基質平均生根率均高于瓊脂,且芽苗粗壯,葉片舒展,根系發達,須根多。可見,具有良好透氣性和持水性的河沙蛭石基質較透氣性差的瓊脂更有利于根的誘導與生長[13]。無附加物的組合①和④的平均生根率均高于對應附加白糖或白糖+活性炭的組合②、③和⑤。肖玉蘭[13]認為無糖培養基可以促進植株盡早生根,提高生根率;譚文澄等[14]認為白糖培養基較高的滲透勢和活性炭的吸附性不利于芽苗生根。

表2 不同培養基質與添加物組合對生根率的影響

圖1 瓊脂上(A)和河沙蛭石基質上(B)的生根芽苗Fig.1 Rooting shoots on agar and substrate with sand and vermiculite
平均生根率方差分析結果為F組合=104.38>F0.01(4,8)=7.01,P組合=0.000 1;表明培養基質與附加物組合對生根率的影響達極顯著水平。多重比較表明組合④即無附加物的河沙蛭石基質平均生根率最高,為84.4%,極顯著高于其他組合,因此最優組合為④。
生根培養后期,組合④有部分芽苗葉片黃化易脫落,而組合⑤芽苗葉色正常,顯然無糖的河沙蛭石基質有利于芽苗生根,但不利于芽苗后期生長。
2.3 補充白糖、K2HPO4對生根率、移栽成活率和黃化率的影響
補充白糖或K2HPO4等4種處理對芽苗生根率、移栽成活率和黃化率的影響見表3,芽苗生根率方差分析結果為F處理=2.695 表3 補充白糖與K2HPO4對芽苗生根率、移栽成活率和黃化率的影響 處理⑧和⑥未見芽苗黃化,對照組⑨和處理⑦芽苗均有黃化現象。植物異養條件下,糖是植物細胞代謝的主要能源,是植物離體培養必不可少的物質[13],因此生根培養后期補充白糖15.0 g/L利于芽苗后續生長。處理⑧的芽苗葉片濃綠、粗壯,平均莖粗2.16 mm,最大莖粗2.80 mm(圖2);處理⑥的芽苗葉色淡綠;因此綜合芽苗生根率、黃化率及長勢,最佳處理是⑧。 另外,試驗觀察到無糖的河沙蛭石基質(V細河沙∶V蛭石=1∶1)上,芽苗污染率較瓊脂培養基的芽苗污染率低,約0.5%。傳統培養基中的糖和瓊脂(或卡拉膠)是造成污染的主要原因[13],芽苗污染率通常為2%~5%[15]。 表3中,處理⑧和⑥的移栽成活率較高,分別為93.9%和90.1%;方差分析結果:F處理=211.5>F0.01(3,6)=9.78,P處理=0.000 1,表明4種處理的移栽成活率差異極顯著。多重比較結果表明:處理⑧和⑥的移栽成活率與對照組⑨和處理⑦差異極顯著;說明生根培養后期補充白糖可顯著提高芽苗移栽率成活率。綜合考量生根率、移栽成活率、芽苗黃化率和長勢等指標,最佳處理是⑧,即生根培養后期補充白糖15.0 g/L+K2HPO415.0 mg/L。 圖2 補充白糖+K2HPO4的生根芽苗及移栽情況Fig.2 Rooting shoots and transplantation situation on substrate added sugar and K2HPO4 ‘黃樽’薄葉金花茶在傳統的白糖瓊脂培養基上,未獲得理想的生根效果,在優選的培養基1/2 B5+ABT 0.5~1.0 mg/L+ IBA 0.5~1.0 mg/L+白糖15 g/L+瓊脂6.0 g/L上,培養60 d,生根率僅為42.2%~41.1%。 不同培養基質(河沙蛭石基質、瓊脂)與附加物(白糖、活性炭)組合對‘黃樽’薄葉金花茶生根率影響極顯著,以河沙蛭石基質替代培養基1/2 B5+ABT 0.5~1.0 mg/L+IBA 0.5~1.0 mg/L中的瓊脂和白糖,平均生根率達84.4%,且芽苗粗壯、葉片舒展、根系發達。李桂娥等[8]通過液體濾紙橋培養法改善了根的誘導環境,提高了金花茶生根率,但該培養法不便于普及推廣。因此對于組培生根困難植物,選擇透氣性基質結合無糖或低濃度糖培養,以改善根的誘導環境是提高生根率的有效方法[13]。此外,采用無糖的河沙蛭石基質生根培養,也可大幅度降低芽苗污染率。 在生根培養基(河沙蛭石基質)+1/2 B5+ABT 0.5 mg/L+ IBA 0.5 mg/L上培養35 d后,分別補充白糖15.0 g/L、K2HPO415.0 mg/L、白糖15.0 g/L+K2HPO415.0 mg/L及CK等4種處理對平均生根率的影響不顯著,但對移栽成活率影響極顯著;補充白糖15 g/L+ K2HPO415.0 mg/L,有效克服芽苗黃化,提高芽苗質量,進一步提高了芽苗生根率和移栽成活率,芽苗生根率和移栽成活率分別為91.1%和93.3%。參考對組培苗的培養優化措施[16],K元素能夠促進植物生長健壯,保障各種代謝活動的順利進行[17],K2HPO4或KH2PO4富含K離子,因此被廣泛用于調控植物的生長發育。單妍[16]用KH2PO4處理香糯竹黃化組培苗,獲得了較好效果。適宜濃度KH2PO4噴施桃葉和月季葉片可增加葉綠素含量和葉片干質量[18-19],對月季新梢的莖長和莖粗有明顯的促進作用[19]。徐莉莉等[20]研究認為噴施KH2PO4能顯著提高紅葉桃的凈光合速率。‘黃樽’薄葉金花茶生根培養時間長達60 d以上,較長時間的無糖培養勢必因碳源缺失導致芽苗葉片黃化;因此,及時補充糖等碳源物和K2HPO4,對提高芽苗質量,進而提高芽苗生根率和移栽成活率是極為有利。 綜上所述,‘黃樽’薄葉金花茶通過傳統的白糖瓊脂培養法,生根率低、芽苗長勢差,且芽苗移栽成活率低;而用河沙蛭石基質(V河沙∶V蛭石=1∶1)+1/2 B5+0.5~1.0 mg/L+IBA 0.5~1.0 mg/L的無糖培養法,培養后期補充白糖15 g/L+K2HPO415.0 mg/L,是提高‘黃樽’薄葉金花茶生根率和移栽成活率的有效方法,也是其他組培生根困難的植物尤其是金花茶組植物離體培養可借鑒的培養方法。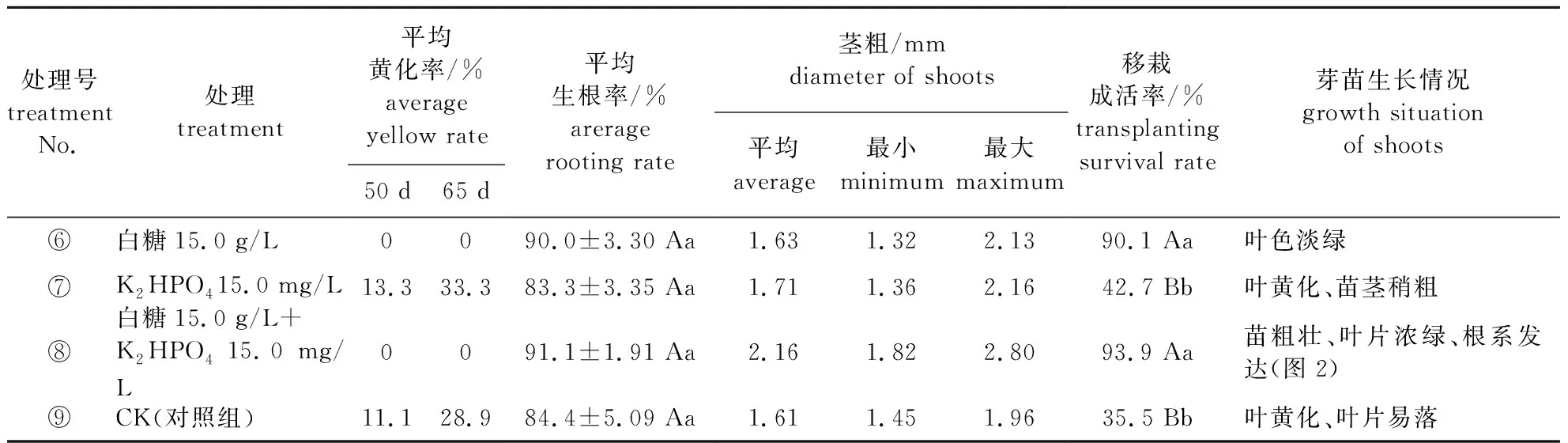

3 討 論

