α-磷酸三鈣/α-半水硫酸鈣復合骨水泥的制備及力載荷下的性能研究*
宋亞萍,連小潔,2,高志鵬,2,侯丁煜,黃 棣,2,魏 延,2
(1. 太原理工大學 生物醫學工程學院生物醫學工程系,納米生物材料與再生醫學研究中心,太原 030024;2. 太原理工大學 生物醫學工程研究所,材料強度與結構沖擊山西省重點實驗室,太原 030024)
0 引 言
在人體中,骨骼除了支撐人體外,還可以保護內部器官;貯存礦物質;在運動系統中傳遞力。在日常生活中,衰老、感染、腫瘤、創傷、骨髓炎手術清創以及先天性疾病都可能導致骨組織的結構完整性受到一定的破壞,臨床上稱為骨缺損。
目前,骨缺損有很多類型,例如骨折,臨床手術中保守的治療方法為對受損部位通過石膏、夾板、支具等進行固定,手術治療方法為鋼板固定、經皮穿針等,研究表明,保守的治療方法無法滿足患者對骨功能修復的要求,手術治療方法會引起相應的并發癥[1]。再如骨不連,人體組織自身的修復潛能無法保證受損骨可進行局部骨誘導生成新骨,且會在一定程度上引起炎癥流膿,從而產生積液,臨床上需要進行骨移植治療[2]。最大程度減輕病人的痛苦,減少手術創傷,減少手術并發癥的幾率至關重要[3]。
對骨折引起的骨移位及骨裂縫,難以自我愈合的骨不連,制備一種骨黏合劑來輔助治療效果更佳,既可固定骨折,也可以減少甚至避免鋼板等金屬材料的植入[4],暫時填補骨缺損帶來的組織空缺,減少機體由于處于不穩定環境下而采取的一系列過激的保護措施,減少引發炎癥的概率,除此之外,還可以通過載藥誘導受損骨兩端骨細胞長入骨黏合劑,并分泌有關物質使其降解,從而完成骨重建。因此找到一種較為安全的骨黏結劑,使用注射器將其注射到缺損部位,實現微創修復就成了骨缺損患者的福音[5]。
本文研究旨在找到一種可降解性骨修復材料,在不影響骨的正常形態的情況下,填補骨缺損,一來減少炎癥的發生,二來作為缺損部位骨細胞長入的支架,在骨重建的過程中逐漸降解。
人體骨在納米結構上由無機物質羥基磷灰石(hydroxyapatite, HA)晶體與有機蛋白(糖蛋白、膠原蛋白、蛋白多糖)按一定的比例組合而成,HA的含量決定了骨的力學強度[6]。為使新骨與原本骨結構相似,骨黏合劑應為與HA結構相似的物質從而更好的模擬人體骨結構。HA晶型屬于六方晶系,在晶粒生長過程中沿a、c軸的方向生長或隨機生長其晶體形態不同,目前研究發現,其沿c軸生長的晶體形貌為板片狀,各性能也與人體內HA更為相似[7-9]。
研究表明,磷酸鈣骨水泥(calcium phosphatecement,CPC)水化產物可逐步轉化為HA[10],具有良好的生物相容性、生物安全性、自固化性、可塑性、可降解性、可載藥性[11-12],因此磷酸鈣骨水泥更適合作為骨黏合劑來修復骨缺損。磷酸鈣骨水泥是由α-TCP、β-磷酸三鈣(β-tricalcium phosphate,β-TCP)、磷酸氫鈣(dicalcium phosphatedehydrate,DCPD)、無水磷酸氫鈣(dicalcium phosphate anhydrate,DCPA)、磷酸四鈣(tetricalcium phosphate,TTCP)等兩種及兩種以上磷酸鈣鹽,由檸檬酸、生理鹽水、磷酸二氫鈉等固化液混合后形成的骨黏合劑[13]。其中磷酸三鈣(TCP)是一種重要的可吸收磷酸鈣生物材料,是磷酸鈣的中間相。TCP 由于其優異的骨傳導性和生物降解性,已被用作骨替代物的理想候選物、生物可降解復合材料的無機填充物、評價細胞接種有效性、增殖、成骨分化的基質、刺激骨愈合和骨生成的骨生長因子的載體、藥物載體、發光材料和催化劑[14]。
α-TCP是目前臨床上理想的骨修復材料之一[15],鈣磷比接近1.5,在與水混合后可以進行鈣磷原子重排獲得鈣磷比為1.67的羥基磷灰石,但其降解速度慢于新骨形成的速度[16],如果應用于臨床,可能會影響骨缺損的愈合。
為加快α-TCP的降解速度,本文將其與具有一定生物相容性和生物降解性,且降解速度將快的α-半水硫酸鈣(α-calcium sulfate hemihydrate, α-CSH)復合,并模擬人骨受力狀態,對其凝固時間、靜態力學性能、動態力學性能、降解性能以及生物相容性進行了研究。
1 材料和方法
1.1 材料
1.1.1 α-TCP的制備
α-TCP以碳酸鈣(CaCO3),磷酸(H3PO4),氫氧化鈣(Ca(OH)2)為原料,按式(1)~(3)制備得到磷酸三鈣(Ca3(PO4)2)后,經程序控溫高溫煅燒至1400℃后獲得,程序控溫升溫步驟如圖1所示。

圖1 程序控溫升溫步驟Fig 1 Programmed temperature control step
CaCO3+2H3PO4→Ca(H2PO4)2+H2O+CO2↑
(1)
Ca(H2PO4)2+Ca(OH)2→2CaHPO4+2H2O
(2)
2CaHPO4+CaCO3→Ca3(PO4)2+H2O+CO2↑
(3)
1.1.2 α-CSH的制備
α-CSH以二水硫酸鈣(calciumsulphate dehydrate, CSD)為原料,經水熱合成法獲得,將CSD置于立式壓力蒸汽滅菌器中(LDZF-30KB-Ⅱ,上海申安醫療器械廠),溫度設為127 ℃,滅菌9 h,后置于烘箱中2 h即可獲得α-CSH。
1.1.3 固化液的制備
固化液為2.5%(質量分數)的磷酸氫二鈉(sodium hydrogen phosphate, Na2HPO4)溶液,有研究表明,將Na2HPO4作為固化液,在降解過程中可致孔[17]。
1.2 α-TCP/α-CSH的制備
復合材料以α-TCP為主要占質量比材料(占比分別為100%,95%,90%,85%,80%,75%)與α-CSH在攪拌器皿中混合后,按液固比(L/S)0.4 mL/g加入固化液,攪拌均勻,倒入模具,待其凝固后脫模,分別制備骨水泥柱與骨水泥粒用于力學性能與降解性能的研究,樣品尺寸如圖2。

圖2 樣品尺寸Fig 2 Size of samples
1.3 凝固時間的測定
凝固時間的測定選擇φ10 mm×15 mm的圓柱形模具,混合材料總質量為3 g,加入固化液攪拌均勻后倒入模具,用攪拌勺加壓去除內部氣泡并保證材料兩端平整,置于空氣中,利用維卡儀測定其凝固時間,α-TCP占比不同的材料每組設有5個平行試樣。
1.4 靜態力學性能的測定
將制備的φ10 mm×15 mm的骨水泥柱置于空氣中一周后,用砂紙將柱狀材料兩底面打磨光滑平整,利用萬能材料試驗機(INSTRON5544,英斯特朗公司)對其加載,采用位移控制的方式,設定其加載速度為1 mm/min,記錄其最大抗壓力,α-TCP占比不同的材料每組設有4個平行試樣。
1.5 動態力學性能的測定
將制備的φ10 mm×15 mm的骨水泥柱,置于空氣中一周后,用砂紙將材料打磨光滑平整,利用萬能材料試驗機對其進行動態循環加載,加載方式模擬人行走時膝蓋受力的波形圖,加載方式通過軟件Bluehill Universal設定,由于α-TCP占比不同會影響其抗壓強度,所以設置動態循環加載峰值時需參考靜態力學性能測試中的結果,α-TCP占比不同的材料每組設有五個平行試樣。
1.6 掃描電子顯微鏡表征
掃描電子顯微鏡(SEM)(JSM-7100F,日本電子株式會社)表征測試選擇φ5 mm×3 mm的骨水泥粒,小粒在空氣中放置一周后進行SEM試驗。觀察其表面形貌。
1.7 降解試驗
降解實驗同樣采用φ5 mm×3 mm的骨水泥粒,α-TCP占比不同的材料每組設有八個平行試樣,以PBS緩沖液為降解液,利用集熱式恒溫加熱磁力攪拌器(DF-101SZ,鞏義市科瑞儀器有限公司)對其進行恒溫振蕩(90 r/min),測試時間為12周,分別對2、4、6、8、10、12周的結果進行分析,以材料失重率的形式顯示,計算失重率后對材料進行SEM觀察。
動態加載實驗中的材料亦做降解實驗,實驗方式同上。
1.8 X射線衍射分析
將降解2周的復合材料靜置,待干燥后通過X射線衍射儀(DX-2700BH,丹東浩元儀器有限公司),設置步寬角度為0.05°對材料成分進行分析。
1.9 細胞增殖檢測
細胞實驗以CCK-8實驗為主。α-TCP占比不同的材料每組設有4個平行試樣,一共3組,置于3個96孔板中。首先將培養好的細胞稀釋至2.5×105個/mL,制成細胞懸液,每個材料上加200 μL細胞懸液,分別培養2、4、6天,則細胞可接種于96孔板的材料上,之后將培養2、4、6天的96孔板分別取出,在每個比例材料中加入10 μL的CCK-8,繼續培養4 h,最后將150 μL的上清液移入新的96孔板,將上清液振蕩后放入酶標儀,在450 nm處測試其吸光度。最終結果通過觀察細胞培養上清液的吸光度顯示。
2 結果與討論
2.1 凝固時間
骨水泥的最佳凝固時間為5~30 min,若時間過短,在材料注射過程中材料就會凝固在注射管內;若時間過長,當材料到達骨缺損部位后短時間內難以塑形,可能會引起受損部位感染。由骨水泥的凝固時間結果柱狀圖(圖3)可得,當α-TCP占比為100%時,平均凝固時間為36 min左右,相比骨水泥最佳凝固時間過長;α-TCP占比為95%時,平均凝固時間為7min左右;α-TCP占比為90%、85%時,其平均凝固時間在10min左右,較為適中;α-TCP占比為80%,75%時,凝固時間﹤5min,相比骨水泥最佳凝固時間過短。

圖3 不同比例的復合骨水泥的平均凝固時間Fig 3 Average setting time of composite bone cement with different proportion
2.2 靜態力學測試
對材料進行靜態力學測試旨在檢測材料在注射入人體后所能承受的最大壓強,由結果柱狀圖4(a)可得,當α-TCP占比為95%時,其可承受最大的壓強為2.7MPa,其次為α-TCP占比為85%的復合材料。因此,材料的力學性能適用于非負重區的骨修復。
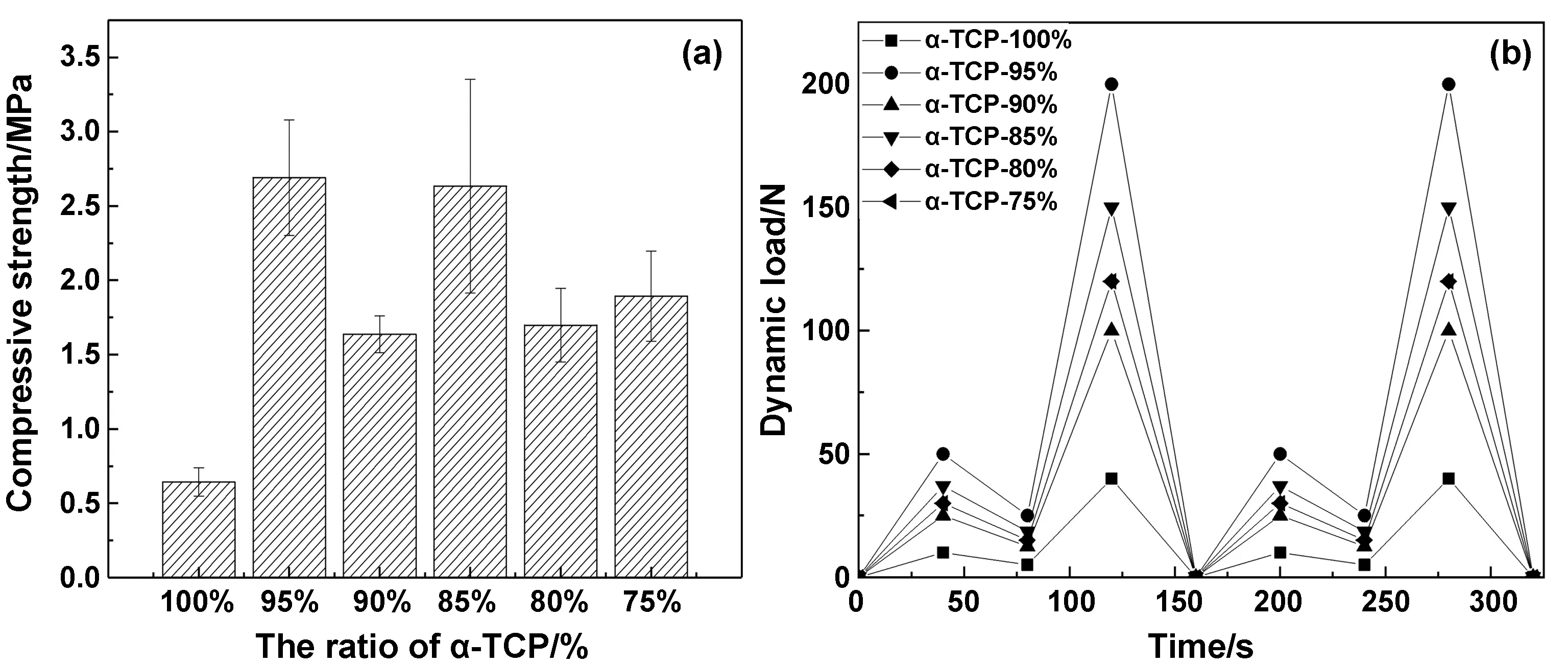
圖4 靜態力學測試與動態力學測試Fig 4 Static mechanics test and dynamic mechanics test: (a) compressive strength of composite bone cement with different proportions under static loading; (b) dynamic loading waveform of different proportion composite bone cement
2.3 動態力學測試
對α-TCP占比不同的復合材料進行循環加載,加載波形及大小如圖4(b)所示,此波形可近似模擬人站立行走時脛骨關節所受的力[18]。由于α-TCP占比不同,其在靜態載荷下可承受的最大壓力不同,在動態載荷下可承受的壓力也不同,所以對不同的材料設計的波形壓力最大值也不同。其中α-TCP占比為95%的復合材料可承受壓力的峰值最大,可達200N,α-TCP占比為100%的復合材料可承受壓力的峰值最小。
2.4 降解實驗
圖5(a)為不同比例未加載復合材料降解失重率對比圖,降解時間為12周。對于未加載的復合材料,其在降解實驗中,當α-TCP占比為75%時,材料發生質量損失,當α-TCP占比為80%、85%、90%、95%、100%時,材料幾乎沒有失重。但相比而言,失重率在上下波動,說明復合材料一方面進行降解,一方面發生水化,其水化過程主要是α-CSH作為非均勻形核的基底引起的磷酸三鈣晶體形成。在PBS緩沖液的作用下復合材料吸收其鈣磷原子發生原子重排,使HA晶體得以生長,降解過程與水化過程發生動態協調。但當α-CSH含量過多時,在液體環境中易發生潰散,導致復合材料發生質量損失。
圖5(b)為不同比例復合材料在未加載及加載動態載荷情況下降解兩周的失重率對比。當材料經過動態加載以后,復合材料的失重率相比未加載增大,說明動態載荷會影響材料的降解,使降解速度加快。

圖5 降解失重率對比Fig 5 Comparison of degradation weight loss rate: (a) comparison of degradation weight loss rate of unloaded composites with different proportion; (b) comparison of weight loss rate of different proportion composites under unloaded and dynamic loading after 2 weeks
2.5 掃描電鏡表征
圖6為未加載荷的復合材料電鏡形貌圖。圖6(a)~(f)分別為α-TCP占比為100%、95%、90%、85%、80%、75%的復合骨水泥材料降解0、6、12周的形貌圖。在降解0周時,復合材料均為無規則狀,在發生降解后,復合材料SEM表征為板片狀結構,說明復合材料在降解過程中,晶體沿六方晶系中c軸進行生長[9-11],逐漸形成人體內HA晶體結構,與降解實驗中材料的失重率結果形成呼應,表明材料在降解過程中以α-CSH為基,發生了水化。

圖6 未加載荷復合材料降解0、6、12周形貌圖Fig 6 Characterization of 0, 6, 12 weeks degradation of unloaded composites
2.6 X射線衍射結果
圖7為復合材料在降解兩周后的XRD譜圖。由標準卡可知,HA的特征衍射峰主要出現在2θ=25.86°,28.93°,31.75°,32.17°,34.05°,46.68°,50.49°,53.17°,α-TCP的特征衍射峰主要出現在2θ=27.76°,31.02°,34.37°,46.98°,52.94°。由圖可知復合材料在降解過程中,始終有α-TCP的衍射峰,說明α-TCP可部分水化形成HA。當α-TCP占比為100%、90%時,復合材料的XRD譜圖中HA的最高衍射峰較弱,說明材料呈弱結晶狀態,當α-TCP占比為85%時,HA的衍射峰出現頻率最高,隨著α-CSH含量增加,復合材料的衍射峰數量減少,峰值也有所減弱,說明α-CSH的加入增大了鈣磷比例,使得材料更易向HA轉化。

圖7 復合材料的XRD譜圖Fig 7 XRD patterns of composite materials
2.7 CCK-8實驗結果
實驗結果以材料吸光度(圖7)顯示,培養液吸光度增加,則細胞增殖。如圖7所示,材料在接種細胞培養2、4、6天后,培養液的吸光度逐漸增加,說明細胞處于增殖的狀態,證明復合材料生物相容性良好,但α-TCP占不同比例的復合骨水泥材料其吸光度并無顯著性差異。

圖8 不同比例復合骨水泥細胞吸光度對比Fig 8 Comparison of cell absorbance of different proportion of composite bone cement
3 結論
由凝固時間實驗可知,α-TCP占比為95%、90%、85%的復合材料降解時間在5~30 min,滿足骨水泥最佳凝固時間的要求。在靜態加載與動態循環加載實驗中,可承受壓力最大的材料α-TCP占比為95%,其可承受最大靜態壓強為2.7 MPa。在降解實驗中,本實驗認為材料的增重是磷酸鈣的水化過程與硫酸鈣降解過程的不斷協調平衡導致的,α-TCP以α-CSH為基從外到內進行層層降解并水化,內部的水化對于Ca、P原子的攝取來自于上一層復合材料以及PBS緩沖液中的Ca、P原子,導致了材料表面的晶體不斷生長,形態不斷改變,最終出現板狀纏結晶體結構。在XRD衍射分析中可知,α-TCP在降解水化的過程中會部分轉化為HA,當α-TCP占比為85%時,HA的衍射峰出現頻率最高。在細胞吸光度的檢測中可以看出,復合材料都是生物相容性良好的材料。

