單胃動物腸道氣體的代謝、生理功能及營養調控
王 丹 陳代文 羅玉衡
(四川農業大學動物營養研究所,農業部動物抗病營養與飼料重點實驗室,動物抗病營養教育部、四川省重點實驗室,動物營養與飼料工程四川省高校重點實驗室,雅安 625014)
消化道不僅是動物養分攝入、轉運、消化和吸收的主要場所[1],也是微生物定植的主要場所[2]。動物消化道微生物對內環境穩態與腸道健康的維持有重要意義[3]。無法在單胃動物小腸(前腸)被消化吸收的膳食/飼糧成分,可在大腸(后腸)多種菌群的協同作用下被進一步發酵分解,這方面最為熟知的例子是復雜碳水化合物的后腸發酵。微生物分泌的胞內酶可將復雜碳水化合物降解為低聚體或單體,同時產生短鏈脂肪酸(short-chain fatty acids,SCFAs)、氣體、其他有機酸和小分子物質[4]。迄今為止,對SCFAs、有機酸等微生物代謝產物及其功能的研究較為豐富,但發酵氣體對單胃動物的具體生物學功能仍有待探索。
氫氣(H2)、甲烷(CH4)和二氧化碳(CO2)是單胃動物腸道內的主要氣體,而硫化氫(H2S)、一氧化氮(NO)和一些含硫化合物[5]的濃度較低,屬于微量氣體,它們中的大部分都來源于消化道微生物的代謝反應。這些氣體大部分屬于微生物發酵終產物,但是對其作用認識還不夠充分。隨著研究的深入,人們發現這些氣體對腸道健康有直接或間接的影響[6],例如,與腸道氣體相關的疾病包括小腸細菌過度生長、碳水化合物消化不良如腸易激綜合征(irritable bowel syndrome,IBS)、乳糖不耐癥和肝脂肪變性[7]等。因此,腸道氣體亦可作為某些胃腸道疾病診斷的生物標記[8]。
碳水化合物、蛋白質、脂肪等多種營養物質,均已被證實可通過多種機制改變腸道的運動、分泌、免疫,且這些變化均與腸道微生物區系密切相關。鑒于氣體是菌群代謝的重要產物之一,腸道內氣體的組成和分布也會受到膳食/飼糧營養成分的影響[9]。因此,腸道氣體不僅是微生物發酵產物,還可能是動物生理活動的重要介導分子。本文將從代謝過程、生物學活性、測量方法、營養調控等方面,系統綜述單胃動物腸道氣體對機體健康的影響,同時也討論腸道氣體在畜牧生產中作為生物標記物判斷微生物功能和活性的可行性,為降低規模化養殖過程的廢棄物排放、促進精準營養手段的研發提供新思路。
1 腸道氣體代謝過程及氣體的生物學特性
腸道氣體代謝是腸道生理學的一個復雜而有趣的分支。目前,對腸道內各種氣體的代謝途徑有大概了解,但對其具體的作用機制還缺乏系統認知[10]。總體而言,腸道氣體有3種來源——吞咽的空氣、腸道內生成(主要包括化學反應和微生物代謝,后者的特點是同時產生和消耗氣體)、血液擴散(氣體從血液擴散到管腔內)。其中,大部分氣體在腸道內產生,少量可能通過吞咽進入腸道,例如腸道內所有的氧氣(O2)和大部分氮氣(N2)(少量N2由結腸微生物脫氮作用產生)都是通過吞咽進入腸道[11]。腸道內氣體的排出是通過打嗝、腸壁吸收、菌群代謝和肛門排空來實現的。如圖1所示,呼吸作用以及胃內化學反應生成的CO2,以及吞咽的O2和N2,部分被小腸上皮吸收進入血液循環系統,剩余部分進入后腸。后腸(尤其是近端結腸)細菌發酵產生大量H2和CO2,并進一步被其他微生物利用生成CH4(產甲烷菌)和H2S(硫酸鹽還原菌)。小部分的氣體經大腸上皮細胞進入毛細血管,大部分氣體隨未消化的營養物質經過肛門排出體外。毛細血管內的氣體也可分泌到腸腔中。吞咽進入胃內的空氣大部分通過打嗝排出體外,少部分空氣在仰臥時被胃推送進入小腸。

CO2:二氧化碳 carbon dioxide;O2:氧氣 oxygen;N2:氮氣 nitrogen;H2:氫氣 hydrogen;NO:一氧化氮 nitric oxide;CO:一氧化碳 carbon monoxide;CH4:甲烷 methane;H2S:硫化氫 hydrogen sulfide。下圖同 The same as below。
1.1 CO2
1.2 H2
與CO2生成方式不同,腸道中所有H2和CH4都來自微生物代謝。研究發現,在新生嬰兒和無菌仔鼠出生后的12 h內,腸道內都沒有H2和CH4產生[16-17]。對人類結腸中編碼氫化酶的基因組和宏基因組的分析發現,約70%的人類結腸微生物具有生成H2的能力[18]。
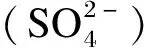

NAD+:二磷酸吡啶核苷酸 pyridine diphosphate nucleotide;NADH+:三磷酸吡啶核苷酸 pyridine triphosphate nucleotide;Fdox:氧化鐵氧還蛋白 oxidized ferredoxin;Fdred:還原鐵氧還蛋白 reduced ferredoxin。①:通路① pathway ①;②:通路② pathway ②;③:通路③ pathway ③。

CHO-MFR:N-甲酰甲烷呋喃 N-formylmethane furan;CH3-H4MPT:甲基-四氫甲烷蝶呤 methyl tetrahydro methotrexate;CH3-S-CoM:甲硫基輔酶M methylthiol coenzyme M;CHO-H4F+:甲酰-四氫葉酸 formyl tetrahydrofolate;CH3-H4F:甲基-四氫葉酸 methyl tetrahydrofolate。:硫酸根離子 sulfate ion;:亞硫酸根離子 sulfite ion;:硫代硫酸根離子 thiosulfate ion;①:甲基輔酶M還原酶途徑 methyl coenzyme M reductase pathway;②:乙酸激酶途徑 acetic kinase pathway;③:亞硫酸還原酶途徑 sulfite reductase pathway。
1.3 CH4
單胃動物腸道內的CH4主要由產甲烷菌產生(圖2、圖3)。產甲烷菌是古細菌領域的厭氧原核生物,其與細菌、真菌是單胃動物腸道內的3類主要微生物(三域系統)[25]。反芻動物瘤胃中存在大量產甲烷菌,但在單胃動物腸道中,產甲烷菌相比于細菌受到的關注要少得多,其功能研究極少。人和豬腸道中的產甲烷菌主要存在于結腸[26-27],由于其可利用細菌發酵的終產物(如H2、CO2、甲酸、乙醇等),對降低腸腔內氫分壓、維持微生物發酵效率和腸道正常生理功能有重要意義。
在很長一段時間內,CH4被認為僅僅是一種代謝廢氣,但有研究重新評估了產甲烷菌和CH4對人類的生物學意義,發現二者與胃腸道疾病(如IBS、結直腸癌等)和肥胖息息相關[28-30](表1)。有研究認為,產甲烷菌導致肥胖的機制可能是因為甲烷菌作為氫營養型微生物,可促進后腸細菌發酵產生更多的SCFAs參與宿主能量代謝,從而導致肥胖[31]。炎癥性腸病(inflammatory bowel disease,IBD)患者不僅腸道中定植的產甲烷菌數量相對較少,且其呼出氣體中CH4濃度也較低,推測其可能原因是腹瀉導致腸道微生物總量減少[32]。此外,產甲烷菌在便秘嚴重的神經性厭食癥患者腸道中的豐度極高[33],進一步分析表明,腸腔中高濃度的CH4可能會減緩腸道運動,延長食糜在腸道中的運輸時間,從而導致便秘的產生。

表1 可能與CH4/產甲烷菌相關的疾病(人和模式動物)
1.4 H2S
單胃動物腸道內H2S的生成也主要有3條途徑:其一,硫酸鹽還原菌利用硫酸鹽作為終端電子受體,H2作為終端電子供體,生成H2S[39];其二,依靠細菌發酵蛋白質或氨基酸(如含硫氨基酸)產生。研究表明,在糞便勻漿中添加半胱氨酸可促進H2S生成,添加低聚糖則會抑制H2S生成,猜想其原因可能是低聚糖可以作為半胱氨酸的競爭底物優先被細菌發酵[30];其三,某些細胞或組織(如血管組織)可以通過不同的酶生成H2S[40]。如大部分哺乳動物產生內源性H2S的主要途徑是通過2種依賴5-磷酸吡哆醛的酶(胱硫醚β-合酶和胱硫醚γ-裂合酶),并利用L-半胱氨酸為主要底物來完成的[41-43]。其中,細菌來源的H2S占主導,也與單胃動物腸道健康密切相關[44]。
H2S同時具有有益作用和毒性作用。當H2S濃度較高時,特別是與NO同時存在時,會損害β-氧化以及脂質和蛋白質的合成[45]。例如,在某些臨床研究中發現,腸道中H2S的存在與炎癥性腸病和結直腸癌密切相關[46-47]。并且體外研究發現,一定濃度的H2S會對中國倉鼠卵巢細胞和人類HT-29結腸上皮細胞基因組DNA造成損傷[48]。濃度為50 μmol/L的硫化物可使中國倉鼠卵巢細胞核完全降解[49]。反之,當H2S濃度較低時,則具有重要的細胞信號傳導特性[50]。例如,硫化物可通過抑制KATP通道的開放[51],阻斷L型鈣通道[52],抑制環磷酸腺苷/蛋白激酶A(cAMP/PKA)途徑[53],從而對心肌細胞產生負性肌力作用[54]。
2 腸道氣體的測量方法
腸道氣體的測量方法最早可以追溯到1781年[9]。目前在臨床應用中已開發的腸道氣體測量方法可分為直接法和間接法。直接法主要指采用集氣袋收集肛門排出氣體,或以專用軟管插入直腸收集氣體進行測量。間接法則主要指采用體熱測定、呼吸測定和成像技術等手段進行分析。其中,成像技術包括腹部平片、計算機斷層掃描(CT)和磁共振成像(MRI)[55-57]。腸道微生物產生的CH4和H2一旦進入循環系統,現已知唯一的代謝方式是通過肺呼出體外[13]。研究發現,腸道內H2和CH4總產量與呼出的H2、CH4含量成正比,并且其中14%的H2和20%的CH4經由肺呼出體外[58-59]。因此,通過檢測呼出氣體中H2和CH4的濃度和比例,可以間接評估腸道內微生物的發酵活性。需要注意的是,現有的腸道氣體測量方法都存在其弱點。例如,間接法雖然是無創的,但因為氣體的檢測過程通常暴露于干擾信號,故方法的嚴謹性和結果的準確性存在爭議;直接法雖然獲得的數據較為準確,但因測量方法有較大侵入性,機體不適感強烈,因此在臨床應用上也有一定困難。
在畜牧行業中,腸道氣體的測量方法更為落后。呼吸測熱室是用于動物代謝產熱試驗的較為經典的方法,但其測定的氣體僅為終端氣體,即動物通過呼吸和肛門排出的氣體,無法實時反映腸道內氣體的代謝情況。研究發現,隨機收集新鮮的糞便樣本在32 ℃發酵48 h后,收集氣體檢測其中的有害氣體濃度[60-61],可在一定程度上反映腸道內關鍵氣體的產生情況,但該方法與在體內情況相差甚遠,分析結果只能粗略反映有害氣體濃度,不能準確反映飼糧成分對腸道氣體代謝的影響,故不具有代表性。
近期研究表明,可攝入的氣體傳感膠囊可能是一種較為精確、安全的腸道氣體測量方法[62]。這種可攝入膠囊可以同時測量消化道中O2、CO2、H2和CH4的濃度,并將數據無線傳輸到外部接收器,從而評估氣體的分布[23,63],且可以通過氣體的實時濃度確定膠囊所在位置。經腹部超聲成像表明,O2濃度可準確反映膠囊離開胃部以及從回腸末端移動到盲腸的時間,這使研究者能夠推斷出其他氣體的生成部位。膠囊從體內排出后因溫度從體溫降到環境溫度,溫度傳感器檢測到溫差后即可知道膠囊排出的時間[62]。
因此,先進的腸道氣體測量方法可以準確反映腸道氣體的產生和代謝過程,不僅可以作為消化道疾病診斷、治療的輔助手段,還可以幫助判斷腸道微生物的功能和活性,為個體化和精準營養提供參考。
3 腸道氣體與營養調控
大量證據表明膳食結構與消化道微生物區系密切相關[64]。如前所述,腸道內大部分氣體為菌群的代謝產物,所以菌群結構的改變可能直接影響腸道氣體的分布和濃度,從而改變與氣體相關的腹部癥狀,如脹氣、腹痛、便秘、肛門排氣過多等[65]。基于此,通過定性和定量分析腸道氣體,可以為營養調控改善腸道健康提供思路。
IBS是一種常見的功能性腸病,以腹脹、腹痛為主要癥狀,且餐后癥狀明顯,嚴重影響患者生活質量[66]。西方國家患病率為5%~24%,我國人群患病率為5%~15%[67]。飲食管理是IBS治療中的重要一環[68],其中又以控制腸內微生物發酵氣體的濃度與生成速度為主。研究表明,IBS患者攝入易發酵短鏈碳水化合物之后,呼吸中的H2減少,CH4增加,胃腸道癥狀加重;攝入不可發酵碳水化合物則相反[66,69-70],說明腸道氣體不僅可以作為疾病診斷標記物,且在IBS的發病機制中也扮演重要角色。
雖然腸道氣體對豬等單胃動物的生物學功能仍不清楚,但綜上所述,腸道氣體可以作為養分利用率和動物機體健康的參考標準之一。由于發酵體系中的產氣量通常與微生物發酵底物的程度成正比,因此腸道氣體的產量、分布、移動速率很可能與飼料組分的利用程度相關(圖4)。

FODMAPs:易發酵的低聚糖、雙糖、單糖和多元醇 fermentable oligosaccharides, disaccharides, monosaccharides and polyols。
目前,關于膳食/飼糧營養成分與單胃動物腸道氣體關系的研究主要集中于碳水化合物和蛋白質,其他營養成分與腸道氣體之間的關系仍屬未知。
3.1 碳水化合物與腸道氣體
單胃動物腸道微生物對碳水化合物的利用途徑相對比較簡單。大多數腸道細菌對碳水化合物的發酵始于糖酵解途徑,生成的丙酮酸進而被下游細菌利用產生SCFAs和氣體等[10](圖5)。細菌對碳水化合物的分解取決于其胞內酶的種類,實質上是1種或多種酶促反應,因此可利用多種底物的細菌能迅速適應不斷變化的營養條件,具有較大的競爭優勢,而對底物專一的細菌競爭力相對較弱[76]。細菌的這種底物偏好性和競爭性造成腸道氣體組成和分布的差異,最后影響腸道健康和營養物質利用率。
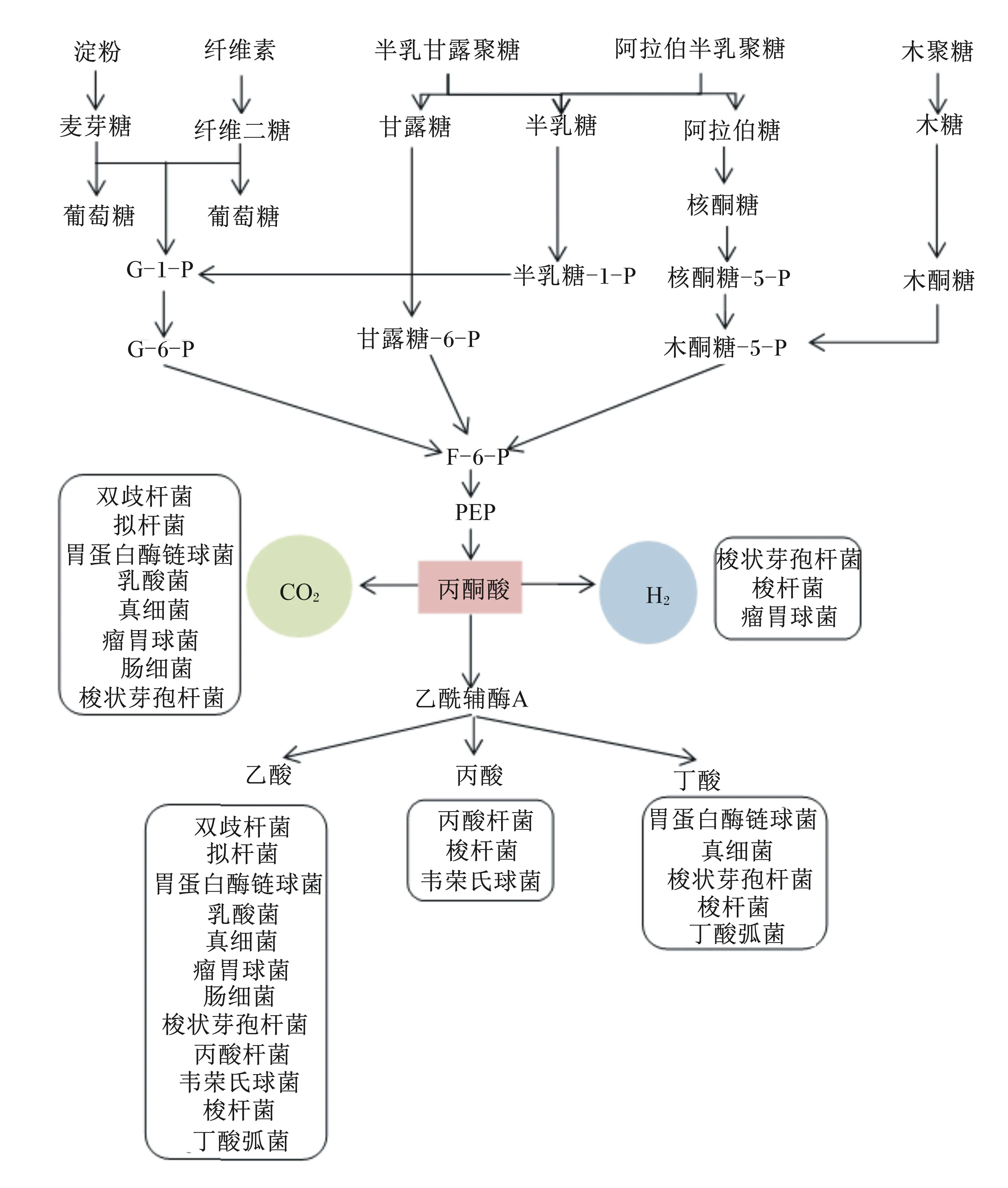
G-1-P:葡萄糖-1-磷酸 glucose-1-phosphate;G-6-P:葡萄糖-6-磷酸 glucose-6-phosphate;F-6-P:果糖-6-磷酸 fructose-6-phosphate;PEP:磷酸烯醇式丙酮酸 phosphoenolpyruvate。
根據鏈長的不同,碳水化合物可分為易發酵的低聚糖、雙糖、單糖和多元醇(fermentable oligosaccharides, disaccharides, monosaccharides and polyols,FODMAPs)和纖維。FODMAPs聚合度(degree of polymerization,DP)小于10,其特點為難吸收、發酵快并具有滲透活性,發酵部位通常為近端結腸[77]。體外研究發現,短鏈低聚糖(如低聚果糖和低聚半乳糖)的發酵速度最快,程度最深,而短鏈混合長鏈低聚糖發酵速度和程度明顯減弱,說明短鏈碳水化合物比長鏈碳水化合物(DP>10)發酵更快,在更短的時間內產生更多的氣體[71]。這在體內試驗中被進一步驗證。健康志愿者攝入高FODMAPs含量膳食后,呼氣中的H2濃度在短時間內顯著增長[78]。同時,因為FODMAPs具有滲透活性,可使腸道內水分含量升高,增加管腔內容物流動性[79],有助于緩解便秘。但IBS患者的內臟存在超敏反應,管腔的膨大和氣體量過多會導致患者腹脹和腹痛[72]。膳食/飼糧纖維的定義繁多,但通常為DP>2的不易消化碳水化合物,因此包含大部分FODMAPs,也具有持水性強的特點,但有些纖維(如纖維素含量較高或結晶程度較高)發酵速度緩慢甚至不發酵,且發酵的位置靠近橫結腸或降結腸,使氣體生成速度變緩,體積變少,對腸壁刺激較小。通常而言,溶解度高、鏈長較短的碳水化合物一般在升結腸或橫結腸被發酵;溶解度低、鏈長較長或有分支的碳水化合物一般難以被發酵[72-73]。因此,混合攝入不可發酵(如纖維素)或慢速發酵的碳水化合物與易于發酵(如菊粉)的碳水化合物,可使發酵位置往結腸或后腸遠端移動,同時改善大腸內氣體分布,緩解IBS等疾病癥狀。
綜上所述,膳食/飼糧中的碳水化合物來源、結構、組成等,都與單胃動物腸道微生物的發酵活性和氣體組成密切相關。針對不同動物、不同腸道健康狀況,構建適宜的碳水化合物“平衡模式”,是從源頭控制腸道氣體的生成、促進腸道健康的有效營養調控手段。
3.2 蛋白質與腸道氣體
前腸未被完全利用的蛋白質進入單胃動物后腸(主要是結腸)被細菌分解,并利用產生的氨基酸合成其結構蛋白或其他微生物蛋白[80]。蛋白質的微生物代謝產物比碳水化合物更加多樣化[81]。例如,梭菌屬和梭桿菌屬細菌均可在厭氧條件下發酵氨基酸,生成SCFAs、支鏈脂肪酸(如異丁酸、2-甲基丁酸和異戊酸)、H2、CO2和氨氣(NH3),以及少量的H2S、甲基硫醇、酚類、醇類和有機酸[82]。
在畜牧領域,大部分有關腸道氣體的研究集中在減少規模化養殖場有害氣體的排放。其中,糞便NH3濃度可以作為腸道內蛋白質發酵程度的生物標志物,因為有研究表明糞便中的NH3濃度會隨著蛋白質攝入量的增加而增多[83]。還有研究認為,H2S也可以替代NH3作為生物標志物來衡量蛋白質的發酵情況,因為長期攝入動物性蛋白質的健康人群腸道內H2S濃度較高[83]。
在調控腸道氣體生成方面,碳水化合物與蛋白質之間可能存在某種互作。在斷奶仔豬飼糧中添加低聚木糖或乳糖均可明顯降低斷奶仔豬糞便中的NH3濃度[61,82],但其具體機制尚屬未知。關于飼糧蛋白質與單胃動物腸道氣體生成、種類、比例和分布的關系,及其對腸道健康的影響仍有待探明。
4 小 結
綜上所述,膳食/飼糧結構可通過改變菌群組成來改變腸道內的氣體狀態。一方面,不同的營養素影響氣體生成的終體積和速度;另一方面,膳食/飼糧原料類型影響氣體轉運。針對動物營養領域,腸道氣體是了解腸道微生物代謝機制的一個重要窗口。探索不同飼糧組分與腸道氣體之間的聯系,尋找反映腸道健康的標志性氣體或氣體組成,或根據氣體組成情況形成個性化飼料配方,充分發揮腸道微生物對宿主不可消化的飼糧組分的利用潛力,是值得期待的發展方向。
對氣體組分的監測離不開先進的測量手段。然而目前人們對腸道氣體的分布及其隨時間和腸道長度變化情況的了解還很膚淺,這主要是因為對腸道氣體的測量手段大多是間接的或具有高度侵入性的。可攝入的氣體傳感膠囊雖然具有無創、靈敏、結果準確、成本較低等優點,但其檢測的氣體種類有限,無法根據結果推測或反映特定菌群活性,不能確定底物的發酵程度,且其操作和數據處理流程仍有待標準化。
最后,有關蛋白質、脂肪等重要營養物質與單胃動物腸道氣體之間的關系研究甚少,前者與動物生長、免疫和有害物排放密切相關,后者與能量代謝、肉品質、繁殖等生理機能的維持密不可分。腸道氣體能否作為三大營養素與腸道微生物互作情況的指示物,以反映動物的生長和健康程度仍有待探索。總之,關于單胃動物腸道氣體的產生和調控機制,及其對腸道疾病和健康的影響機理的相關研究仍處于起步階段。腸道氣體是微生物代謝的重要產物之一,其種類、組成、濃度和分布與腸道微生物區系和活性息息相關。因此,從營養學和微生態角度出發,開發更為先進的腸道氣體測量方法,探究能否通過營養手段調控腸道內氣體的組成和分布,以促進動物腸道健康,提高飼料利用率,同時減少有害物排放,將會是動物營養的一個全新研究領域。

