斑馬魚和鯉miR-1-2/133a-1基因間序列活性和調控研究
龔葭薇 何 梅 閆學春 孔德麟 梁 洋
(1. 東北林業大學, 哈爾濱 150040; 2. 中國水產科學研究院黑龍江水產研究所, 哈爾濱 150040)
魚類廣泛存在于自然界, 與人類生活息息相關。其中斑馬魚(Danio rerio)由于具有發育快、繁殖周期短、胚體透明、容易飼養及與人類基因組相似度高等特點已經作為模式生物被廣泛應用于發育生物學、環境毒理學、醫學和藥理學等領域[1,2]。而鯉(Cyprinus carpioL.)是目前世界上養殖量最大的淡水魚類之一, 其肉質具有高蛋白、低脂肪和人體必需氨基酸含量高等特點。既可以作為人類重要的食物來源, 也可以成為觀賞動物[3], 同時, 近年來鯉也逐漸成為免疫學、生態學、環境保護學、發育生物學和生物進化等模式動物[4]。隨著分子標記技術與遺傳圖譜繪制的發展, 鯉的一些特性, 包括耐寒、體重和血糖含量等性狀已經開始被廣泛研究[5], 但是迄今為止, 作為魚類重要經濟性狀的骨骼肌形成分子生物學機制尚未被完全揭示。
microRNA(miRNA)是近年發現的一種高度保守的非編碼小RNA(長度約22 nt), 在轉錄后水平調控基因表達。它們廣泛參與器官發育、腫瘤發生、細胞增殖分化及細胞凋亡等生理過程[6]。在模式動物小鼠和斑馬魚中發現了多種與肌肉發育相關的miRNAs, 這些富含在心肌和骨骼肌組織中的miRNAs被稱為myomiRs, 其通過對各自靶基因的作用而協同參與肌肉的發生、分化和再生等過程[7]。在對禾花鯉和建鯉肌間骨miRNAs的研究中也發現, miRNAs的表達水平控制成骨過程, 從而維持其肌間骨細小及柔軟的特性[8]。我們前期通過分析鯉肌肉特異性miRNAs也發現, miR-1、miR-133、miR-206、miR-221、miR-222、miR-181和miR-208等在鯉肌肉發育中存在差異性表達, 其中miR-1和miR-133在小鼠(Mus musculus)、雞(Gallus gallus)、爪蟾(Xenopus laevis)、斑馬魚和鯉等動物中高度保守[9]。在小鼠中, miR-1和miR-133以基因簇的形式存在, miR-1-1/133a-2位于2號染色體, 而miR-1-2/133a-1基因簇位于18號染色體[10,11]。Liu等[12]在小鼠中研究MEF2對miR-1-2和133a-1調控時發現, 在小鼠體內, 編碼miR-1-2和miR-133a-1的基因之間存在一個330 bp的增強子片段, 受肌肉發育重要調控轉錄因子MEF2直接調控。而該區域約330 bp增強子結合位點包含一段保守的E-box(CANNTG), 可能是MyoD家族的結合位點。同時, 通過比較人、大鼠、狗和雞等物種, 表明這一序列對于心臟和骨骼肌的表達是必要的, 且在脊椎動物中具有高度保守性。據此, 我們推測在斑馬魚和鯉中miR-1-2和133a-1基因間序列存在類似增強子的調控序列[12]。
綜上, 本研究擬在前期工作基礎上, 分析斑馬魚和鯉miR-1-2/133a-1的調控元件和轉錄因子, 克隆斑馬魚和鯉miR-1-2/133a-1的增強子序列, 探討在魚中miR-1-2/133a-1增強子序列調控機理; 并通過體外實驗進一步分析MyoD對miR-1-2/133a-1的調控作用, 為完善哺乳動物肌肉發育機制研究, 及為魚類分子育種奠定基礎。
1 材料與方法
1.1 實驗用載體
Hsp68-lacZ載體系國外友人Dr. Alan Peterson惠贈, 熒光素酶報告載體pGL3-Basic(Promega)、真核表達載體pcDNA3.1(+)(Invitrogen)和克隆載體pGEM-T Easy (Promega) 從公司購買。
1.2 實驗動物與細胞
研究所用鯉魚卵及成體組織均來自中國水產科學院黑龍江水產研究所呼蘭實驗站。實驗用斑馬魚魚卵及成體組織系黑龍江水產研究所自繁, 實驗用細胞實驗室自存。
1.3 實驗方法
總RNA提取 取適量斑馬魚或鯉肌肉組織,液氮研磨, 加入Trizol裂解, 10000 r/min離心5min,取上清, 氯仿和異丙醇抽提, 然后以75%乙醇充分洗滌沉淀。適量無RNA酶的去離子水溶解沉淀, 檢測總RNA濃度和純度, 再利用PolyA聚合酶加尾, 利用接頭引物(Ambion)反轉錄成cDNA, ?20℃保存備用。
載體構建與鑒定(1)Hsp68-GFP報告載體的構建: 利用限制性內切酶NcoⅠ和HpaⅠ從pEGFP-N3質粒上切下GFP片段, 與同樣雙酶切的Hsp68-LacZ載體進行連接, 提取質粒, 酶切并測序鑒定正確后–20℃保存備用。(2)pGL3-Hsp68報告載體的構建: 利用KpnⅠ和NcoⅠ從上述Hsp68-GFP質粒上切下Hsp68片段, 定向插入同樣雙酶切的pGL3-Basic載體構建pGL3-Hsp68報告載體, 提取質粒, 酶切并測序鑒定正確后–20℃保存備用。(3)斑馬魚Hsp68-GFP和pGL3-Hsp68報告載體的構建: 通過NCBI查找斑馬魚miR-1-2/133a-1基因間序列(本文中縮寫為dmi), 設計引物(表 1), 通過PCR以斑馬魚基因組DNA為模板克隆該片段, 測序正確后通過XhoⅠ和SmaⅠ雙酶切分別將其定向插入Hsp68-GFP和pGL3-Hsp68報告載體, 提取質粒, 酶切并測序鑒定正確后?20℃保存備用。(4)鯉Hsp68-GFP和pGL3-Hsp68報告載體的構建: 通過NCBI查找鯉miR-1-2/133a-1基因間序列(本文中縮寫為cmi), 設計引物(表 1)通過PCR以鯉基因組DNA為模板克隆該片段, 測序正確后通過ApaⅠ和SmaⅠ雙酶切分別將其定向插入Hsp68-GFP和pGL3-Hsp68報告載體, 提取質粒, 酶切并測序鑒定后–20℃保存備用。(5)斑馬魚和鯉系列突變載體的構建: 通過限制性酶切(酶切位點見圖 1A)及PCR(引物序列見表 1)構建不同長度的dmi缺失突變(示意圖見圖 1B), 并分別定向克隆入兩種報告載體。(6)鯉MyoD基因克隆和真核表達質粒構建: 設計鯉MyoD全長基因引物(表 1), 以肌肉cDNA為模板進行擴增, 將產物與pGEM-T Easy載體連接和轉化, 提取質粒, 經測序比對正確后將MyoD序列通過BamHⅠ和XhoⅠ雙酶切轉連至pcDNA3.1(+)載體,提取質粒, 酶切并測序鑒定正確后?20℃保存備用。

表 1 引物序列Tab. 1 Primer sequence

圖 1 斑馬魚miR-1-2/133a-1基因間序列酶切位點(A)和系列缺失突變體(B)示意圖Fig. 1 The schematic diagram of Danio rerio mir-1-2/133a-1 intergene sequence restriction site (A) and serial deletion mutant (B)
細胞復蘇與傳代培養NIH 3T3與C2C12細胞從液氮中取出后置于37℃水浴中快速融化, 轉移細胞懸液至15 mL離心管, 加入5倍體積預熱到37℃的合成培養基, 1000 r/min離心5min, 棄上清, 加入3 mL合成培養基, 溫和吹打使其混勻, 轉移到60 mm培養皿中, 置于CO2培養箱中進行培養, 每天觀察細胞狀態。培養條件: 37℃、5%CO2和95%空氣。培養基配方: DMEM高糖培養基, 添加10%胎牛血清(ES-FBS, BI公司), 添加1%雙抗和1% GlutaMAX(100×)。當復蘇培養細胞匯合度達到80%左右時,按照常規方法, 將細胞進行1∶3傳代培養。C2C12細胞的分化以2%馬血清誘導。
細胞轉染轉染前一天將細胞接種于不含抗生素的培養基中, 細胞轉染密度60%—70%時匯合, 按照Lipofectamine 2000(Invitrogen)說明書程序轉染細胞。
雙熒光素酶檢測細胞轉染48h后棄去舊培養基, PBS輕輕洗滌細胞2—3次; 加入通用裂解液,水平搖床室溫搖15min使細胞充分裂解; 10000r/min離心3min, 取10 μL細胞裂解液于1.5 mL EP管,加50 μL螢火蟲熒光素酶底物, 熒光光度儀測定螢火蟲熒光素酶的活性值F, 再加50 μL海腎熒光素酶底物, 檢海腎熒光素酶發光值R, 記錄F值、R值和比值。
魚卵顯微操作顯微操作采用日產IM-4A/B顯微注射器, 玻璃針用日產自由落體式拉針器(PP-83)拉成孔徑為6—8 μm的細尖。在?90 mm×18 mm平皿上, 鋪一層厚2—3 mm的瓊脂, 在其上挖一些與魚受精卵大小相似的圓孔, 選取質量好的魚受精卵固定在孔中, 平皿置在解剖鏡下, 注射針以75度角進入受精卵。每個受精卵注射質粒體積為1 nL, 注射劑量為50—100 pg, 對照組注射生理鹽水。注射后的魚受精卵于28℃孵化。
2 結果
2.1 斑馬魚和鯉miR-1-2/133a-1基因間序列分析
通過NCBI分別獲取dmi和cmi序列信息后, 根據設計的特異性引物(表 1), 以各自的基因組DNA為模板分別克隆獲得2084和2242 bp目的片段,并進行序列比對。同時人、小鼠、斑馬魚和鯉保守區域的序列比對結果顯示, 潛在的E-box元件(MyoD調控位點)在物種間高度保守。
2.2 斑馬魚和鯉基因間序列報告載體的構建
為了探究斑馬魚和鯉miR-1-2/133a-1基因間序列增強子的調控作用, 首先通過酶切和連接等方法分別獲得Hsp68-GFP和pGL3-Hsp68基礎報告載體,并將dmi(2084 bp)和cmi(2242 bp)全長序列分別定向克隆入上述兩種報告載體。
隨后, 按照圖 1所示利用酶切及PCR獲得不同長度的dmi系列缺失突變序列, 并定向克隆入上述兩種報告載體中, 鑒定正確后進行斑馬魚增強子活性分析。
2.3 斑馬魚miR-1-2/133a-1基因間序列增強子活性分析
活體實驗分析檢測增強子活性將上述構建的dmi-Hsp68-GFP質粒注射斑馬魚胚胎, 72h后觀察熒光, GFP呈現肌肉特異性表達(圖 2A)。進一步將上述構建的dmi-Hsp68-GFP系列缺失質粒注射斑馬魚胚胎(按照從a到i的順序注入胚胎, a為對照),72h后觀察熒光, 缺失片段不同(圖 2B), GFP表達量也不同, 保留有保守區域(1116—1432間序列, 縮寫為cr)的載體(圖 2C中b、f和g), 胚胎GFP表達量明顯高于其他突變體(圖 2C中c、d、e、h和i)。
離體實驗分析增強子活性通過脂質體法將上述pGL3-dmi-Hsp68系列質粒轉染小鼠C2C12細胞中, 并在分化前和分化后分別檢測相對熒光素酶活性(圖 3), 分化后的表達量均明顯高于分化前,由于其缺失片段不同而導致熒光素酶活性明顯不同, 保留有cr序列的b、f和g組, 在分化后熒光素酶活性顯著高于分化前。
2.4 鯉miR-1-2/133a-1基因間序列增強子活性分析
活體實驗分析基因間序列增強子活性無論活體實驗還是離體實驗, 上述結果都證明在斑馬魚中cr序列具有增強子活性, 因此推測在鯉中該區域有相似作用。將上述構建的全長cmi-Hsp68-GFP載體質粒注射鯉胚胎, 72h后觀察熒光, GFP同樣呈現肌肉特異性表達(圖 4)。
離體實驗分析基因間序列增強子活性通過脂質體法將pGL3-cmi-Hsp68質粒轉染小鼠C2C12細胞中, 并在分化前和分化后分別檢測相對熒光素酶活性(圖 5), 分化后的表達量明顯高于分化前, 且cmi的表達變化大于dmi。
2.5 MyoD調控miR-1-2/133a-1基因間序列分析
以在NIH-3T3細胞中轉染pGL3-dmi-Hsp68(斑馬魚)、pGL3-cmi-Hsp68(鯉)和保守序列pGL3-cr-Hsp68質粒作為對照, 以分別將上述3種質粒與pcDNA-MyoD質粒共轉染作為實驗組, 結果顯示,無論是斑馬魚還是鯉, 共轉染pcDNA-MyoD組熒光素酶活性明顯上調, 說明無論在斑馬魚還是鯉中,miR-1-2/133a-1基因間及保守區(cr)序列活性均受MyoD調控(圖 6)。
3 討論
魚類肌肉發育與脊椎動物類似, 由多核肌纖維組成, 胚胎期經歷了復雜的肌肉發生過程, 才發育為不同類型的肌肉[13]。成體骨骼肌有再生潛力, 依靠位于肌肉肌纖維膜和基底膜之間的骨骼肌衛星細胞, 在正常條件下衛星細胞處于靜止狀態, 在生理刺激下, 靜止的衛星細胞才被激活, 然后增殖、遷移、分化, 融合形成新的多核肌纖維[14]。同時,激活的一部分衛星細胞返回靜止狀態, 通過自我更新補充干細胞庫。目前大量證據表明非編碼RNA,包括miRNA、長非編碼RNA(lncRNA)和圓形RNA(環RNA), 也廣泛參與衛星細胞激活、增殖、自我更新等重要的肌發生過程[15]。

圖 2 dmi-Hsp68-GFP及突變質粒注射斑馬魚胚胎Fig. 2 Danio rerio embryo injected with dmi-Hsp68-GFP and mutated plasmid
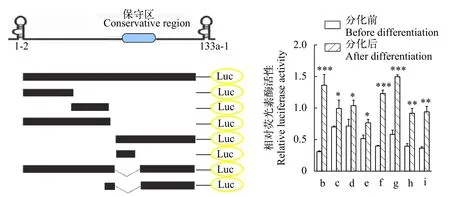
圖 3 pGL3-dmi-Hsp68系列質粒轉染C2C12熒光素酶活性分析Fig. 3 Luciferase activity analysis of pGL3-dmi-Hsp68 series plasmids transfected with C2C12
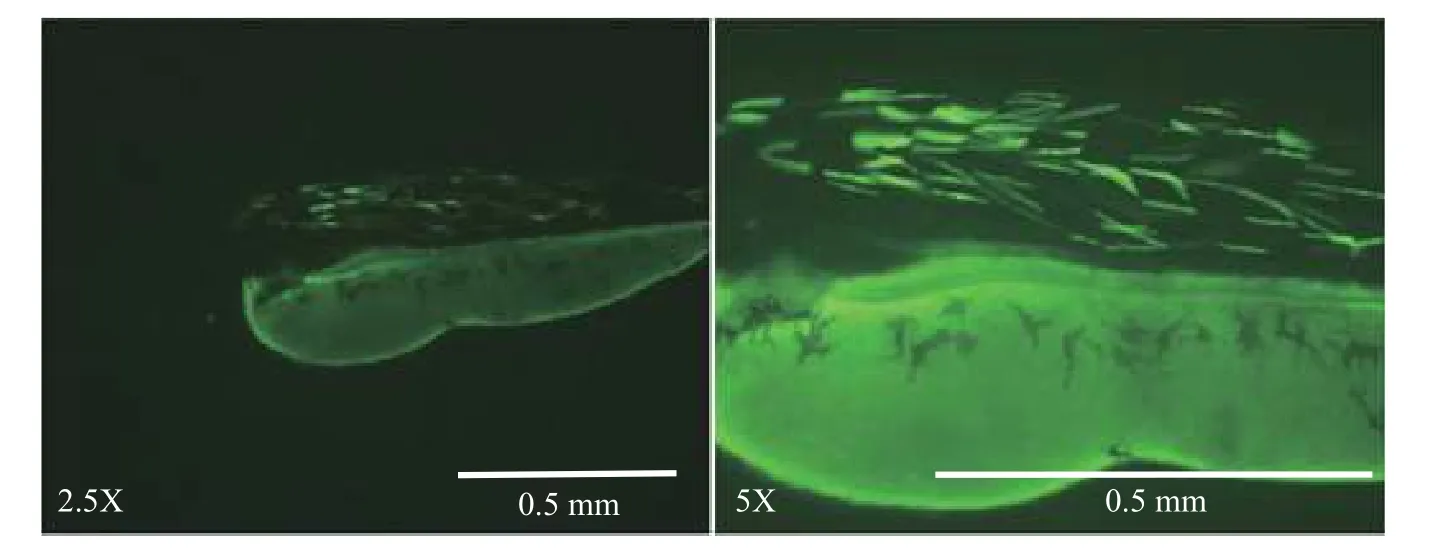
圖 4 cmi-Hsp68-GFP質粒注射鯉胚胎后熒光分析Fig. 4 Fluorescence analysis of cmi-Hsp68-GFP after injection into carp embryos

圖 5 pGL3-cmi-Hsp68質粒轉染C2C12熒光素酶活性分析Fig. 5 Luciferase activity analysis by transfection of C2C12 with pGL3-cmi-Hsp68 plasmid

圖 6 MyoD調控miR-1-2/133a-1基因間序列活性分析Fig. 6 Activity analysis of the intergene sequence of miR-1-2/133a-1 regulated by MyoD
3.1 斑馬魚和鯉中miR-1-2和miR-133a-1之間存在增強子序列
在模式動物小鼠和斑馬魚中, 與肌肉發育相關的miRNA被稱為myomiRs, 這些myomiRs通過對各自靶基因的作用而協同參與肌肉的發生、分化和再生等過程。我們前期通過分析鯉肌肉特異miRNAs發現, miR-1和miR-133在小鼠、雞、爪蟾、斑馬魚和鯉等動物中高度保守[9]。
已經有研究顯示, 在小鼠中編碼miR-1-2和miR-133a-1的基因之間存在一個330 bp的增強子片段, 受肌肉發育重要調控轉錄因子MEF2直接調控,該增強子具有肌肉特異性[12]。通過比較人、大鼠、狗和雞等物種, 表明這一序列對于心臟和骨骼肌的表達是必要的, 且在脊椎動物中具有高度保守性[12]。據此, 我們分析斑馬魚和鯉序列信息, 結果顯示, 在斑馬魚和鯉miR-1-2和miR-133a-1基因間也存在一段保守序列, 且包含E-box元件。進一步分析其是否具有肌肉特異性的增強子活性, 我們選擇了Hsp68為啟動子。熱休克蛋白Hsp68是一個基礎啟動子, 正常情況下的轉基因胚胎中檢測不到啟動子活性, 在受到熱激或者外源增強子誘導情況下被激活[16,17]。因此, 在本實驗中, Hsp68作為報告載體的啟動子, 正常情況下幾乎檢測不到啟動子后面GFP的表達, 而在Hsp68啟動子前加入dmi或cmi的miR-1-2和133a-1的基因間序列后, 則顯示GFP表達升高(圖 2和圖 4), 因此證明miR-1-2/133a-1基因間序列確實具有增強子活性。
無論在斑馬魚還是鯉中, miR-1-2/133a-1基因間序列的增強子活性, 以及MyoD對該序列的調控作用尚未見到相關報道。
3.2 增強子活性與保守序列相關且具有肌肉特異性
進一步分析顯示, 這種增強子活性強弱與保守區域cr有關, 在斑馬魚體內利用dmi-Hsp68-GFP系列質粒注射胚胎72h后, GFP呈現肌肉特異性表達。缺失片段不同, 表達量也不同, 保留有cr(含有E-box)序列的質粒注射胚胎后, GFP表達量明顯高于其他突變體(圖 2), 說明miR-1-2/133a-1基因內增強子中的E-box對于骨骼肌的表達是必要的。
另外, 體外細胞轉染試驗結果顯示, 在小鼠C2C12細胞中, 分化后的表達量均明顯高于分化前, 且其缺失片段不同其熒光素酶活性明顯不同,保留有cr的序列在分化后熒光素酶活性顯著高于分化前(圖 4和圖 5)。關于實驗中觀察到無論分化前后熒光素酶活性均有不同程度升高現象, 推測由于3′端的部分片段在肌肉分化前具有抑制子活性, 這種抑制作用在分化中解除, 因此表現為分化后所有熒光素酶活性升高。而具有保守cr序列的熒光素酶活性顯著高于其他實驗組, 進一步說明miR-1-2和133a-1基因間序列的增強子活性具有肌肉特異性。
3.3 斑馬魚和鯉中miR-1-2和133a-1增強子序列受到MyoD調控
根據已經有報道, 小鼠中miR-1-2和miR-133a-1基因之間330 bp增強子區域包含一段保守的E-box(CANNTG), 可能是MyoD家族的結合位點[12]。Rao等[18]發現, 在小鼠C2C12細胞和人類成肌細胞分化過程中, miR-1-2和miR-133a-1被明顯誘導表達, 通過ChIP實驗證明, MyoD能夠結合在miR-1-1/133a-2和miR-1-2/133a-1上游頸環區域, 提示在小鼠中該區域受到MyoD的調控。Liu等[12]在小鼠中也發現MEF2能調控miR-1-2/133a-1上游肌肉特異的增強子, 該區域約330 bp增強子區域包含一段保守的E-box (CANNTG), 正是MyoD家族的結合位點。據此, 分析斑馬魚和鯉序列信息, 也發現在miR-1-2和miR-133a-1基因間保守序列之間存在類似的E-box元件。
將cmi-Hsp68-GFP質粒注射鯉胚胎, 72h后觀察熒光, GFP呈現明顯肌肉特異性表達, 主要表現在生肌節部位, 與MyoD的表達相似(圖 4)。進一步通過熒光素酶實驗證明, 無論是斑馬魚還是鯉, miR-1-2/133a-1基因間及保守區(cr)序列活性均受MyoD調控(圖 6)。
綜上, 本研究發現無論在斑馬魚或者鯉中,miR-1-2/133a-1基因間序列確實存在可能與MyoD結合的E-box元件(CANNTG), 通過體內外實驗驗證了該區域的增強子活性, 并通過熒光素酶報告系統驗證了MyoD對該序列具有調控作用, 從而暗示在魚類中, miR-1-2和miR-133-a-1可能也是MyoD的下游基因。該研究為探明MyoD與2種重要的myomiRs(miR-1和miR-133)之間的表達調控關系, 完善脊椎動物肌肉發育調控機理, 及為鯉分子育種等打下基礎。

