數字PCR在食源性致病菌檢測中的應用進展
盧海強, 焦新雅,, 吳思源, 王婭麗, 劉璐, 程書梅, 張曉, 蘇曉峰*
1.河北農業大學食品科技學院,河北 保定 071001;2.中國農業科學院生物技術研究所,北京 100081;3.長春理工大學生命科學技術學院,長春 130022
隨著生活水平的逐步提高,食品安全問題受到了越來越多的重視,而食源性疾病是影響食品安全的主要因素之一。食源性疾病主要是由食源性致病菌所引起的,會危害人們的身體健康,給世界衛生組織帶來沉重負擔,嚴重影響社會經濟的發展。全世界每年約有1.5億的腹瀉病患者,其中由致病性微生物引起的占70%,而由食源性致病菌引起的腹瀉病總數已達到致病性微生物的46.4%,占據主導地位[1]。因此,為確保食品安全,開發更高效、更靈敏和更經濟的檢測方法尤為重要。目前,用于檢測致病菌的方法主要有分子生物學檢測技術[2]、高光譜成像技術[3]、激光散射技術[4]和酶聯免疫吸附檢測法(ELISA)[5]等。近年來,分子生物學檢測技術中的PCR技術受到了廣泛關注。
到目前為止,PCR技術已經發展到了第三代。第一代PCR是傳統PCR(endpoint PCR),即通過擴增獲得更多的目的片段;第二代PCR是實時熒光定量PCR(real-time PCR,qPCR),即在擴增過程中對熒光信號進行實時檢測;第三代PCR是數字PCR(digital PCR,dPCR),即針對單分子進行擴增的檢測技術。數字PCR具有精準度高、特異性強、靈敏性好和能進行絕對定量等優點,目前已得到了廣泛應用,尤其在病毒載量[6]、產前診斷[7]、癌癥診斷檢測[8]、轉基因成分檢測[9]和摻假成分檢測[10]等方面。本文就dPCR在食源性致病菌檢測中的研究進展進行了綜述,以期為食源性致病菌的檢測研究提供參考。
1 dPCR技術概述
dPCR是基于傳統PCR基礎上對核酸分子進行絕對定量的技術。早在1992年,Sykes等[11]第一次在傳統PCR基礎上提出三個重要原則:①對PCR反應物進行有限稀釋;②只需觀察有無熒光信號;③通過泊松分布進行統計處理,為今后dPCR的發展奠定了基礎。1997年,Olga等[12]利用玻璃毛細管作為載體進行PCR反應,實驗結果表明反應體系越小,擴增循環次數越多,TaqMan檢測的靈敏度就越高,為日后單分子目標DNA檢測應用提供了技術依據。1999年,Dressman[13]第一次正式提出數字PCR的概念,同時闡述其具有諸多優勢。2003年,Vogelstein等[14]用BEAMing技術以及流式技術結合dPCR,通過磁珠克隆DNA。BEAMing技術是基于小珠、乳濁液、擴增和磁性這四個主要組分來構建的,將單分子目標DNA連接到磁珠上,然后對小珠進行熒光標記,并使用流式細胞儀對其進行計數。這項技術不僅能提高實驗的靈敏度,可計算基因突變率,而且還降低了實驗誤差,為未來數字PCR的發展提供了技術依據。2006年,Fluidigm公司發明了第一臺基于芯片的dPCR儀。
dPCR基本原理如圖1所示,首先將參與擴增的組分分配成數百萬個PCR反應,使每個反應中盡可能含有一個模板分子,再對每個反應進行PCR擴增;然后,通過讀取熒光信號對反應結果的陰陽性進行判斷;最后將判斷結果根據泊松分布的原理估計靶分子的拷貝數和濃度[16]。在絕對定量時,dPCR不需要建立標準曲線,也不需要依賴標準品,因此實驗的工作量較qPCR更少,精準度更高,同時dPCR還具有不易受抑制劑影響、對樣品需求量很低、能很好地對稀有突變進行檢測等優點[17]。目前,dPCR可基于分液方式的不同,分為微流體數字PCR(microfluidic digital PCR,mdPCR)、微滴數字PCR(droplet digital PCR,ddPCR)和芯片數字PCR(chip digital PCR,cdPCR)[18]。
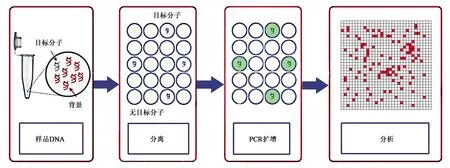
圖1 dPCR基本原理[15]
2 dPCR在食源性致病微生物檢測中的應用
引起食源性疾病的致病微生物種類有細菌、真菌和病毒,其中細菌是最主要的食源性致病微生物。這些食源性致病菌不僅污染食物,使食物腐敗變質,還會造成間接感染,如果食用的食物中含有過量的食源性致病菌,可能會引發腎臟疾病、腸道疾病或視力障礙,甚至致命。常見的食源性致病菌包括空腸彎曲菌、沙門氏菌、蠟狀芽孢桿菌、大腸桿菌、副溶血性弧菌和單核細胞增生李斯特氏菌等。此外,細菌和真菌產生的毒素是引起食源性疾病的主要原因,這些毒素在食品生產加工過程中也能保持活性,生的食物或即食的海鮮,都可能會被污染。
2.1 dPCR檢測食品中大腸桿菌
大腸埃希氏菌(E.coli)通常被稱為大腸桿菌,是一種兼性厭氧革蘭氏陰性菌。大多數大腸桿菌不具有致病性,具有致病性的大腸桿菌根據它們的毒力機制可分為:腸致病性大腸桿菌(enteropathogenicE.coli, EPEC)、產腸毒素性大腸桿菌(enterotoxigenicE.coli, ETEC)、腸侵襲性大腸桿菌(enteroinvasiveE.coli, EIEC)、腸聚集性大腸桿菌(enteroaggregativeE.coli, EAEC)、腸出血性大腸桿菌(enterohemorrhagicE.coli, EHEC)、產志賀毒素大腸桿菌(shiga-toxigenicE.coli, STEC)、腸粘附性大腸桿菌(enteroadhesiveE.coli, DAEC)和腸聚集性出血性大腸桿菌(enteroaggregative haemorrhagicE.coli,EAHEC)。致病性大腸桿菌會引起胃腸道疾病、泌尿系感染、腦膜炎、菌血癥、腹瀉和敗血癥等疾病,一般存在于未經巴氏滅菌的牛奶、牛肉、蔬菜和雞蛋等食品中。高達10%~15%的STEC感染患者會發展成溶血性尿毒癥綜合征(hemolytic uremic syndrome, HUS)[19],每年約有280萬例由STEC引起的感染病例[20]。EHEC中最常見的致病性菌株是O157∶H7和六大非O157血清型(O26∶H11,O45∶H2,O103∶H2,O111∶H8,O121∶H19和O145∶H28)。在美國,每年約有23萬人會感染EHEC,約有73 000人是由血清型O157∶H7引起的[21]。
2.1.1dPCR檢測食品中STEC利用大腸桿菌純培養物、添加培養物的牛糞、添加培養物的碎牛肉以及自然脫落的牛糞樣品,Liu等[22]對產志賀毒素的大腸桿菌血清組進行檢測。結果表明,與標準平板計數法相比,dPCR技術用時更少,通常一天內就可完成。同時證實了使用完整的細菌細胞作為dPCR模板和使用適當的樣品進行稀釋是dPCR檢測成功的關鍵所在。Capobianco等[23]研究表明,DD-check檢測方法不僅可以檢測志賀毒素(Shiga toxin,stx)和緊密黏附素基因(intimin gene,eae)的存在,還可以評估這些基因之間的連鎖性。
2.1.2dPCR檢測食品中EHECMcmahon等[24]使用MuSIC ddPCR的方法檢測EHEC,此方法利用ddPCR技術中微滴包裹完整單個細菌的特性以及分析stx和eae基因同時出現的連鎖性以達到檢測目的。該實驗從食品(碎牛肉、碎豬肉和綠葉蔬菜)中提取增菌液,并對增菌液中的EHEC進行檢測。在觀察正負液滴熒光振幅強度時,檢測stx的最佳溫度在54~57 ℃之間,檢測eae的最佳溫度在56~59 ℃之間。結果表明,MUSIC ddPCR適用于食品增菌液的篩選,不適合檢測stx2基因的stx2f亞型,大大降低了EHEC假陽性的檢出率。
2.1.3dPCR檢測食品中大腸桿菌O157∶H7 魏詠新等[25]對大腸桿菌O157∶H7純培養液和經大腸桿菌O157∶H7污染的三文魚樣品進行檢測,針對大腸桿菌O157∶H7的特異性單拷貝基因α-溶血素(hlyA)設計了引物探針,并比較了平板計數法、qPCR和ddPCR的定值效果。結果顯示該研究建立的ddPCR檢測方法對檢測食品安全、開展風險評估、應急檢測突發公共衛生事件、控制疫情擴散以及提高病原菌檢出效率等均有重要意義。為提高靈敏度,Jang等[26]應用熒光圖像對包裹不同數量的大腸桿菌O157∶H7和沙門氏菌的微滴進行研究。實驗證明,ddPCR檢測食源性致病菌具有從單細胞到多細胞水平的準確性和可行性。因此,已有的數據表明,dPCR在快速、靈敏和準確地量化樣品中攜帶的致病菌含量方面具有極大的潛在應用價值。
2.2 dPCR檢測食品中沙門氏菌
沙門氏菌(Salmonella)是一種革蘭氏陰性細菌,可引起人畜共患病。這種細菌可以污染多種食品,如雞蛋、水果、肉類、香辛料和蔬菜等,還能引起食物中毒、敗血癥、胃腸炎和菌血癥等癥狀。據報道全球約有13億例胃腸炎是由沙門氏菌引起的[27]。在中國,約有80%的食源性疾病是由沙門氏菌造成的[28]。在美國,每年近130萬人感染食源性沙門氏菌,有500多人因其致命[29]。鼠傷寒沙門氏菌(Salmonellatyphimurium)是一種能引起致死性敗血癥的革蘭氏陰性菌,在世界范圍內,大約三分之一的食源性疾病是由鼠傷寒沙門氏菌引起的[30]。
2.2.1dPCR檢測食品中的沙門氏菌趙新等[31]建立了沙門氏菌ddPCR的快速定量檢測方法,檢測靈敏度可達到102cfu·mL-1,結果證實了使用ddPCR方法檢驗食品中沙門氏菌具有檢測快速、檢出率高和操作方便等優點,且更適用于大批量應急預案樣品的檢測。Shaw等[32]開發了一種基于分子的方法,將基因工程標記到細菌染色體后,直接對微生物進行量化。在沙門氏菌野生型和突變菌株染色體上的無害位點上插入25個堿基對的DNA條形碼(DNA條形碼序列需要設計成便于使用的高質量探針序列),對每個菌株進行絕對定量,根據數值計算出每個菌株的競爭指數。這項技術提供了可觀的敏感性、特異性、準確性和精確度,可以輕松地量化不同細菌群體中的單個菌株,并且可大量適用于所有染色體修飾的有機體,以及降低實驗成本。dPCR具有很高的學術地位,但其致病菌檢測應用的潛力尚有待深入研究,無論是在優化成本還是檢測動態范圍方面,均是剛開始商業化開發。隨著技術的不斷發展,dPCR極有可能成為核酸定量的標準檢測方法。
2.2.2dPCR檢測食品中鼠傷寒沙門氏菌Wang等[33]為了評估qPCR和ddPCR在實際樣品中的應用效果和效率,制備了添加鼠傷寒沙門氏菌的牛奶,用qPCR和ddPCR進行檢測:qPCR的LOD為103cfu·mL-1,ddPCR的LOD為102cfu·mL-1,因此ddPCR的檢測限較低,具有更高的靈敏度,但動態范圍窄。同時,ddPCR預培養時間比qPCR節省2 h,不受PCR抑制劑影響。這些均是傳統qPCR無法達到的檢測水平。dPCR在未來具有很好的應用前景。
2.3 ddPCR檢測食品中金黃色葡萄球菌
金黃色葡萄球菌(Staphylococcusaureus)是一種典型的革蘭氏陽性菌,在自然界無處不在,主要存在于生肉(95.5%)、熟肉制品(93.5%)、豆制品(86.7%)和腌制蔬菜(78.1%)。金黃色葡萄球菌可產生多種毒力因子,從而引起膿毒癥、骨髓炎、菌血癥、心內膜炎和肺炎等疾病。在中國約25%的食源性疾病是由于感染了金黃色葡萄球菌[34]。2000年,日本有13 420人因食用金黃色葡萄球菌污染的乳制品被感染[35]。美國每年約有50萬人因金黃色葡萄球菌住院,其中有5萬人致命[36]。因此,檢測致病性金黃色葡萄球菌對食品安全非常重要。
趙麗青等[37]將疊氮溴化丙錠(propidium monoazide,PMA)與ddPCR技術相結合檢測金黃色葡萄球菌活菌。實驗結果表明,PMA-ddPCR方法能避免死菌DNA的干擾,并且有很高的靈敏度,因此在實際應用中具有極高的應用價值。周巍等[38]基于ddPCR技術,建立了發酵乳中金黃色葡萄球菌定量檢測方法,其檢測靈敏度為33 cfu·g-1。實驗證明在致病菌的檢測中ddPCR技術具有良好的應用前景。Pacocha等[39]用雙滴數字PCR(direct droplet digital PCR,dddPCR)檢測3種革蘭氏陽性細菌(金黃色葡萄球菌、頭葡萄球菌和表皮葡萄球菌),通過比較只含有目標菌的樣品和含有目標菌以及背景菌稀釋度的樣品來檢測dddPCR的實用性。實驗表明,dddPCR對非特異性微生物的抑制作用比qPCR低,當PCR樣品中細菌數量過多或生長培養基濃度過高會抑制dddPCR反應。值得一提的是,進行dddPCR檢測,不需要提取和純化DNA,同時對背景細菌的存在有更強的抗干擾能力。這使得這種一體化的dPCR平臺在食源性致病菌檢測中具有巨大的應用潛力。
2.4 dPCR檢測食品中空腸彎曲菌
空腸彎曲菌(Campylobacterjejuni)是一種革蘭氏陰性微嗜氧菌。感染空腸彎曲菌的主要途徑是家禽,尤其是雞肉,同時在未經巴氏滅菌的乳制品、水、牛肉和其他農產品中也能檢測出,有研究發現野生動物可能是人類感染空腸彎曲菌的潛在宿主。空腸彎曲菌感染被認為是引起人類細菌性胃腸炎的主要病因,潛伏期為2~3 d,隨后會出現腹瀉、腹痛、發燒、嘔吐等癥狀,具有自限性,大約7~10 d就可康復[40-41]。此外,該菌還會引起炎癥性腸病、賴特氏綜合征以及神經系統疾病米勒費雪癥候群(Miller Fisher癥候群)和格林-巴利綜合征(Guillian-Barre綜合征)。在美國,空腸彎曲菌感染人數大約為130萬[40],給食品安全帶來了巨大挑戰,因此研究快速準確的篩選和檢測方法具有重要意義。
Papic等[42]對75份肉雞頸部樣品進行空腸彎曲菌的定量檢測,同時對dPCR、qPCR和標準平板計數法進行比較。在dPCR檢測中,空腸彎曲菌最佳稀釋度范圍為10-3~102,LOQ為12 523 cfu·g-1。實驗證明,雖然cdPCR和ddPCR都可以觀察到假陽性樣本,但由于cdPCR耗時較長以及較高的試劑成本,不適于空腸彎曲菌的常規檢測和定量,而dPCR可以通過增加平行實驗的次數、增加DNA模板體積和優化dPCR分析進行改善。
2.5 ddPCR檢測食品中志賀氏菌
志賀氏菌(Shigella)是一種革蘭氏陰性細菌。由志賀氏菌引起的疾病可能是通過食用被污染的水、肉類、雞蛋和牛奶引起的。此菌可引起幼兒和成人的急性腹瀉和痢疾,感染者在1~2 d內會出現腹瀉、腹部痙攣、惡心、嘔吐和發燒等癥狀。一般5~7 d內即使不治療也可以康復,但免疫力低下的人可能還需要持續一段時間[43]。5歲以下的兒童最容易被感染,據報道每年約有7 500萬兒童因感染志賀氏菌導致發育遲緩和消瘦,每年約有28 000人因志賀氏菌致命[44-45]。志賀氏菌每年導致全球1.9億例腹瀉[46]。美國每年約有45萬人感染,6 380人住院,26人致命[43]。因此,定量檢測食品中志賀氏菌已成為各國關注的熱點。
Yang等[47]通過檢測志賀氏菌來比較3種不同PCR的靈敏度和特異性,包括傳統PCR、qPCR和ddPCR。ddPCR最佳退火溫度為58 ℃,志賀氏菌增菌培養液LOD為10-1cfu·mL-1。ddPCR檢測靈敏度是qPCR檢測的10倍,是傳統PCR的1 000倍。實驗結果表明,傳統PCR的靈敏度較低,qPCR可檢測出10-4ng·μL-1基因組DNA或100cfu·mL-1細菌,而ddPCR可檢出10-5ng·μL-1基因組DNA和10-1cfu·mL-1細菌,具有更高的靈敏度和準確性。因此ddPCR有檢測時間短、特異性高、重復性好和準確性好等特點,更適合用于志賀氏菌的檢測。
2.6 ddPCR檢測食品中克羅諾桿菌
克羅諾桿菌(Cronobacter)是一種能在食品表面形成生物膜的革蘭氏陰性條件致病菌。它共分為7個屬,具有豐富的遺傳多樣性,感染后主要表現為敗血癥、致死性小腸結腸炎、膿毒癥、腦膜炎以及菌血癥等。它可引起所有年齡段人群感染,尤其是免疫力低下的早產兒和老年人,致死率高達40%~80%,其幸存者依然有嚴重的神經系統后遺癥[48]。克羅諾桿菌廣泛存在于自然界中,主要傳播源是嬰兒配方奶粉,另外牛奶、奶酪、肉類、蔬菜、谷物、香草料及中草藥等也可作為其傳播源。克羅諾桿菌最先鑒定出的毒力因子是腸毒素[49]。該菌耐熱、酸堿、干燥、滲透壓、輻射、抗生素和天然提取[48],因此需要加強食品中克羅諾桿菌的監測及污染控制。
Ma等[50]利用PacBio SMRT測序和ddPCR對7個山羊奶粉樣品進行細菌污染檢測,鑒定出10門119屬249種。主要優勢菌屬有克羅諾菌屬(Cronobacter)、類芽孢桿菌(Paenibacillus)、乳球菌屬(Lactococcus)、嗜堿菌屬(Alkaliphilus)、不動桿菌屬(Acinetobacter)、腸球菌(Enterococcus)、鏈球菌屬(Streptococcus)和氣單胞菌屬(Aeromonas)。實驗說明,在食源性致病菌的檢測中,ddPCR與其他檢測手段結合使用的方法更適用于未來的研究,具有很好的應用前景。
2.7 dPCR檢測食品中副溶血性弧菌
副溶血性弧菌(Vibrioparahaemolyticus)是一種嗜鹽的革蘭氏陰性細菌,該菌廣泛分布于溫暖的海洋或河口中,主要從貝類中檢出,其次還常從海魚、蝦和蟹中檢出。食用副溶血性弧菌污染的生的或未煮熟的海產品可引起急性腸胃炎、敗血癥,會導致以嚴重腹瀉、腹部痙攣、惡心、嘔吐、頭痛和發燒為癥狀的疾病。1991—2001年,我國5 770起食源性疾病中有31.1%由副溶血性弧菌引起[51]。耐熱直接溶血素(thermostable direct hemolysin,tdh)和TDH相關溶血素(TDH-related hemolysin,trh)被認為是該微生物的主要毒力因子[52]。為了有效地預防和控制疾病,發展快速副溶血性弧菌定量檢測方法越來越重要。
方佩佩等[53]采用ddPCR以副溶血性弧菌中tlh為靶基因建立副溶血性弧菌快速定量檢測系統,其副溶血性弧菌有效基因組DNA濃度范圍為2~19 440 copy·20μL-1,靈敏度為0.2 copy·20μL-1,菌懸液濃度的檢出限為50~4.86×105cfu·mL-1。結果證明,dPCR在檢測副溶血性弧菌中具有較好的發展前景,可進一步應用于其他微生物的檢測。總體而言,在致病菌檢測中,dPCR已被證明能夠成功地檢測到低濃度的目標物質,并可獲得非常可靠的檢測結果。楊娟等[54]使用ddPCR與DNase處理法相結合對冷凍食品中副溶血性弧菌進行檢測,并與qPCR進行比較。將DNase試劑與PMA染料分別作用于不同時期的冷凍基質,與PMA相比,DNase處理法無需強光照射,操作簡便快捷,無試劑毒性。結果表明,ddPCR與DNase相結合適用于副溶血性弧菌活的非可培養狀態(viable but non-culturable state,VBNC)的檢測,能對冷凍食品中的微量活性副溶血性弧菌精準定量檢測,其檢測過程快速、安全、穩定。翁文川等[55]對水產品中活的副溶血性弧菌采用ddPCR與PMA新型染料相結合的檢測方法,并與qPCR進行對比。實驗表明,PMA-ddPCR的整個檢測過程只需3~4 h,在食源性致病微生菌檢測中有很大的發展空間。Li等[56]建立了副溶血性弧菌的定量檢測方法,數據顯示,原食品樣品中tdh基因拷貝數為14.90 copies·mL-1,產生tdh的菌株與不產生tdh的菌株的比例約為1∶30。結果顯示,單一的培養方法可能導致錯誤的結論,傳統的弧菌選擇性富集培養基對tdh產生菌的生長沒有特異性的促進作用。因此,開發新的培養基也尤為重要。
2.8 ddPCR檢測食品中單核細胞增生李斯特氏菌
單核細胞增生李斯特氏菌(Listeriamonocytogenes)簡稱單增李斯特氏菌,是一種革蘭氏陽性、桿狀、不產芽孢和兼性厭氧的病原菌,主要存在于即食食品和海鮮中,能夠引起人畜共患病。單核細胞增生李斯特氏菌的毒力主要由6個毒力因子編碼基因組成,分別為prfA、plcA、mpl、InlA、hly、actA和plcB[57]。單核細胞增生李斯特氏菌容易感染免疫力低的人群和動物,還可能導致孕婦流產、死產或胎兒死亡,致死率達20%~30%[58]。孕婦感染單核細胞增生李斯特氏菌的機率是正常人群的17倍,糖尿病患者和免疫力低下的人群感染單核細胞增生李斯特氏菌的概率是正常人群的25倍[59]。單核細胞增生李斯特氏菌能夠在冷藏溫度下生長和繁殖,對酸和鹽具有一定的耐性,而且在低水分的環境中也能生長[58,60]。因此,單核細胞增生李斯特氏菌在食品檢驗中要加以重視。
程逸宇等[61]采用ddPCR檢測方法對乳制品中單核細胞增生李斯特氏菌進行定量檢測,實驗選取單核細胞增生李斯特氏菌的iap基因為靶基因,結果顯示與qPCR相比,ddPCR具有靈敏性強、精密度高、可重復性好和檢測低濃度染菌樣品更精確等優點。雖然qPCR是目前致病菌檢測中最常用的方法,但dPCR比qPCR具有更多潛在的優勢,更適合在食品檢測中推廣運用。趙麗青等[62]以單核細胞增生李斯特氏菌的hlyA基因為靶基因,建立了可準確定量的ddPCR方法;ddPCR反應中的最佳探針濃度為5 pmol·μL-1,檢出限為(3.6±0.1)copies·20 mL-1,標準偏差為0.067%。因此,該研究建立的ddPCR系統可以為單核細胞增生李斯特氏菌的快速定量檢測提供參考。Witte等[63]通過對單核細胞增生李斯特氏菌的檢驗發現,質量較差、保存時間較長的DNA會影響ddPCR的檢測。與qPCR預混液相比,使用ddPCR預混液進行prfA分析時Ct值會顯著提高。實驗結果表明,ddPCR不僅對從純培養物中提取的DNA具有很好的定量能力,而且對來自食品的樣品也有很好的檢測效果。
2.9 ddPCR檢測食品中蠟狀芽孢桿菌
蠟狀芽孢桿菌(Bacilluscereus)是一種能形成芽孢的革蘭氏陽性細菌,廣泛存在于自然界和食品中,如奶制品、肉制品、香辛料、中草藥、谷物、雞蛋、蔬菜、水果和即食食品。當蠟狀芽孢桿菌攝入濃度在105~108cfu·g-1之間時,便會引起食物中毒,主要癥狀為嘔吐綜合征和腹瀉綜合征[64-65]。嘔吐綜合征由毒素引起,通常與大米制品、淀粉類食物和奶酪制品有關;腹瀉綜合征由一種或多種腸毒素引起,與肉類、魚類、牛奶和蔬菜有關;極少數情況下,嘔吐和腹瀉綜合征會同時出現。蠟狀芽孢桿菌對高溫、低水分和其他影響因素都有很強的抵抗力[64, 66],因此,對食品中蠟狀芽孢桿菌進行檢測十分必要。
Porcellato等[67]優化并使用了一種新的ddPCR方法來檢測和定量牛奶中的蠟狀芽孢桿菌,并與qPCR進行比較。優化ddPCR的步驟如下:首先評估4種不同濃度探針的ddPCR結果,然后優化退火溫度。實驗分別從90個紙箱裝的生奶、巴氏殺菌奶和包裝奶樣品中檢測出蠟狀芽孢桿菌組53份(58%)和18份(20%)陽性。結果表明,與qPCR相比,ddPCR表現出更好的性能,在食品樣品檢測中具有良好的應用前景。
3 展望
綜上所述,dPCR較常規檢測技術有絕對定量、精準度高、工作量少和特異性好等諸多優點。針對傳統dPCR的檢測方法,研究人員為了提升檢測的精準度,將dPCR技術與試劑相結合并應用于致病菌的檢測中:例如dPCR與PMA提高了檢測的靈敏度;研究人員用DNase替換PMA,此方法無需強光照射,而且無試劑毒性,大大提高了檢測效率,提高了檢測質量;dPCR與DNA條形碼相結合可以輕松地量化不同細菌群體中的單個菌株,提高精準度。因此,隨著時間的推移,dPCR經過不斷的改進和創新,在各個領域檢測中具有巨大的優勢和廣泛的應用前景。
另一方面,dPCR雖具有上述優點以及巨大的應用潛力,但仍存在一定的局限性。例如:在dPCR檢測中假陰性和假陽性的現象相對較少,但依舊存在,且引發人們對基于dPCR定量食源性致病菌的準確性的擔憂;另外,由于dPCR吞吐量低和容納樣品的體積小,導致動態范圍較窄、穩定性和精密度略低于qPCR;由于dPCR數據分析平臺眾多,且處理方式不盡相同,因此對數據進行規范的協同分析也是dPCR今后發展的重點。
現如今,dPCR是一種很強大的絕對定量方法,有可能徹底改變致病菌的檢測方式。但實現完全自動化也是dPCR應用于檢測食源性致病菌方面的主要挑戰。因此,隨著技術的革新,dPCR技術必將更加自動化。同時,如果dPCR能與一些新興的檢測技術如等溫擴增技術和無透鏡成像技術相結合,將有助于進一步精準的檢測食源性致病菌。隨著今后科技的不斷發展,dPCR在食源性致病菌中的檢測會更加精準、高效和廣泛,為規范我國食品安全工作的實施提供強有力的技術平臺,從而保障人民群眾的食品安全。

