高親和力抗eGFP納米抗體的篩選與應用
劉曉芳,劉 貝,周方月,黃云祥,鐘引鳳,張茹云,梁宇芳,王 丹,付金衡*
(1.南昌大學a.生命科學學院,江西 南昌 330031;b.中德聯(lián)合研究院,江西 南昌 330047;2.江西農業(yè)大學,江西 南昌 330045)
Shimomure等首次分離出的GFP[1]具有β桶和α-螺旋使其性質穩(wěn)定[2],研究者常把它作為一種標簽分子應用于抗體檢測[3-4]、單分子熒光成像[5]、細胞內定位[6-7]等領域[8]。GFP/eGFP作為最常用的工具蛋白,在生命科學研究中具有很高的研究與應用價值,抗GFP/eGFP納米抗體應運發(fā)展。與傳統(tǒng)抗體相比,具有小體積,15 KDa分子質量;耐酸耐熱較高穩(wěn)定性、穿透力強、易于基因工程改造及表達、親和性高等優(yōu)點[9-10]的納米抗體被廣大科學研究者應用于各領域[11],例如在發(fā)育生物學中的有機體和細胞培養(yǎng)系統(tǒng)中[12-13],作為穩(wěn)定生物學中構象狀態(tài)的結晶伴侶[14,15];作為酶的活性調節(jié)劑或抑制劑[16,17];作為生物化學分析的免疫組化試劑[18]或作為“二抗”檢測抗鼠抗Ig的免疫印跡和免疫熒光[19]等。特異性結合GFP/eGFP的抗GFP/eGFP納米抗體在亞細胞定位[20]、細胞內信號通路研究和活細胞成像[21-22]以及靶向納米材料[22]等方面被廣泛應用。但對高親和力的抗GFP/eGFP納米抗體的研究鮮少報道。
本研究以eGFP蛋白免疫羊駝皮下部位,構建抗eGFP納米抗體噬菌體展示文庫;經過四輪淘選獲得能與eGFP結合的納米抗體,通過基因克隆技術在大腸桿菌Rosetta中表達,獲得了高親和力的納米抗體4-28,HRP酶標納米抗體4-28作為檢測“二抗”,簡化ELISA實驗操作,納米抗體4-28偶聯(lián)納米磁珠,免疫沉淀B13-eGFP融合蛋白,為抗eGFP納米抗體的應用奠定基礎。
1 材料與方法
1.1 實驗材料與試劑
M13輔助噬菌體、噬菌粒載體pComb3XSS、E.coliTG1、E.coliDH5α、Rosetta(DE3)、pET-25b(+)載體均由本實驗室保存;弗氏佐劑購自Sigma公司;質粒提取試劑盒、DNA純化試劑盒、割膠純化試劑盒購自天根生物有限公司;Taq酶、核酸內切酶、DNA連接酶等均購自TaKaRa公司;M13 Bacteriophage Antibody(HRP)購自北京義翹神州科技有限公司;HRP Anti His-Tag Mouse Monoclonal Antibody購自北京康為世紀生物科技有限公司;人外周血淋巴分離液、所需引物購自生工生物工程(上海)股份有限公司。
巢式PCR擴增VHH基因,所需引物分別為:
VH-LD:CTT GGT GGT CCT GGC TGC
CH2-R:GGT ACG TGC TGT TGA ACT GTT CC
VHH1:CATGCCATGACTGTGGCCCAGGCGGCCCAGKTGCAGCTCGTGGAGTC
VHH2:CATGCCATGACTCGCGGCCGGCCTGGCCATGGGGGTCTTCGCTGTGGTGCG
VHH3:CATGCCATGACTCGCGGCCGGCCTGGCCGTCTTGTGGTTTTGGTGTCTTGGG
1.2 實驗儀器與設備
臺式高速冷凍離心機、酶標儀、NanoDrop購自Thermo公司;超聲波細胞粉碎機購自寧波新芝公司;凝膠成像系統(tǒng)購自上海天能科技有限公司;電泳儀購自BIO-RAD公司;恒溫培養(yǎng)箱和恒溫搖床購自上海一恒科技公司;PCR儀購自艾本德公司;DYY-I III穩(wěn)壓電泳購自為北京六一儀器廠。
1.3 方法
1.3.1 噬菌體展示文庫的構建
分別取免疫前靜脈血作陰性組和每次免疫后靜脈血,監(jiān)測血清效價;取eGFP四免羊駝后的靜脈血50 mL提取總RNA,然后反轉錄成cDNA,兩步巢式PCR進行擴增VHH基因,將純化后的VHH基因克隆至M13噬菌粒載體pComb3XSS上,電轉至E.coliTG1感受態(tài)細胞中,得到噬菌體文庫。
1.3.2 抗eGFP納米抗體的淘選與鑒定
采用固相親和淘選的方法,以eGFP為靶標從噬菌體文庫中淘選特異性結合eGFP的納米抗體。淘選策略如下,1)逐輪降低抗原包被在酶標板孔中的濃度:100~1 μg·mL-1;2)每輪均投入納米抗體文庫:1.0×1012cfu,3)逐輪降低抗體庫與抗原結合時間:第1輪結合60 min,第2輪結合30 min,第3~4輪結合15 min;4)逐輪增加洗滌次數:第一輪分別用磷酸鹽吐溫緩沖液(PBST)和磷酸鹽緩沖液(PBS)各洗滌5次,第二、三、四輪各洗滌10,15,20次;5)噬菌體洗脫:先采用pH 4.0的甘氨酸-鹽酸洗脫掉親和力較低的噬菌體,然后再采用pH 2.2的甘氨酸-鹽酸洗脫得到特異性噬菌體,每一輪的洗脫條件一致。采用間接phage-ELISA鑒定從第3,4輪測定洗脫物滴度的平板上各隨機挑取的45個單菌落,確定陽性克隆。
1.3.3 抗eGFP納米抗體的原核表達與純化
1)PCR擴增出陽性噬菌體克隆子片段;NcoI和NotI分別酶切4-28基因與pET-25b(+),將純化的目的片段與表達載體用T4 DNA連接酶16 ℃過夜連接,連接產物轉化至Rosetta(DE3)感受態(tài)中;菌落PCR驗證隨機挑取的10個克隆子并測序。
2)1%接種量轉接至100 mL培養(yǎng)基,37 ℃ 220 r·min-1震蕩培養(yǎng)至OD600≈0.6-0.8時加入終濃度為0.1 mmol·L-1IPTG,30 ℃ 220 r·min-1震蕩培養(yǎng)6 h;收集培養(yǎng)物;PBS重懸離心后的菌體,將超聲破碎后的上清經Ni-NTAResin純化,SDS-PAGE分析純化結果。
1.3.4 ELISA鑒定抗eGFP納米抗體活性及特異性
1)將1 μg·mL-1的eGFP 4 ℃過夜包被;PBST甩洗3次,4%脫脂乳37 ℃封閉1 h;PBST甩洗3次,100 μL·孔-1加入稀釋至不同濃度純化后的納米抗體4-28,37 ℃孵育30 min;PBST洗板3次,加入二抗,37 ℃孵育30 min;PBST甩洗拍干6次,加入預熱的TMB單組份顯色液,37 ℃孵育8-10 min,最后加入濃H2SO4終止液終止反應,酶標儀測OD450。
2)分別將eGFP,GFP,黃色熒光蛋白(YFP),牛血清白蛋白(BSA),卵清蛋白(OVA)稀釋至1 μg·mL-1包被于酶標板中,按照1)的實驗方法進行操作,測OD450。
1.3.5 親和力測定
采用OCTET系統(tǒng)生物傳感器測定納米抗體4-28與eGFP的親和力,將200 μL生物素化的eGFP固定在鏈酶親和素的探針上,洗滌,加入200 μL納米抗體,使抗原抗體結合,結束后進行解離;最后通過軟件進行擬合運算計算出動力學參數。
1.3.6 HRP偶聯(lián)納米抗體4-28及工作濃度和穩(wěn)定性鑒定
1)采用過碘酸鈉法將HRP偶聯(lián)抗eGFP納米抗體4-28,向0.3 mg的溶于HAc-NaAc、(pH 5.6)溶液中HRP中加入NaIO4,使其HRP表面的糖分子氧化成醛基,1 mmol·L-1醋酸鈉緩沖液(pH 4.4)每隔4 h透析兩次后,加入150 μg的納米抗體(4-28)4 ℃反應4 h,加入CH3BHNa(5 mol·L-1)反應后用乙醇胺封閉,加入終飽和度45%的硫酸銨粉末,離心取沉淀即為偶聯(lián)物。
2)直接ELISA鑒定其工作濃度及穩(wěn)定性,分別包被eGFP和BSA/OVA 1μg·mL-1,封閉后加入稀釋不同倍數的HRP偶聯(lián)納米抗體4-28,加入預熱的TMB單組份顯色液反應8-10 min后終止,測OD450值。分別將放置-20 ℃ 2個月和6個月的HRP偶聯(lián)納米抗體4-28直接ELISA(同上)的實驗操作驗證其穩(wěn)定性。
1.3.7 B13-EGFP融合蛋白的原核表達與純化
分別將eGFP PCR產物和pET-25b-B13經HindIII、NheI雙酶切后T4DNA連接酶連接,鈣轉至Rosetta(DE3)感受態(tài)中;隨機挑選5個克隆子菌落PCR后測序。誘導表達與純化參照1.3.3操作。
1.3.8 納米抗體4-28偶聯(lián)納米磁珠及免疫沉淀B13-EGFP融合蛋白
1)羧基化的納米磁珠偶聯(lián)高親和力的納米抗體4-28,在磁力架的作用下,將磁珠固定在離心管壁上,活化3~4次,加入活化緩沖液、EDC和Sulfo-NHS,室溫孵育15 min;磁珠被固定在管壁上后吸棄上清,加入納米抗體4-28適時反應后4 ℃過夜偶聯(lián);重復封閉兩次,加入保存液4 ℃保存?zhèn)溆谩?/p>
2)根據抗原抗體反應原理,免疫沉淀B13-eGFP融合蛋白。將含有pET-25b-B13-eGFP質粒的Rosetta細胞誘導表達后超聲破碎,加入抗eGFP納米抗體4-28偶聯(lián)磁珠,并用碳酸鹽緩沖液(CBS)洗滌磁珠沉淀物3次,去除未結合的雜蛋白,SDS-PAGE鑒定上清液和磁珠沉淀物。
2 結果與討論
2.1 噬菌體展示文庫的構建
四免后的羊駝抗血清滴度超過1.28×106(圖1a)。采用兩步巢式PCR擴增VHH基因,第一步擴增得到了約750 bp的片段(圖1b),第二步擴增得到了約500 bp的目的基因(圖1c);將VHH基因克隆至M13噬菌粒載體pComb3XSS后轉化至E.coliTG1,收獲到庫容量為1.85×108cfu納米抗體原始庫,經MI3KO7救援后得到滴度為4×1013cfu·mL-1的噬菌體展示文庫。
2.2 抗eGFP納米抗體的淘選與鑒定
抗體的親和常數KD=Koff(解離常數)/Kon(結合常數),KD值越小,抗體的親和力越高。本研究擬獲得高親和力的抗eGFP納米抗體,因此在原有的基礎上適當調整了淘選策略。通過逐輪降低抗原包被濃度、逐輪減少抗體文庫與抗原的結合時間,以期保留Kon值較大的納米抗體;通過逐輪增加洗滌次數、并在洗脫前用pH 4.0的甘氨酸鹽酸除去Koff相對較大的納米抗體,淘選數據(表1)中表明抗eGFP特異性納米抗體有效富集(富集度為52.17);由于第三四輪淘選時,包被抗原的濃度依次從20降低到5再到1 μg·mL-1以及逐輪增加淘選條件嚴格程度,使第三輪和第四輪的回收率和富集度沒有明顯增加,甚至出現(xiàn)了一定程度的降低(富集度小于1),該結果表明,本研究采用的淘選策略有效的富集了高親和力納米抗體,除掉了低親和力納米抗體。采用間接ELISA鑒定第3、4輪克隆子,結果如圖2、3所示,陽性率達到了95.56%和97.78%;2采用DNAstar軟件進行多序列對比分析,得到了10種納米抗體序列;將這10種納米抗體的噬菌體分別稀釋至同一濃度,采用ELISA測試其結合活性,結果如圖4所示,克隆4-28的OD450最高。

稀釋比/W(a)

表1 淘選結果

NC:陰性對照;BK:空白對照。
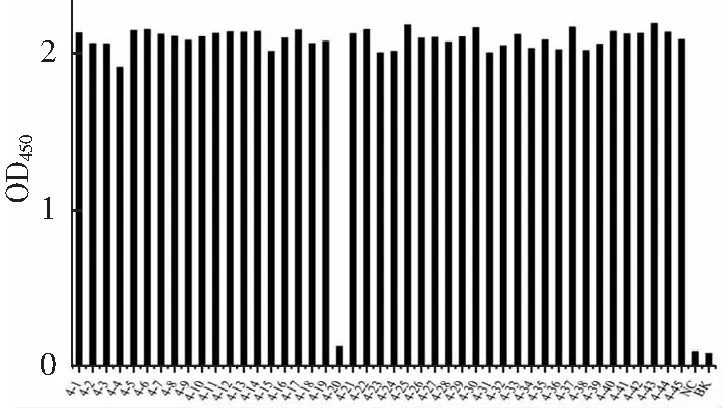
NC:陰性對照;BK:空白對照。
稀釋比
2.3 原核表達載體的構建與表達
按照1.3.3的方法構建原核表達載體,菌落PCR驗證如圖5所示,將750 bp處條帶測序且測序結果顯示序列正確,表達載體構建成功。將構建好的表達載體轉化至大腸桿菌Rosetta感受態(tài)中,IPTG(0.1 mmol·L-1)30 ℃誘導表達6 h后超聲破碎,破碎上清經Ni-NTAResin純化后得到與預期大小相符的20 kDa左右的納米抗體4-28蛋白(圖6),BCA定量蛋白濃度為1.2 mg·mL-1。

泳道M:DNA marker DL2000;泳道1-10:隨機挑取的轉化子。
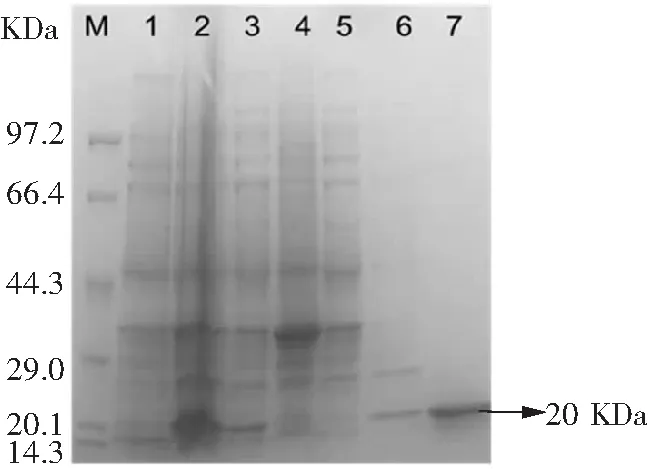
M:蛋白marker;泳道1:誘導前菌體總蛋白;泳道2:誘導后菌體總蛋白;泳道3:破碎上清;泳道4:破碎沉淀;泳道5:鎳柱純化流穿液;泳道6:20 mmol·L-1咪唑洗滌液;泳道7:100 mmol·L-1咪唑洗脫液。
2.4 抗eGFP納米抗體的結合活性及特異性分析
采用ELISA分析的結合活性,如圖7所示,隨著抗eGFP納米抗體4-28濃度的增加,其OD450值逐漸升高并趨于穩(wěn)定,表明納米抗體4-28結合活性良好;將eGFP/GFP/YFP/BSA/OVA稀釋至相同濃度包被后,加入相同濃度的納米抗體,測OD450,如圖8所示,該抗體和eGFP、GFP蛋白結合,和YFP、BSA、OVA結合很弱或不結合,表明納米抗體4-28特異性良好。
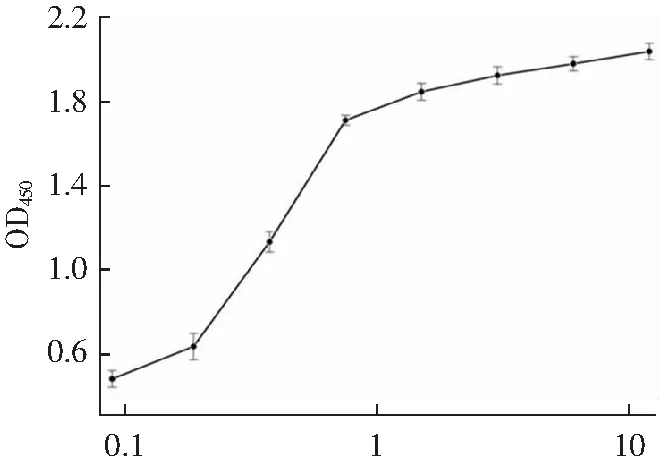
抗體濃度/(μg·mL-1)(a)
2.5 親和力測定分析
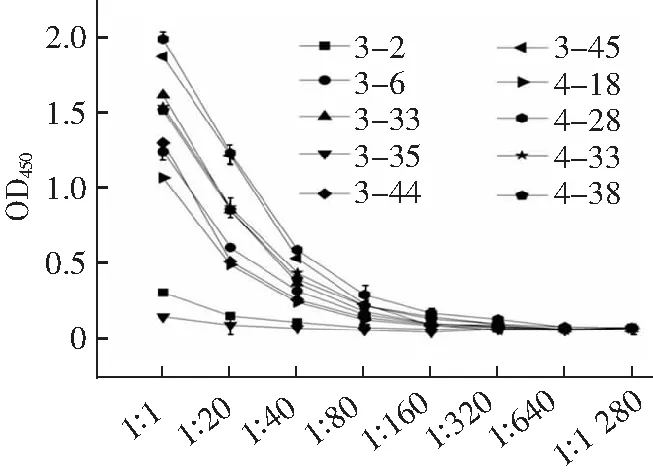
采用ForteBio Octet研究納米抗體與eGFP的親和力。結果如圖8所示,納米抗體4-28的結合常數(Kon)和解離常數(Koff)分別為2.74×105M-1和2.65×10-5M-1s-1,則KD為9.67×10-11M。表2為10種獨特序列的抗eGFP納米抗體的親和力常數(KD),其中3-2和3-45未檢測到信號。納米抗體作為單價抗體,只有一個結構域,其親和力與傳統(tǒng)單克隆抗體相比較低,已有文獻報道的納米抗體親和力常數多在1 μM-1 nM。本研究獲得的納米抗體4-28親和力相對較高,表明實驗中采用的淘選策略是正確的。

T/s

表2 10種納米抗體親和力常數
2.6 HRP標記納米抗體4-28工作濃度及穩(wěn)定性鑒定
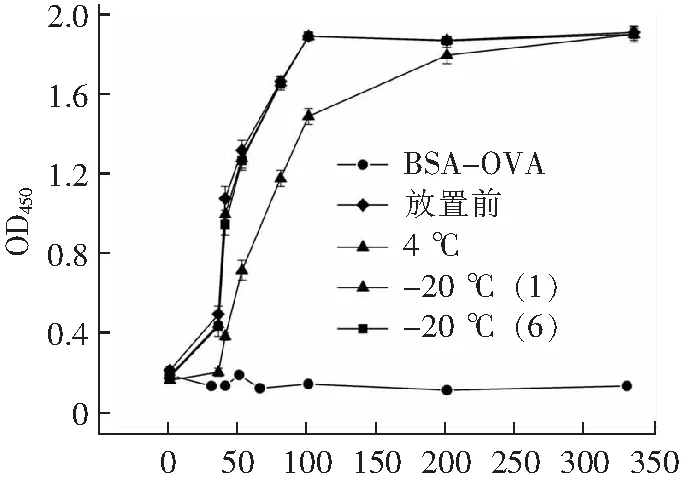
如圖9所示,4 ℃放置一周后,抗體活性下降,-20 ℃放置,時間長短對抗體活性無影響,由圖9可知該酶標抗體的使用稀釋范圍為1:10 000~1:25 000(濃度100~40 ng·mL-1),相比于市場上現(xiàn)有的檢測二抗(稀釋范圍1:5 000~1:20 000)其靈敏度更高。
2.7 融合蛋白的誘導表達及免疫沉淀
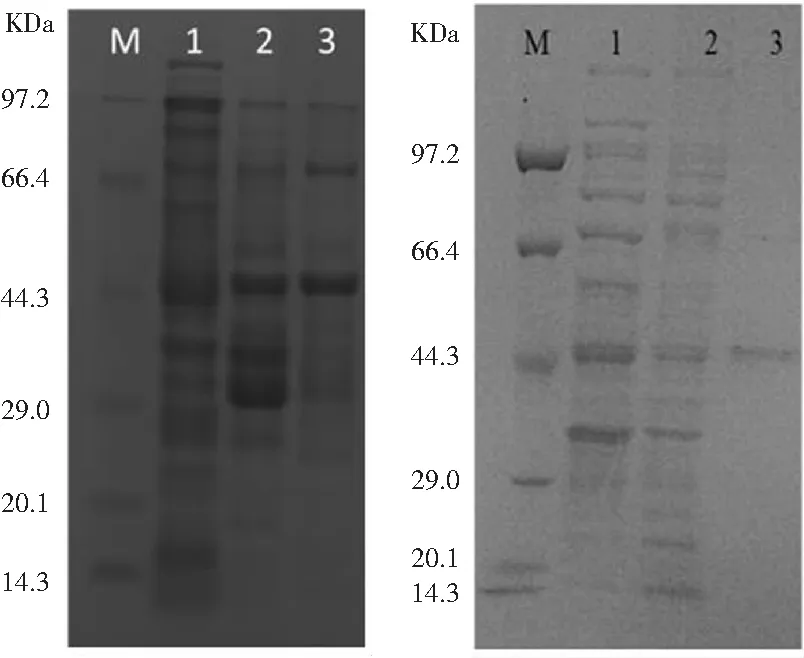
表達后的B13-eGFP融合蛋白經Ni柱純化時,僅用100 mmol·L-1咪唑洗脫目的蛋白,結果如圖10a所示,獲得分子量為45 kDa左右的胞內可溶性的蛋白條帶,經IP鑒定是目的B13-eGFP融合蛋白,但只用一個濃度的咪唑洗脫液洗脫目的蛋白時,目的蛋白純度經Quantity one分析只達到了19.1%。抗EGFP納米抗體與羧基化磁珠偶聯(lián)后免疫沉淀破碎后的融合蛋白,結果如圖10b所示,SDS-PAGE凝膠電泳顯示在45 KDa出現(xiàn)與B13-eGFP融合蛋白大小一致且純度高的目的條帶,與蔡召忠等用Ni柱分離純化PEP-1-VP3融合蛋白[23]相比,該分離目的蛋白的方法簡單快速且純度高。
濃度/(ng·mL-1)
(a) (b)
3 總結
在羊駝免疫效價超出1.28×106時,成功構建了抗eGFP納米抗體文庫。依據抗原-抗體相互作用的動力學規(guī)律,在淘選時通過調整eGFP的包被濃度、文庫與eGFP結合時間、洗滌次數、噬菌體洗脫方式等條件獲得了10種高親和力的納米抗體,其中納米抗體4-28親和力最高,達到了9.67×10-11M。此外,納米抗體4-28與eGFP和GFP有較好的結合,與YFP等蛋白無明顯結合。本研究獲得的高親和力納米抗體在腫瘤檢測等免疫學研究中有望成為非常理想的工具抗體。高親和力的抗eGFP納米抗體4-28與HRP酶進行偶聯(lián)用作檢測二抗,檢測范圍在1:10 000~1:25 000(濃度100~40 ng·mL-1),相比于市場上現(xiàn)有的檢測二抗(稀釋范圍1:5 000~1:20 000)其靈敏度更高。高親和力的納米抗體能夠特異性的和eGFP/GFP標記的目的蛋白快速結合,在免疫沉淀實驗中,利用磁分離技術,可簡單快速分離得到沉淀復合物。

