豬繁殖與呼吸綜合征病毒GP5蛋白在昆蟲細胞中的可溶性表達
尹園英,高雁怩,夏婷婷,白娟,姜平
(南京農業大學動物醫學院/農業農村部動物細菌學重點實驗室,江蘇 南京 210095)
豬繁殖與呼吸綜合征病毒(porcine reproductive and respiratory syndrome virus, PRRSV)是引起母豬繁殖障礙和新生仔豬呼吸道疾病的重要病原,給全球生豬養殖造成巨大經濟損失[1]。目前,PRRSV商品疫苗尚不理想,該病仍嚴重影響我國養豬業的健康發展。
PRRSV為單股正鏈RNA病毒,分為歐洲型、美洲型2個基因型,同一基因型毒株中又有多種基因亞型。我國主要流行的美洲型毒株包括經典型、高致病性和NADC30樣等基因亞型毒株。該病毒基因組全長約15 kb,編碼16種非結構蛋白和8種結構蛋白[2]。其中,GP5是病毒的主要囊膜糖基化蛋白,其序列在各毒株之間變異較大,GP5蛋白大小約25 ku,含有A和B 2個重要抗原表位。B表位高度保守,可誘發中和抗體。A表位為非中和性表位[3]。GP5蛋白是PRRSV亞單位疫苗研究的重要靶標抗原。
為了提高PRRSV疫苗免疫保護廣譜性和GP5蛋白表達效力,本研究根據我國流行的3種基因亞型PRRSV代表性毒株的GP5基因序列,設計合成了雜合GP5基因(xGP5m),并用PCR方法在其前端分別添加TAT、ppTG20以及MPG 3種穿膜肽[4-6],構建獲得4株重組桿狀病毒,獲得了可溶性表達的GP5蛋白,證明其具有的較好抗原性。
1 材料與方法
1.1 主要材料
pFastBacTMDual表達系統和Lipofectamine 3000為Invitrogen公司產品。PRRSV陽性血清為本實驗室制備保存。His單克隆抗體購自翼飛雪生物科技有限公司。SPA-HRP、羊抗小鼠IgG-HRP購自武漢博士德生物工程公司。Sf-900Ⅲ SFM無血清培養基為Gibco公司產品。Mini plasmid、DNA凝膠回收試劑盒、2×TaqMix均購自南京諾唯贊公司。限制性核酸內切酶購自Thermo Fisher公司。ECL化學發光試劑盒購自購Biouniquer公司。IPTG購自大連寶生物工程有限公司。大腸桿菌DH5α和DH10Bac菌株、Sf9細胞均為本實驗室凍存。6~8周齡BALB/c雌鼠50只,購自南京青龍山動物場。
1.2 目的基因設計與合成
選擇PRRSV代表性流行毒株S1、BB0907和FJ1402基因序列,比對分析GP5蛋白氨基酸序列,選取其共有的氨基酸組合為雜合GP5序列(xGP5),并在C端引入6×His標簽序列,再將其對應基因序列按昆蟲細胞偏嗜性優化,命名為xGP5m。基因合成由南京金斯瑞生物科技有限公司完成。根據合成基因序列,設計引物(表1),采用PCR方法,在xGP5m基因N端分別添加3種穿膜肽(TAT、ppTG20、MPG)基因序列,實現融合表達(圖1)。

表1 PCR引物基因序列

A. PRRSV 3種毒株的GP5蛋白序列比對分析;B.重組蛋白示意圖及3種穿膜肽序列
1.3 重組桿狀病毒的構建
將目的基因克隆到昆蟲桿狀病毒表達載體pFastBacTMDual的PH啟動子下的EcoRⅠ和HindⅢ 2個酶切位點,獲得重組轉移質粒pF-xGP5m、pF-TAT-xGP5m、pF-ppTG20-xGP5m和pF-MPG-xGP5m,基因測序正確。按常規方法,將重組轉移質粒轉化至DH10Bac,在X-gal、IPTG、四環素、慶大霉素和卡那霉素的平板上進行2輪藍白斑篩選。挑取白斑進行PCR鑒定,鑒定正確后提取重組Bacmids,轉染入Sf9細胞,28 ℃培養5 d,收獲上清即為第一代重組桿狀病毒。將獲得的重組病毒于Sf9細胞上擴增至第3代,-80 ℃凍存。
1.4 間接免疫熒光鑒定重組桿狀病毒
將重組桿狀病毒接種長滿單層的Sf9細胞,28 ℃培養72 h,用PBS洗滌3次后用預冷的無水乙醇于4 ℃固定30 min,洗滌3次,加入以PBS 1∶200倍稀釋的His單抗,37 ℃孵育1 h,洗滌后加入1∶200稀釋的FITC標記的山羊抗小鼠二抗,37 ℃孵育30 min,洗滌后置于熒光顯微鏡下觀察。細胞胞漿中出現綠色熒光的細胞判定為重組蛋白表達成功。
1.5 重組桿狀病毒TCID50測定
Sf9細胞鋪96孔細胞板,待細胞長滿單層時準備接毒用于各重組桿狀病毒TCID50的測定,方法如下:10倍比稀釋各重組桿狀病毒液,棄去96孔板中營養液,每孔加入各稀釋度的病毒液100 μL,每個稀釋度設置8個重復,然后于28 ℃培養箱培養72 h后進行間接免疫熒光試驗,方法如1.4,細胞胞漿中出現綠色熒光則判定為陽性孔,并使用Karber法計算各重組病毒TCID50。
1.6 Western blot檢測重組蛋白表達
將重組桿狀病毒接種Sf9細胞,28 ℃培養96 h,收集細胞并超聲破碎,4 ℃ 12 000 r/min離心5 min分離上清沉淀,沉淀再用相同體積的PBS重懸,采用Western blot檢測,分別用His單抗(PBS 1∶5 000稀釋)、PRRSV陽性血清(PBS 1∶200稀釋)作為一抗,二抗分別為HRP標記的山羊抗鼠IgG抗體(PBS 1∶1 000稀釋)、HRP-SPA(PBS 1∶10 000稀釋),最后用ECL化學發光劑顯色。
1.7 小鼠免疫試驗
將4種重組桿狀病毒分別接種Sf9細胞(T75細胞瓶,500 μL/瓶),接毒96 h病變明顯后棄培養上清,每瓶細胞加入2 mL PBS,凍融1次后,超聲破碎收獲2 mL細胞破碎液,采用Western blot半定量的方法將目的蛋白濃度調整一致,再分別與ISA206佐劑1∶1混合充分乳化制備疫苗。將6周齡BALB/c雌鼠50只隨機分為5組,每組10只,1~4組每只小鼠皮下免疫疫苗200 μL,21 d后加強免疫1次,第5組為空白對照組。
首免后21和42 d每組分別采血測定血清ELISA抗體效價,以P/N大于2.1的最大血清稀釋度作為血清的ELISA效價。ELISA具體步驟如下:使用碳酸鹽緩沖液(pH=9.6)將純化的PRRSV全病毒抗原稀釋至2 μg/mL,100 μL/孔加入酶標板條,37 ℃包被2 h;之后棄去孔內液體,每孔加入200 μL PBST,振搖洗滌3次;每孔加入200 μL 5%脫脂乳,于37 ℃溫箱封閉2 h后洗滌;將分離的小鼠血清按照1∶50、1∶100、1∶200、1∶400、1∶800、1∶1 600、1∶3 200、1∶6 400、1∶12 800依此倍比稀釋,每孔加入100 μL稀釋后的待測血清,并設置標準陰陽性血清對照,37 ℃孵育1 h后洗滌;再以PBST 1∶1 000倍稀釋HRP標記的山羊抗鼠IgG抗體作為二抗,100 μL/孔,37 ℃孵育30 min后洗滌;避光加入TMB顯色液,100 μL/孔,37 ℃顯色10 min后每孔加入50 μL終止液,酶標儀讀取OD450 nm,并計算P/N值。
2 結果與分析
2.1 重組轉移載體的構建與鑒定
將設計合成的xGP5m基因作為模板,采用PCR方法擴增TAT-xGP5m、ppTG20-xGP5m、MPG-xGP5m基因片段,并將4種目的基因分別克隆至pFastBacTMDual載體上的PH啟動子下,獲得重組質粒pF-xGP5m、pF-TAT-xGP5m、pF-ppTG20-xGP5m和pF-MPG-xGP5m,雙酶切鑒定結果見圖2。基因測序結果為,xGP5m、TAT-xGP5m、ppTG20-xGP5m和MPG-xGP5m基因長度分別為642、675、702和723 bp,與設計的目的基因條帶完全一致。
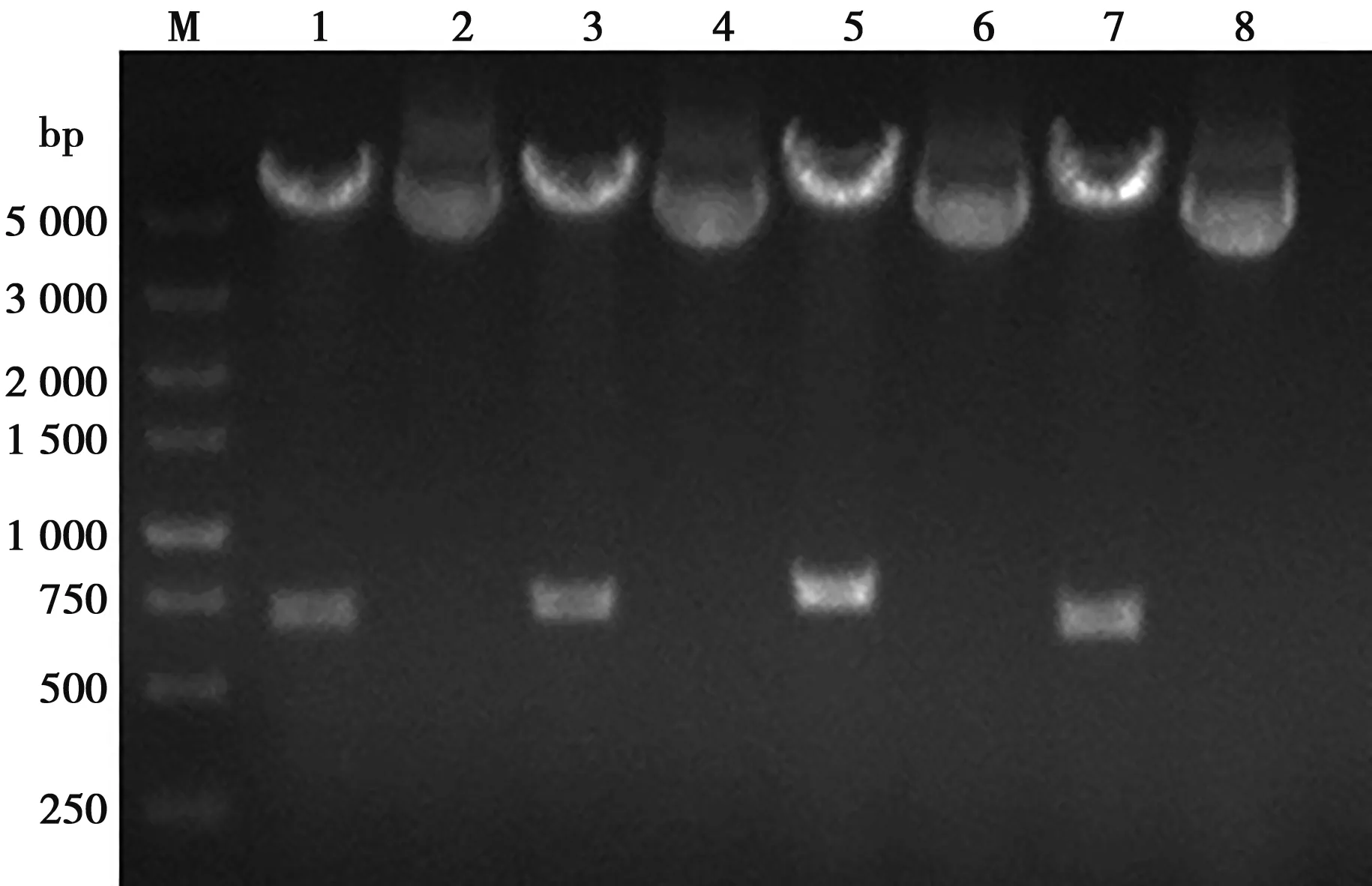
M. DL5000; 1.pF-xGP5酶切產物; 2.pFxGP5m; 3.pF-TAT-xGP5m酶切產物; 4.pF-TAT-xGP5m; 5.pF-ppTG20-xGP5m酶切產物; 6.pF-ppTG20-xGP5m; 7.pF-MPG-xGP5m酶切產物; 8.pF-MPG-xGP5m
2.2 重組桿狀病毒的獲得
重組轉移載體轉化入DH10Bac,獲得含有目的基因的重組Bacmids,以pUC/M13引物對重組Bacmids進行P鑒定。分別將鑒定為陽性的重組Bacmids轉染Sf9細胞,培養5 d后收獲細胞培養液,于Sf9細胞傳代2次,出現細胞病變,表現為細胞變大變圓、通透性增加、脫落(圖3A),獲得4株重組桿狀病毒rAc-xGP5m、rAc-TAT-xGP5m、rAc-ppTG20-xGP5m和rAc-MPG-xGP5m。重組病毒TCID50分別為10-8.5/0.1 mL、10-9.0/0.1 mL、10-8.5/0.1 mL和10-8.75/0.1 mL。
2.3 間接免疫熒光鑒定重組桿狀病毒
將重組桿狀病毒接種長滿單層的Sf9細胞,培養72 h,用His單抗進行間接免疫熒光試驗,熒光顯微鏡下觀察,重組桿狀病毒感染細胞胞漿中出現綠色熒光(圖3B)。
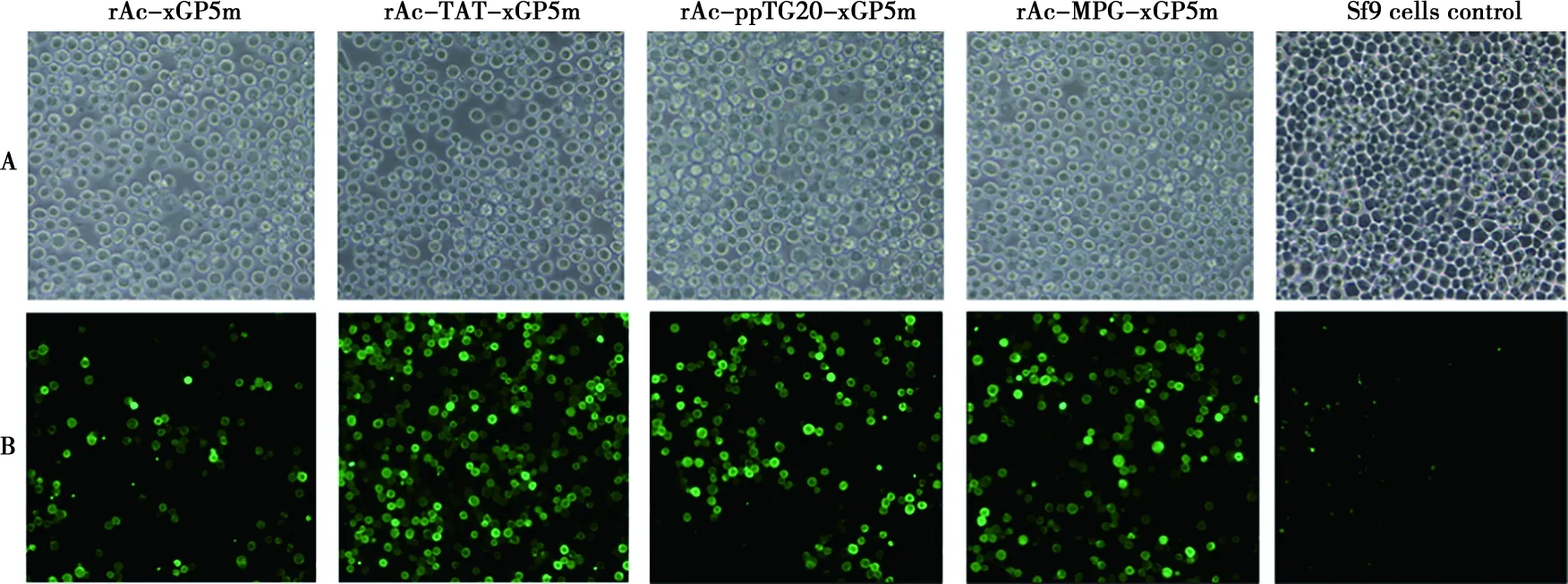
圖3 重組桿狀病毒感染Sf 9細胞引起的細胞病變(A)及間接免疫熒光試驗(B)
2.4 Western blot檢測重組蛋白表達
將重組桿狀病毒接種長滿單層的Sf9細胞,96 h后收樣分別用His-Tag單抗、PRRSV陽性血清作為一抗進行Western blot鑒定,結果(圖4)顯示在上清和沉淀中均可檢測到特異性條帶,與目的蛋白大小一致,并且目的蛋白獲得了較好的糖基化修飾,表明4種重組蛋白均可以表達,且rAc-TAT-xGP5m表達量最高。
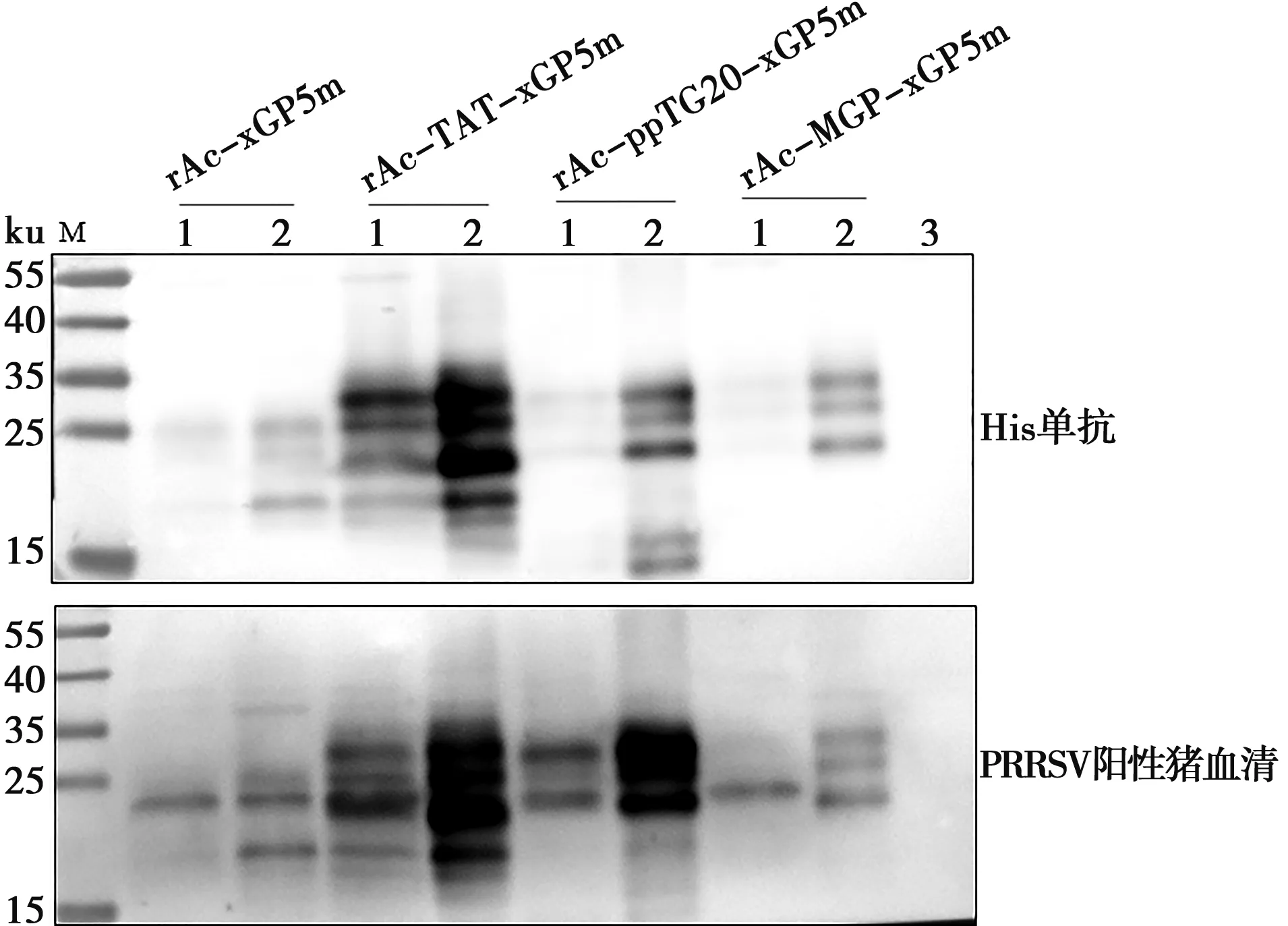
M.蛋白質分子質量標準;1. 重組桿狀病毒感染細胞裂解液離心上清液;2. 重組桿狀病毒感染細胞裂解液離心沉淀物;3. Sf9細胞裂解液
2.5 重組蛋白免疫原性分析
小鼠首次免疫后21和42 d采集小鼠血清,采用純化的PRRSV全病毒作為包被抗原,進行間接ELISA檢測PRRSV抗體,結果見圖5。首免后42 d rAc-TAT-xGP5m免疫組抗體水平極顯著高于其他3個免疫組(P<0.001),表明融合TAT穿膜肽可有效增強xGP5m免疫效果,rAc-TAT-xGP5m重組蛋白具有良好的免疫原性。
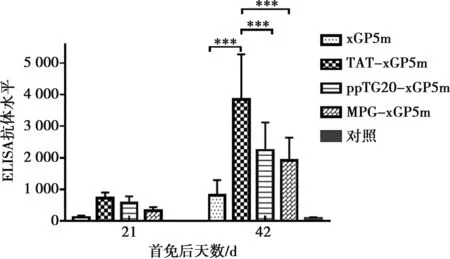
***表示P<0.001
3 討論
我國自1995年首次暴發PRRSV以來,先后出現高致病性PRRSV和NADC30-like毒株流行[7]。目前呈現多種基因亞型PRRSV流行,而且不同基因亞型毒株之間基因重組頻發,新的變異毒株不斷增多,豬場經濟損失十分嚴重。
PRRSV商品化的滅活苗和弱毒苗免疫保護效果有限,安全高效的新型疫苗研制受到國內外持續關注,包括基因疫苗、活載體疫苗和亞單位疫苗等[8-11]。Plana等[11]運用桿狀病毒表達PRRSV的ORF2~ORF7基因,證明GP5蛋白可對免疫母豬提供部分保護。但PRRSV流行毒株GP5基因變異較大,不同毒株間交叉免疫保護作用不夠理想[12]。本研究比對了我國PRRSV主要流行毒株S1(經典型)、BB0907(高致病型)和FJ1402(NADC30-like毒株)的GP5蛋白氨基酸序列,選取其共有的氨基酸組合為雜合GP5序列,構建重組桿狀病毒,實現了GP5與3種穿膜肽的融合表達,其中TAT-xGP5m重組桿狀病毒感染細胞目的蛋白呈現可溶性表達,具有PRRSV抗原性和免疫原性,為PRRSV新型疫苗研制奠定了基礎。
PRRSV GP5蛋白為糖基化跨膜蛋白,基因工程表達產物一般與細胞膜結合,表達效率較低。穿膜肽又稱細胞穿透肽(cell-penetrating peptides,CPPs),一般由堿性氨基酸組成,可攜帶大分子直接穿越磷脂雙分子層實現跨膜轉運,并且能通過提高免疫細胞的聚集來調控先天性和適應性免疫應答[13]。Keogan等[14]報道穿膜肽TAT能夠抑制HIV-1復制。肖少波等[15]研究發現融合表達穿膜肽VP22與PRRSV GP5能增強GP5蛋白誘導的體液免疫和細胞免疫反應。本研究將3種穿膜肽(TAT、ppTG20、MPG)序列添加至xGP5m基因N端,成功構建4種重組桿狀病毒。其中TAT-xGP5m上清和沉淀的表達量均明顯高于xGP5m、ppTG20-xGP5m和MPG-xGP5m,實現了GP5蛋白的高水平和可溶性表達,但是Western blot結果中存在雜帶,可能是由于His單抗及PRRSV陽性血清與表達產物中的一些蛋白發生了非特異性結合。TAT-xGP5m重組桿狀病毒感染細胞的裂解物免疫小鼠,其PRRSV抗體水平明顯高于xGP5m免疫組,說明TAT能促進GP5蛋白可溶性表達,增強其小鼠體液免疫應答能力。當然,重組桿狀病毒感染細胞目的蛋白的表達量及其豬體免疫特性尚需進一步研究。

