TGF-β1對大鼠腎小球系膜細胞纖維化蛋白及長鏈非編碼RNA uc.412表達的影響
楊思慧,王錦,黃嬋,安夢如,張愛青,甘衛華
南京醫科大學第二附屬醫院,南京210003
慢性腎臟病(CKD)是由多種原因引起的慢性腎臟結構及功能障礙,腎纖維化是其主要病理學基礎。轉化生長因子β1(TGF-β1)具有調節細胞生長、分化、凋亡和遷移等多種生物學活性,能夠介導腎小球系膜纖維化,是腎臟纖維化發病機制中的關鍵介質[1-3]。Smad蛋白是TGF-β下游的主要效應蛋白,在腎臟受到各種病理性因素(缺血、缺氧或高糖等)和外界環境誘導因素時,活化的TGF-β1結合Ⅰ型和Ⅱ型TGF-β受體以及受體相關Smad(R-Smad),即Smad2和Smad3;磷酸化的Smad2/3與Smad4形成低聚物,進入細胞核調控下游靶基因的轉錄,誘導纖維化相關蛋白α平滑肌肌動蛋白(α-SMA)及膠原蛋白(Collagen)形成,進一步誘導腎小管上皮—間充質轉化(EMT),從而促進腎纖維化[4-5]。長鏈非編碼RNA(lncRNA)雖然不參與編碼蛋白質,但可作為重要的調控分子發揮多種生物學功能,在某些細胞的增殖調控中發揮重要作用[6]。本課題組前期通過高通量lncRNA微矩陣芯片技術在TGF-β1處理的系膜細胞中篩選出lncRNA uc.412,證實其表達與系膜細胞增殖密切相關,但其在系膜細胞中的具體生物學功能尚不明確[7-9]。SIS3是Smad3磷酸化特異性抑制劑,2020年6—11月,本研究采用SIS3抑制TGF-β1誘導的Smad3磷酸化,觀察TGF-β1誘導大鼠腎小球系膜細胞纖維化蛋白表達的作用,并進一步探討其作用機制與lncRNA uc.412的關系,為臨床防治腎纖維化相關的CKD奠定基礎。
1 材料與方法
1.1 細胞與試劑 大鼠腎小球系膜細胞HBZY-1細胞株購自中國典型培養物保藏中心。過表達慢病毒lncRNA uc.412購自上海吉凱基因科技有限公司,1型膠原蛋白(Collagen-1)、α-SMA抗體購自美國Abcam公司,TGF-β1購自Novoprotein公司,SIS3購自MCE公司,低糖DMEM培養基、胎牛血清和胰蛋白酶購自Gibco公司,GAPDH購自Affinity公司,二抗兔IgG、二抗鼠IgG、BCA蛋白定量試劑盒購自凱基生物,TRIzol試劑購自Invitrogen公司,PCR試劑盒購自TaKaRa公司,PCR引物由上海銳真生物合成。
1.2 細胞培養 將HBZY-1細胞置于含10%胎牛血清的DMEM培養基(含100 U/L青霉素、100 mg/L鏈霉素)中,37℃、5%CO2細胞培養箱中培養。每天于倒置顯微鏡下觀察細胞形態,2~3 d更換培養基,當細胞融合率達到80%~90%時,加入0.25%胰酶進行消化傳代。當細胞長至60%~70%融合時,用無血清培養基繼續培養24 h,使細胞生長同步化。取對數生長期細胞用于后續實驗。
1.3 細胞lncRNA uc.412表達檢測 采用Real-time PCR法。取對數生長期細胞,按(2~8)×105/孔接種至6孔板,隨機分為對照組、TGF-β1組、TGF-β1+SIS3組。對照組僅加入培養基,TGF-β1組加入10 ng/mL TGFβ1,TGF-β1+SIS3組同時加入10 ng/mL TGF-β1和1μmol/L SIS3,繼續培養24 h。收集各組細胞,TRIzol法提取總RNA,逆轉錄合成cDNA。配置10μL PCR反應體系,以β-actin作為內參,參照PCR試劑盒說明書進行Real-time PCR。引物序列:lncRNA uc.412上游5'-CTTGAATTCCAAGCAGCA?CA-3',下游5'-CAGCAATTAATCCCCCAAGA-3';βactin上游5'-CGGGAAATCGTGCGTGAC-3',下游5'-TGGAAGGTGGACAGCGAGG-3'。反應體系(20μL):SYBR 5μL,上下游引物各0.4μL,Rox 0.2μL,cDNA 1μL,ddH2O 3μL。反應條件:預變性95℃30 s;變性95℃5 s;退火60℃34 s;延伸60℃1 min,40個循環;降溫50℃30 s。通過熔解曲線分析擴增產物的特異性,2-ΔΔCt法計算目的基因的相對表達量。每個樣本設置3個復孔,實驗重復3次。
1.4 細胞Collagen-1、α-SMA及p-Smad3表達檢測采用Western blotting法。細胞分組與干預方法同“1.3”。收集各組細胞,加入蛋自裂解液冰上裂解30 min,4℃、12 000 r/min離心15 min,取上清液。BCA法進行蛋白定量,加入5×上樣緩沖液,變性處理(95℃,10 min)。取30μg蛋白上樣,10%十二烷基硫酸鈉聚丙烯酰胺凝膠(SDS-PAGE)電泳,濕轉至PVDF膜,5%脫脂奶粉封閉2 h。加入一抗(稀釋比例為1∶1 000)4℃孵育過夜,TBST緩沖液洗滌3次;加入二抗(稀釋比例為1∶2 000)室溫孵育1 h,TBST緩沖液洗滌3次。加入ECL發光液顯色,凝膠成像系統圖像掃描,Image J軟件測定灰度值。以GAPDH作為內參,計算目的蛋白與GAPDH蛋白灰度值的比值,作為目的蛋白的相對表達量。
1.5 過表達lncRNA uc.412對腎小球系膜細胞纖維化蛋白表達的影響觀察
1.5.1 細胞分組與慢病毒轉染 取對數生長期細胞,接種于6孔板,置于37℃、5%CO2細胞培養箱中培養。待細胞融合率達到60%~70%,加入無血清DMEM培養基繼續培養24 h,使細胞生長同步化。將細胞分為對照組、過表達組和病毒空載組,過表達組加入lncRNA uc.412過表達病毒液,病毒空載組加入不含lncRNA uc.412的慢病毒液,對照組加入等量培養基,繼續37℃培養24 h。
1.5.2 細胞Collagen-1、α-SMA mRNA表達檢測采用Real-time PCR法。PCR引物序列:α-SMA上游5'-AACTATGCTTCTGGACGTACAA-3',下 游5'-CATAGCCCTCATAGATAGGCAC-3';Collagen-1上游5'-AAAGATGGACTCAACGGTCTC-3',下游5'-CAG?GAAGCTGAAGTCATAACCA-3'。具體操作步驟參照“1.3”。
1.5.3 細胞Collagen-1、α-SMA蛋白表達檢測 采用Western blotting法。具體操作步驟參照“1.4”。
1.6 統計學方法 采用GraphPad Prism8統計軟件。計量資料以±s表示,兩組間比較采用t檢驗,多組間比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 各組細胞lncRNA uc.412表達比較 見表1。與對照組比較,TGF-β1組lncRNA uc.412表達升高;與TGF-β1組比較,TGF-β1+SIS3組lncRNA uc.412表達下降(P均<0.01)。
表1 各組細胞lncRNA uc.412表達水平比較(±s)

表1 各組細胞lncRNA uc.412表達水平比較(±s)
注:與對照組相比,*P<0.01;與TGF-β1組相比,#P<0.01。
?
2.2 各組細胞Collagen-1、α-SMA及p-Smad3蛋白表達比較 見表2。與對照組比較,TGF-β1組細胞Collagen-1、α-SMA及p-Smad3蛋白表達升高(P均<0.05);與TGF-β1組 比 較,TGF-β1+SIS3組 細 胞Collagen-1、α-SMA及p-Smad3蛋白表達下降(P均<0.05)。
表2 各組細胞Collagen 1、α-SMA及p-Smad3蛋白表達水平比較(±s)
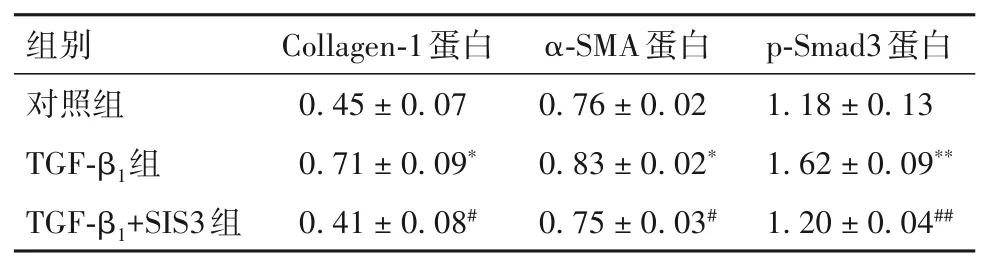
表2 各組細胞Collagen 1、α-SMA及p-Smad3蛋白表達水平比較(±s)
注:與對照組相比,*P<0.05,**P<0.01;與TGF-β1組相比,#P<0.05,##P<0.01。
?
2.3 過表達lncRNA uc.412對細胞纖維化蛋白及mRNA的影響 見表3。與對照組相比,病毒空載組Collagen-1、α-SMA蛋白及mRNA表達無明顯變化(P均>0.05),過表達組Collagen-1、α-SMA蛋白及mRNA表達均升高(P均<0.05)。
表3 各組細胞Collagen-1、α-SMA蛋白及mRNA表達水平比較(±s)
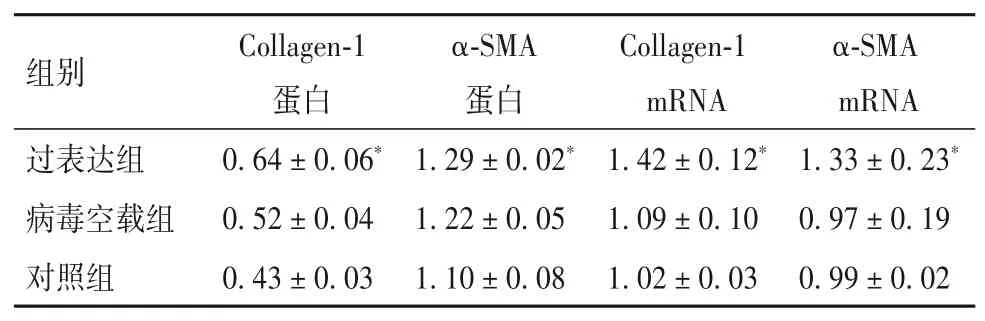
表3 各組細胞Collagen-1、α-SMA蛋白及mRNA表達水平比較(±s)
注:與對照組、病毒空載組相比,*P<0.05。
?
3 討論
了解腎纖維化的分子發病機制,對開發CKD的新型治療策略有重要作用。腎臟纖維化是一個復雜的過程,主要病理表現為細胞外基質沉積和纖維細胞過度增殖,共同導致腎間質、腎小球硬化及慢性炎癥細胞浸潤,引起各種誘因導致的慢性腎臟疾病[10]。研究表明,進行性腎纖維化是由多種介質通過多種途徑介導的,包括生長因子、細胞因子、代謝毒素和應激分子等,其中TGF-β1是腎臟纖維化的發病機制中的關鍵介質。TGF-β1是TGF-β超家族的成員,具有調節細胞生長、分化、凋亡和遷移等多種生物學過程[11]。本研究結果顯示,腎小球系膜細胞中加入TGF-β1處理后,纖維化相關蛋白Collagen-1、α-SMA蛋白表達升高,證實TGF-β1可以誘導腎小球系膜纖維化。
lncRNA在某些細胞的增殖調控中發揮重要作用。近年來,關于lncRNA與腎臟疾病的研究越來越多,已有文獻報道lncRNA參與腎纖維化[12]。FENG等[13]報道,在輸尿管梗阻性腎病(UUO)和抗腎小球基底膜腎小球性腎炎(抗GBM-GN)小鼠中,發現151個Smad3依賴性的lncRNA,其中Erbb4-IR是通過下調Smad7來導致TGF-β/Smad3介導腎纖維化。WANG等[14]報道,TGF-β/Smad3相互作用長非編碼RNA(lnc-TSI)受Smad3轉錄調控,并特異性抑制TGF-β誘導的Smad3磷酸化和下游纖維化基因表達,從而阻止Smad3與獨立于Smad7的TGF-β受體1相互作用,抑制腎臟纖維化。因此,研究lncRNA對于治療腎纖維化導致的慢性腎臟疾病具有重要意義。lncRNA uc.412基因全長268 bp,位于人類17號染色體q12片段,其表達水平與系膜細胞增殖程度有關。本研究結果顯示,腎小球系膜細胞加入TGF-β1后,與對照組相比,TGF-β1組lncRNA uc.412表達明顯上調;建立過表達lncRNA uc.412的系膜細胞模型,發現過表達組纖維化相關蛋白Collagen-1、α-SMA蛋白及mRNA表達均顯著增加。這表明lncRNA uc.412參與介導腎小球系膜纖維化,但TGF-β1通過lncRNA uc.412調控系膜纖維化的機制有待進一步研究。
Smad蛋白家族是TGF-β下游的主要效應蛋白,在腎臟受到各種病理性因素(如缺血、缺氧或高糖等)和外界環境誘導因素影響時,TGF-β受體被激活,與下游底物Smad蛋白家族結合,形成復合體轉移入細胞核,調控下游基因轉錄,進一步誘導腎小管上皮間充質轉化,從而促進腎纖維化。其中Smad3是有效的致纖維化因子,敲除Smad3有效減輕腎臟纖 維 化[1]。XU等[15]發 現,敲 除Smad3可 降 低lncRNA Erbb4-IR轉錄,同時增加miR-29b轉錄,保護小鼠腎臟免受進行性腎損傷,Smad3可能成為糖尿病腎病的新型有效治療靶標。ZHOU等[16]在Smad3野生型/敲除型的小鼠上構建單側輸尿管結扎誘導的腎臟纖維化模型,發現lncRNA np_5318和np_17856參與了TGF-β1介導的腎纖維化,并可能成為腎臟纖維化的潛在治療靶點。因此推測,TGF-β1可能通過與下游Smad3信號通路上調lncRNA uc.412,進而促進系膜細胞纖維化相關蛋白表達。SIS3是Smad3的特異性抑制劑,可抑制TGF-β1誘導的Smad3磷酸化。JI等[17]研究發現,SIS3通過抑制單側輸尿管結扎小鼠腎臟中的TGF-β/Smad3信號轉導通路,改善了腎組織纖維化、細胞凋亡及炎癥。本研究結果顯示,與TGF-β1組比較,TGF-β1+SIS3組p-Smad3水平下調,證實SIS3能特異性抑制Smad3磷酸化;用SIS3干預后,與TGF-β1組相比,TGF-β1+SIS3組Collagen-1、α-SMA蛋白及mRNA表達顯著降低,證實TGF-β1通過Smad3信號途徑誘導系膜細胞纖維化蛋白表達增加;與TGF-β1組相比,TGF-β1+SIS3組系膜細胞lncRNA uc.412表達降低,提示TGF-β1可以通過Smad3信號通路上調lncRNA uc.412表達,從而參與腎小球系膜纖維化的進程。
綜上所述,TGF-β1能夠誘導腎小球系膜纖維化,其作用機制可能是通過Smad3信號通路上調lncRNA uc.412表達從而發揮作用,提示lncRNA uc.412可能具有治療CKD的潛在前景,但其具體機制仍有待進一步深入研究。

