Sebia Capillarys 3 TERA血清蛋白電泳的方法驗證和流程優化*
沈若堅,吳 群,郭奕超,邵文琦△,王蓓麗,2,郭 瑋,2
1.復旦大學附屬中山醫院檢驗科,上海 200032;2.復旦大學附屬中山醫院廈門醫院檢驗科,福建廈門 361015
血清蛋白電泳能分離血清或體液中的不同分析物,有助于識別疾病過程相關的生物流體組分[1]。血清含有各種蛋白質,其等電點均在pH值7.5以下,若置于pH值8.0以上的緩沖液電泳時均游離成負離子,再向正極移動。由于其等電點、相對分子質量和分子形狀各不相同,其電泳速度就不同,故可將血清中蛋白質進行區分[2]。血清蛋白電泳通常用于檢測異常增生的單克隆免疫球蛋白(M蛋白,也稱為M-帶)以診斷和監測骨髓瘤[3-5],但還有其他一些用途往往被忽略[6]。血清蛋白電泳對于肝病、嚴重感染性疾病及慢性腎臟病等的診斷、鑒別診斷、病情發展的判斷有重要的意義[7]。發生肝炎時,γ帶所占比例明顯增加,肝硬化時出現“β-γ橋”現象;腎病綜合征時α2區帶所占比例明顯增加[8]。國外有許多學者對血清蛋白電泳進行研究,有研究對第1代自動化毛細管電泳儀進行評估,發現其靈敏度、重復性都優于瓊脂糖凝膠電泳,易于操作,適用于日常工作量較大的臨床實驗室,但由于檢測M蛋白的特異度較低,可能會導致免疫固定分析的成本增加[9]。21世紀,Helena V8與Sebia Capillarys 2 Flex Piercing (C2)被廣泛應用于各家實驗室[10]。第2代電泳儀檢測速度較快,靈敏度較高(可檢測>0.3 g/dL M蛋白),但特異度低于瓊脂糖凝膠電泳,檢測總蛋白水平低或低球蛋白血癥患者的標本常出現假陽性。本研究對Sebia新一代毛細管電泳儀Sebia Capillarys 3 TERA(C3)進行了血清蛋白電泳的性能驗證。
1 材料與方法
1.1儀器與試劑 檢測儀器采用法國Sebia公司的Capillarys 3 TERA,試劑采用Sebia CAPI 3s Protein(E)6,試劑批號為PN2503,試劑盒包含700 mL緩沖液3瓶,濾器4個。
1.2檢測性能評價
1.2.1精密度驗證 根據國家食品藥品監督管理局(SFDA)有關毛細管電泳儀醫療器械注冊產品標準,用同一批號試劑對Sebia公司提供的正常水平范圍內定值血清蛋白質控品(LOT:27047/01)重復檢測24次,計算批內標準差(s)及變異系數(CV);對任選的一個批號(LOT:27047/01)質控品連續測試20 d,每天檢測1批次,檢測12根毛細管的批間s及CV。
1.2.2正確度驗證 選用國家衛生健康委員會臨床檢驗中心2020年血清蛋白電泳室間質量評價樣品(標本編號202011、202012、202013、202014、202015),每個水平樣品至少每天重復測定2次,連續測定5 d,記錄檢測結果,計算全部檢測結果均值,判斷各項指標均在給定的范圍內。
1.2.3靈敏度驗證 選擇M蛋白水平500 mg/dL的血清標本,采用生理鹽水按梯度倍比稀釋,直到血清標本中的M蛋白峰不可分辨為止,記錄各梯度對應的稀釋倍數和血清標本水平,判斷M蛋白峰不可分辨前,最大稀釋倍數對應的血清標本水平是否小于或等于27 mg/dL。
1.2.4參考區間驗證 選取隨機體檢標本24份進行血清蛋白電泳,剔除離群值,判斷是否均在預設參考區間之內。
1.2.5線性范圍驗證 根據美國臨床和實驗室標準協會(CLSI)EP6-A操作指南,使用溶液(A)清蛋白(Alb)溶液(52.0 g/L)和溶液(B)γ球蛋白溶液(31.0 g/L),按不同比例混合(100% A溶液+0% B溶液,90% A溶液+10% B溶液等......0% A溶液+100% B溶液)得到共11份不同水平的Alb和γ球蛋白混合物,每份混合物檢測Alb百分比3次,取均值,判斷理論值與實測值的線性。
1.2.6交叉污染驗證 將樣品與蒸餾水共24份標本交替安放在試管架上,計算平均值、最大誤差及相對誤差,若最大相對誤差≤ 5.2%,則交叉污染驗證通過。
1.2.7儀器性能評價 計算實驗室電泳崗位每日檢測標本量、花費人力數量、毛細管電泳儀數量、轉移標本的時間及頻次,評估優化血清蛋白電泳檢測流程。同時檢測80份標本,比較C3與C2的檢測速率與檢測時間。
由于C2每份標本需要人力推送(1 s),而本實驗室有4臺毛細管電泳儀,從第1臺走到第2臺用時1 s,到第3臺用時1.5 s,到第4臺用時2 s。每天需要檢測3 000份標本,共計375架。每臺儀器滿負荷8架。每30分鐘共檢測約160份標本。
由于新儀器沒有上述問題。去除標本插在架子上的時間,最后測算C3比C2節約多少時間。

2 結 果
2.1精密度驗證 C3進行血清蛋白電泳的批內CV:Alb區帶<2%,α1球蛋白(α1)、α2球蛋白(α2)、β1球蛋白(β1)、β2球蛋白(β2)、γ球蛋白(γ)區帶<10%;批間CV:Alb區帶<2%,α1、α2、β1、β2、γ區帶<10%,均小于廠家提供的CV。見表1。
2.2正確度驗證 正確度驗證結果見表2,各項指標均符合要求,正確度驗證合格。
2.3靈敏度驗證 血清蛋白電泳可見M蛋白尖峰的最大稀釋倍數為16倍,相應標本水平為16 mg/dL,最終患者標本水平≤27 mg/dL且仍能明顯觀察到單克隆跡象,符合要求。
2.4參考區間驗證 24份體檢標本,剔除離群值后,檢測標本均在預設參考區間之內,符合參考區間驗證要求。

表1 C3血清蛋白電泳的重復性、中間精密度驗證結果

表2 正確度驗證結果(%)
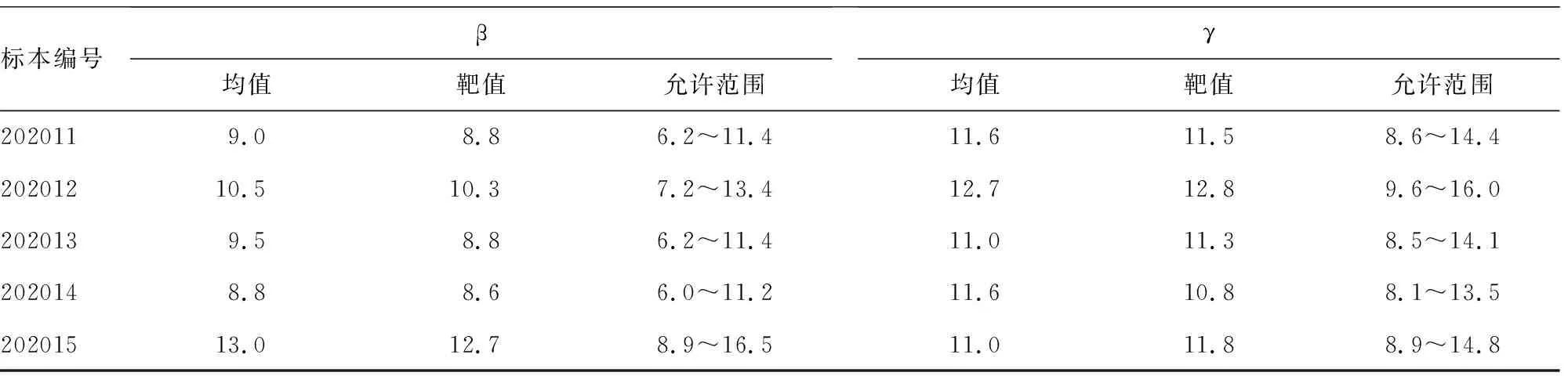
標本編號β均值靶值允許范圍γ均值靶值允許范圍2020119.08.86.2~11.411.611.58.6~14.420201210.510.37.2~13.412.712.89.6~16.02020139.58.86.2~11.411.011.38.5~14.12020148.88.66.0~11.211.610.88.1~13.520201513.012.78.9~16.511.011.88.9~14.8
2.5線性范圍驗證 從混合物中得到的每個區帶百分比與理論上每個區帶百分比完全符合,且使用CAPI 3 PROTEIN6程序可以根據線性檢測到任何變化,相關系數(r)=0.999 0,斜率為0.999 9,截距為-0.317 9。見表3。
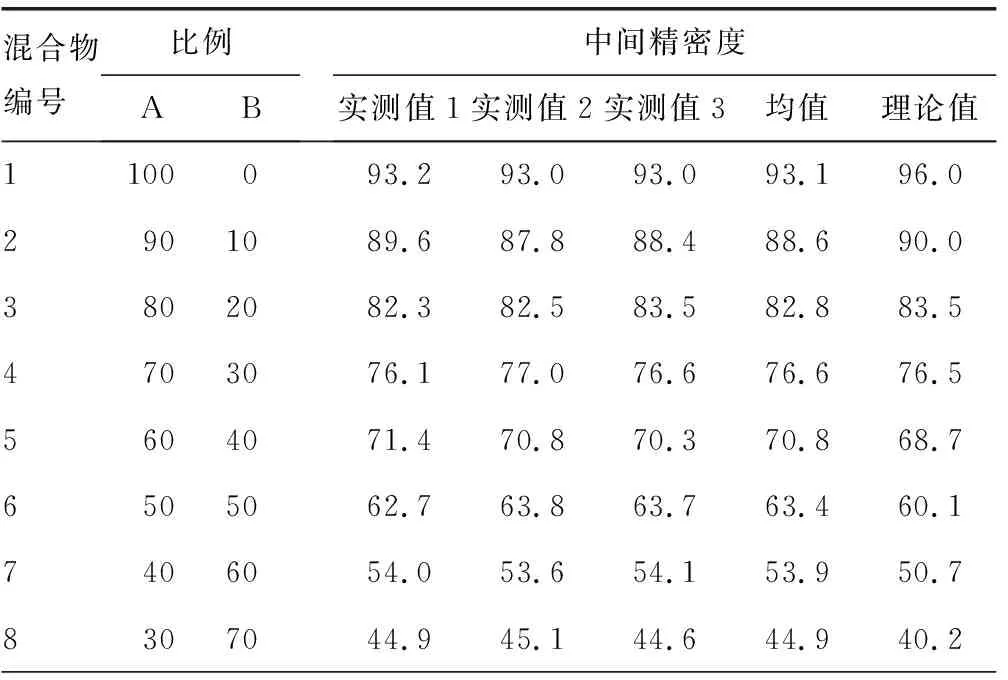
表3 線性范圍驗證結果(%)
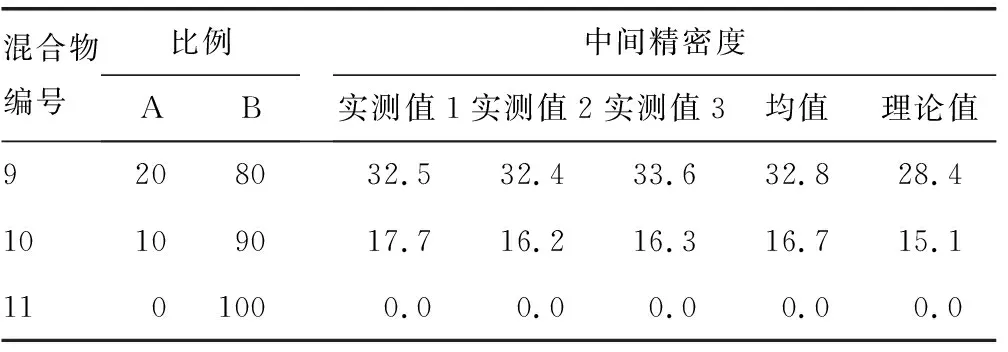
續表3 線性范圍驗證結果(%)
2.6交叉污染驗證 樣品結果最大相對誤差≤5.2%,無交叉污染,見表4。
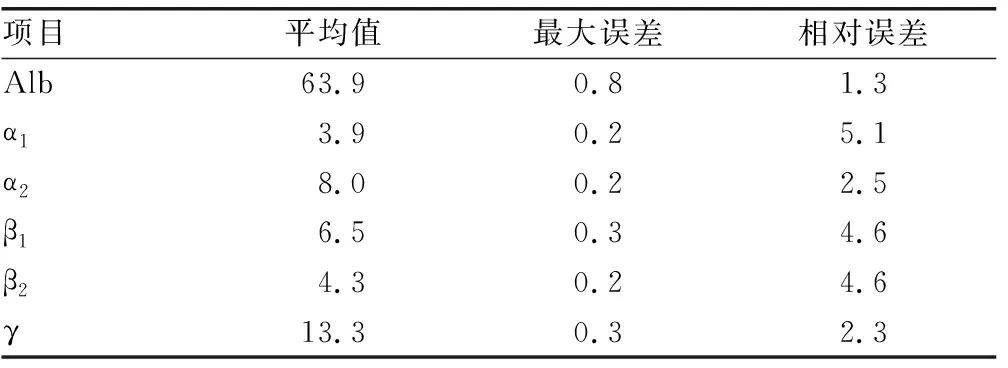
表4 交叉污染驗證試驗結果(%)
2.7儀器性能評價 檢測流程變化結果見表5。C3的檢測速率約為每臺72份/h,C2的檢測速率約為每臺64份/h;同時檢測80份血清標本,C3 TERA用時58 min 57 s,C2用時59 min 45 s;前7架血清標本檢測速率:C2>C3,前10架血清標本檢測速率:C2 表5 C3與C2檢測效率比較 表6 C3與C2血清蛋白電泳檢測時間比較 毛細管電泳是一種非常適用于臨床分離蛋白質的技術。與臨床常用的色譜方法相比,主要優點是分離效率更高,所需的樣品體積更小。毛細管電泳的臨床應用廣泛,LATOSINSKA等[11]在研究毛細管電泳時發現,其與質譜技術聯合檢測對于泌尿系統疾病的診斷具有較高的靈敏度。多篇文獻報道,血清蛋白電泳的使用有助于常見疾病的篩查[12-13]。因此,由于檢測靈敏度較高,毛細管電泳儀在國內外實驗室的日常檢測中變得更加重要。 目前,CLSI沒有明確應用于毛細管血清蛋白電泳的性能驗證方案,國內外也鮮有對于毛細管血清蛋白電泳的性能評價。劉素蘭等[14]曾對Sebia電泳儀及其配套試劑測定血清蛋白進行方法學評價,發現用毛細管電泳儀進行血清蛋白電泳操作簡便、圖譜清晰、分辨率高、重復性好、結果準確。本研究對C3血清蛋白電泳進行性能評價,結果顯示,C3檢測血清蛋白電泳具有良好的精密度、正確度、靈敏度、參考區間、線性范圍,無交叉污染,檢測性能符合臨床要求,對于異常增生的M蛋白的檢測靈敏度更高,最低檢測水平< 27 mg/dL。 與C2相比,C3的檢測優勢主要體現在大批量血清標本的檢測速度更快(每批次檢測12份血清標本,每臺1 h可檢測約72份血清標本),檢測自動化程度更高,檢測結果更準確。由于C2每份標本需要人力推送(1 s),而本實驗室有4臺毛細管電泳儀,從第1臺走到第2臺用時1 s,到第3臺用時1.5 s,到第4臺用時2 s,而C3具備靈活組合的聯機與自動進樣裝置,一臺進樣器可配備多臺電泳儀器,因此僅需將標本放置于進樣裝置上即可,有效降低了人力成本。由于C3檢測大批量標本時檢測速度較快,可減少相應檢測人力與標本轉運頻次,檢測人員可在相同時間內檢測更多標本。除此以外,與舊系統相比,C3軟件的更新使操作人員一次性能瀏覽更多標本,C3檢測系統更高的靈敏度及特異度使分析假陽性率降低,分析疑難標本更準確。C3故障發生率低于C2。對于每日需要檢測大批量標本的實驗室,C3能發揮最大的優勢,功能方面優化了開機、關機、維護保養等功能,可以設定自動開關機,自動定時保養等功能。 本研究不同于以往毛細管血清蛋白電泳性能評價的一點是全部性能驗證項目的檢測都針對同一根毛細管,因此實驗結果更可靠。但本研究由于未引入多臺C3電泳儀,只能對一臺單機配一臺進樣器的電泳流水線進行檢測速度的評價,后續會在此基礎上對兩聯機配一臺進樣器、三聯機配一臺進樣器的電泳流水線進行性能評估。

3 討 論

