多模態超聲特征與乳腺癌YEATS4、SOX12表達狀態的相關性研究
楊興益, 董瑞生, 郭浩
乳腺癌是最常見的女性惡性腫瘤,在我國的發病率逐年上升,對患者的身體健康和生命質量造成了嚴重的威脅[1]。近年來,隨著分子生物學研究的迅猛發展,研究者們報道了許多與乳腺癌病理、預后相關的分子標志物[2,3]。這些分子標志物有助于乳腺癌的早期診斷及治療方案的選擇,從而對改善患者預后具有重要意義[4]。最近研究表明,YEATS域含蛋白質4(YEATS domain-containing protein 4,YEATS4)和SOX(SRY box-containing)基因家族的轉錄因子SOX12在乳腺癌組織中的表達顯著高于癌旁正常組織,并且在乳腺癌的疾病進展和轉移中發揮重要作用,是乳腺癌的的潛在治療靶點和預后生物標志物,YEATS4和SOX12的陽性表達可預示乳腺癌預后不良[5,6]。因此,YEATS4和SOX12不僅可以反映乳腺癌的生物學行為,對患者預后的評價和治療方案的選擇也具有重要指導意義。然而,目前檢測這些分子標志物,均需獲取活體組織標本,結合病理診斷結果才能完成,因此都是有創性的。常規超聲、剪切波彈性成像(shear wave elastography,SWE)和超聲造影(contrast-enhanced ultrasonography,CEUS)作為常用的乳腺病變檢測方式,在乳腺病變的診斷和化療效果的評價中已被患者和臨床醫生廣泛接受和認可[7-10]。然而,目前還未有研究探討乳腺癌常規超聲、SWE、CEUS特征與YEATS4、SOX12表達狀態的相關性。因此,本研究旨在通過比較乳腺癌不同YEATS4和SOX12表達狀態的多模態超聲征象,分析兩者的相關性,以期為乳腺癌治療方案的選擇及術前無創性評估患者預后提供影像學新思路。
材料與方法
1.研究對象
納入2018年1月-2020年12月于山西醫科大學附屬汾陽醫院就診并行手術治療的乳腺癌女性患者作為研究對象,手術時取患者的乳腺癌組織和癌旁正常組織(距離癌組織≥5 cm),所取組織離體后立即置入-196℃液氮中保存待用。病例納入標準:①年齡18~70周歲,單側單發病灶;②術前行常規超聲、SWE和CEUS檢查;③術前未進行過放、化療或其他治療;④術后經病理學確診為乳腺癌。病例排除標準:①復發、多灶或雙側乳腺病灶;②臨床病理或影像學資料不完整。最終共納入210例乳腺癌患者(210個病灶),包括165例浸潤性導管癌、19例導管內原位癌、18例黏液腺癌、5例髓樣癌、2例惡性葉狀腫瘤和1例多形性癌。患者年齡范圍21~70周歲,平均(53.65±7.16)歲。本研究取得了醫院倫理委員會的支持,所有患者均自愿參加并簽署了書面知情同意書。
2.研究方法
檢查儀器和方法:超聲檢查儀器為邁瑞resona7型超聲診斷儀,使用L15-4線陣探頭進行常規超聲及SWE檢查,頻率為4~15 MHz;CEUS檢查使用L14-5線陣探頭,頻率2~10 MHz。常規超聲觀察指標包括腫塊直徑、腫塊形態、腫塊邊界、有無微小鈣化、Alder血流分級及有無腋窩淋巴結。常規超聲檢查完成后切換至SWE模式,當發現病灶周圍高彈性模量的“硬環征”或病灶中心彈性模量缺失的“黑洞征”時,進行記錄。然后更換探頭,調至造影模式,選擇病灶區與周圍正常乳腺組織為感興趣區,觀察病灶增強強度、灌注缺損、增強方式、消退方式、增強邊界、有無周圍放射狀增強等并進行記錄。
YEATS4和SOX12的表達狀態檢測及判斷:采用免疫組織化學法檢測乳腺癌組織和癌旁組織中的YEATS4和SOX12表達水平。兩位病理醫師在對臨床數據不知情的情況下,采用雙盲法對結果進行評估,當結果產生分歧時,和第3位主任醫師商討后確定最終結果。YEATS4主要定位于細胞核,染色強度計分:無染色為0分,淡黃色為1分,黃色為2分,棕黃色為3分;陽性細胞百分比計分:0分為<10%,1分為10%~25%,2分為26%~50%,3分為>50%。取染色強度評分與陽性評分的乘積作為染色指數,染色指數≥3為陽性表達,≤3為陰性表達。陽性細胞呈棕黃色,無陽性細胞為0級,1%~5%為1級,5%~10%為2級,>10%為3級,0級為陰性表達,1、2、3級均為陽性表達[5]。SOX12定位于細胞膜和/或細胞質,染色強度計分:0分為無染色,1分為弱染色強度,2分為中等染色強度,3分為強染色強度。陽性細胞百分比計分:0分為<5%,1分為5%~25%,2分為26%~50%,3分為51%~75%,4分為>75%。取染色強度評分與陽性評分的乘積作為最終評分,得分0~5分為陰性表達,6~12分為陽性表達[6]。
3.統計學分析
采用SPSS 22.0軟件進行統計學分析。計量資料以均數±標準差表示,組間比較采用t檢驗;計數資料以頻數和百分比表示,組間比較采用χ2檢驗。采用二元Logistic回歸進行多因素分析。以P<0.05為差異有統計學意義。
結 果
1.YEATS4、SOX12表達狀態在乳腺癌組織與癌旁正常組織中的比較
對于YEATS4,在210例乳腺癌組織中120例(57.14%)YEATS4陽性表達,90例(42.86%)陰性表達;在癌旁組織中,42例(20.00%)YEATS4陽性表達,148例(80.00%)陰性表達,兩組YEATS4表達狀態比較差異有統計學意義(χ2=50.817,P<0.001)。對于SOX12,在乳腺癌組織中128例(60.95%)SOX12陽性表達,82例(39.05%)陰性表達;在癌旁組織中,54例(25.71%)SOX12陽性表達,156例(74.29%)陰性表達,兩組SOX12表達狀態比較差異具有統計學意義(χ2=53.096,P<0.001,表1)。
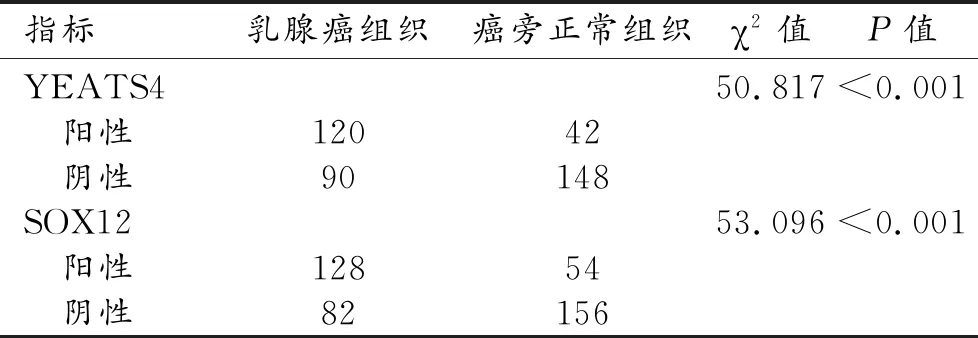
表1 兩組織的YEATS4、SOX12表達狀態比較 (例)
2.乳腺癌YEATS4、SOX12不同表達狀態的常規超聲特征比較
常規超聲特征中的腫塊形態、腫塊邊界和有無微小鈣化與乳腺癌YEATS4的表達狀態有關,YEATS4陽性者中出現腫塊形態不規則、腫塊邊界模糊和微小鈣化的患者比例顯著高于YEATS4陰性患者(P值均<0.05,表2、圖1)。腫塊形態、有無微小鈣化和Alder血流分級與SOX12的表達狀態有關,SOX12陽性者中出現腫塊形態不規則、微小鈣化和2~3級血流分級的患者比例顯著高于SOX12陰性患者(P值均<0.05,表3、圖2)。
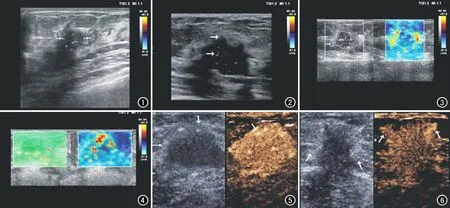
圖1 乳腺癌患者,女,52歲,YEATS4表達陽性,常規超聲表現為腫塊邊緣不規則,邊界模糊,伴微小鈣化。圖2 乳腺癌患者,女,57歲,SOX12表達陽性,常規超聲表現為腫塊邊緣不規則伴微小鈣化。 圖3 乳腺癌患者,女,61歲,YEATS4和SOX12均表達陽性,SWE征象表現為硬環征。 圖4 乳腺癌患者,女,58歲,YEATS4表達陽性,SWE征象表現為黑洞征。 圖5 乳腺癌患者,女,60歲,YEATS4表達陽性,CEUS征象表現為高增強。 圖6 乳腺癌患者,女,69歲,SOX12表達陽性,CEUS征象表現為周圍放射狀增強。
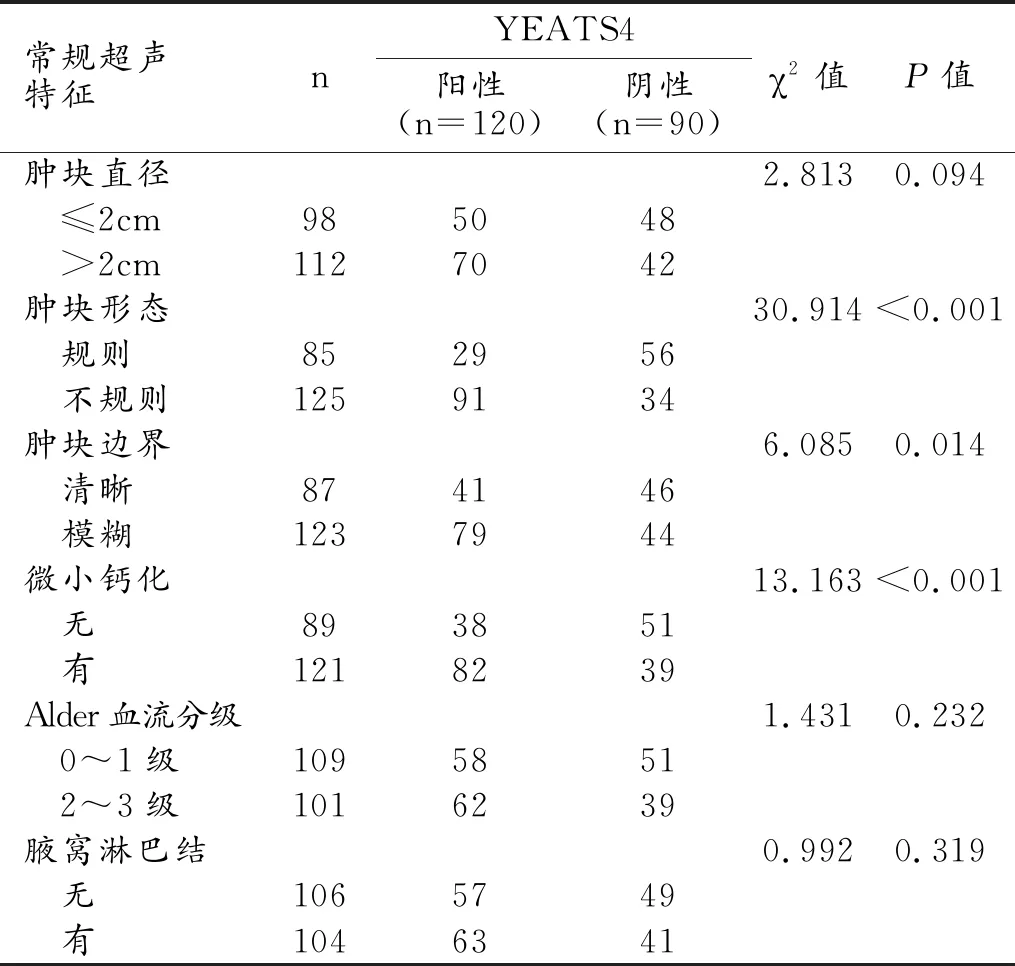
表2 乳腺癌YEATS4不同表達狀態的常規超聲特征比較 (例)
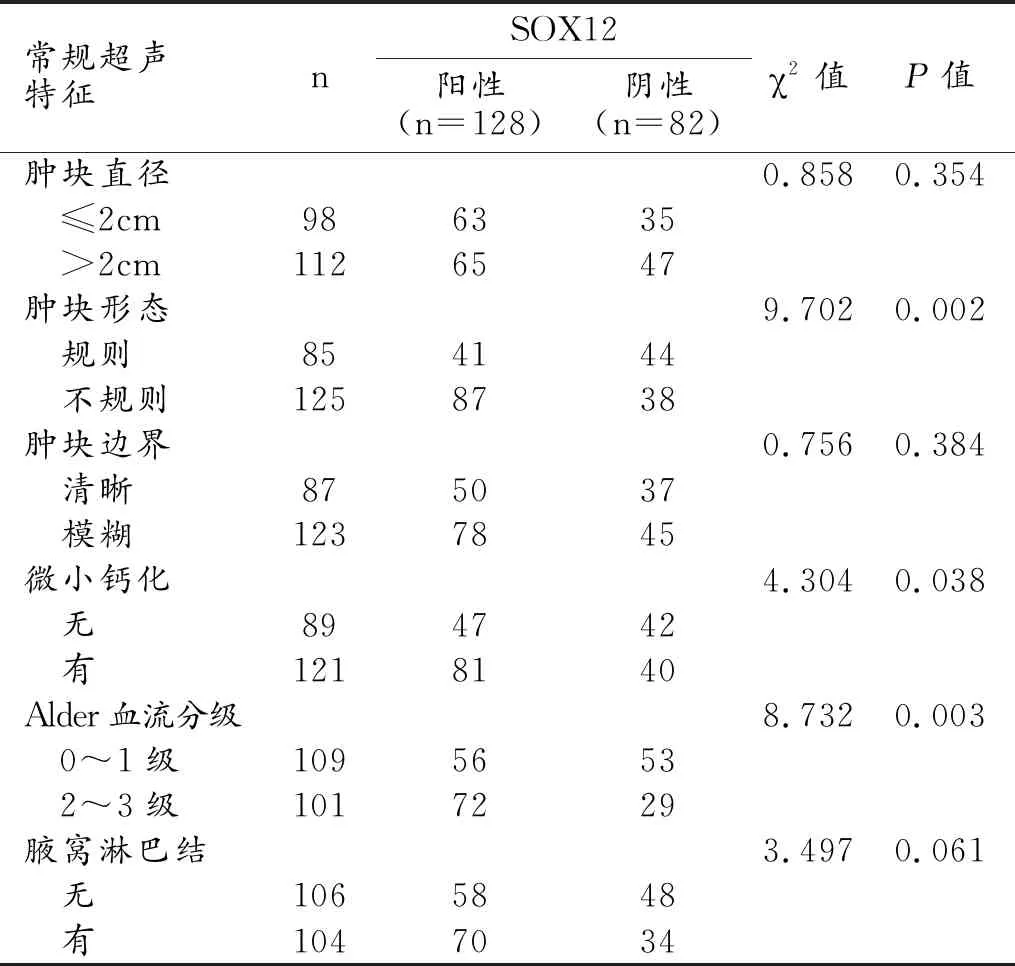
表3 乳腺癌SOX12不同表達狀態的常規超聲特征比較 (例)
3.乳腺癌YEATS4、SOX12不同表達狀態的SWE征象比較
YEATS4陽性乳腺癌患者出現硬環征和黑洞征的比例均顯著高于YEATS4陰性者(P值均<0.05);SOX12陽性者中出現硬環征的患者比例顯著高于SOX12陰性患者(χ2=20.430,P<0.001),而黑洞征在兩組中的比例差異無統計學意義(χ2=1.791,P=0.181,表4、圖3~4)。
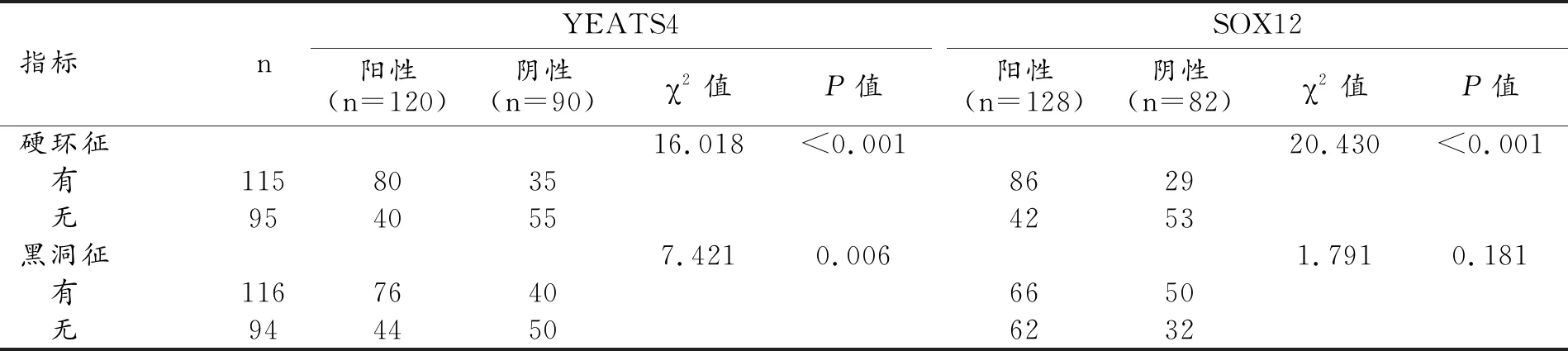
表4 乳腺癌YEATS4、SOX12不同表達狀態的SWE征象比較 (例)
4.乳腺癌YEATS4、SOX12不同表達狀態的CEUS特征比較
CEUS特征中的增強程度和有無灌注缺損與乳腺癌YEATS4表達狀態有關,YEATS4陽性者中出現高增強、灌注缺損的患者比例顯著高于YEATS4陰性患者(P值均<0.05,表5、圖5)。增強程度和有無周圍放射狀增強與SOX12的表達狀態有關,SOX12陽性者中出現高增強和周圍放射狀增強的患者比例顯著高于SOX12陰性患者(P值均<0.05,表6、圖6)。
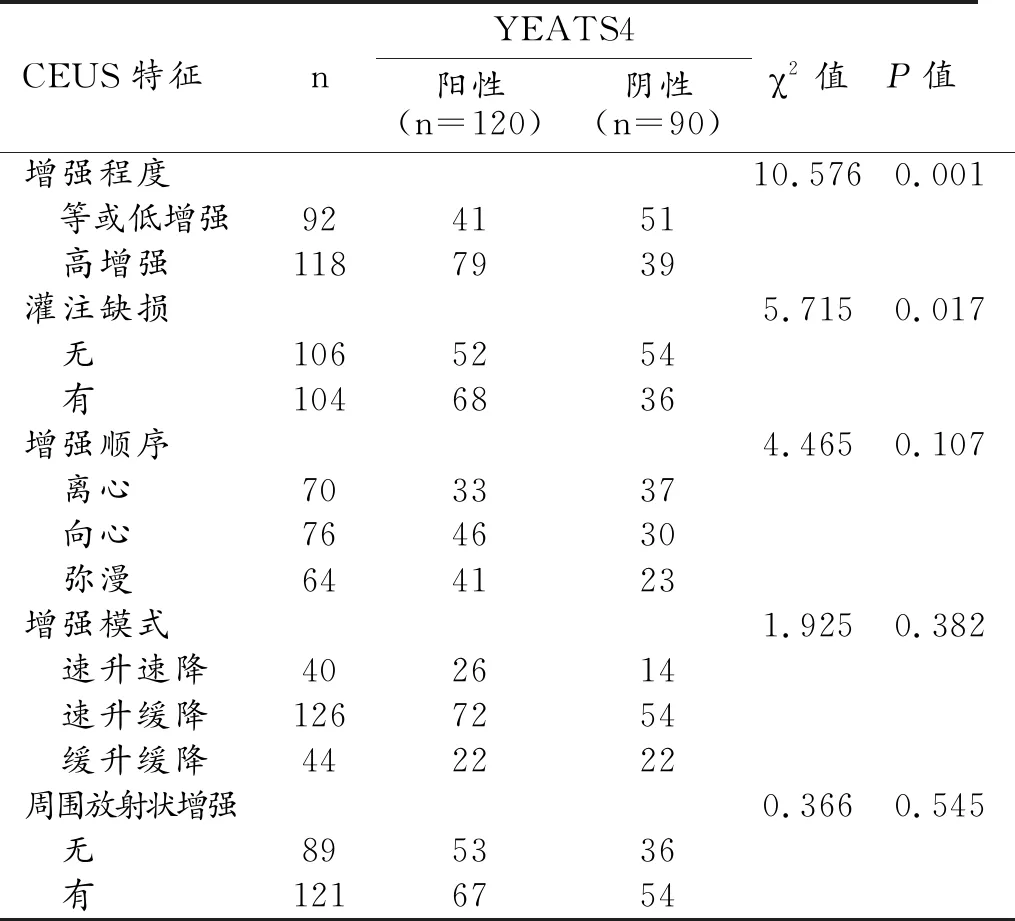
表5 乳腺癌YEATS4不同表達狀態的CEUS特征比較 (例)
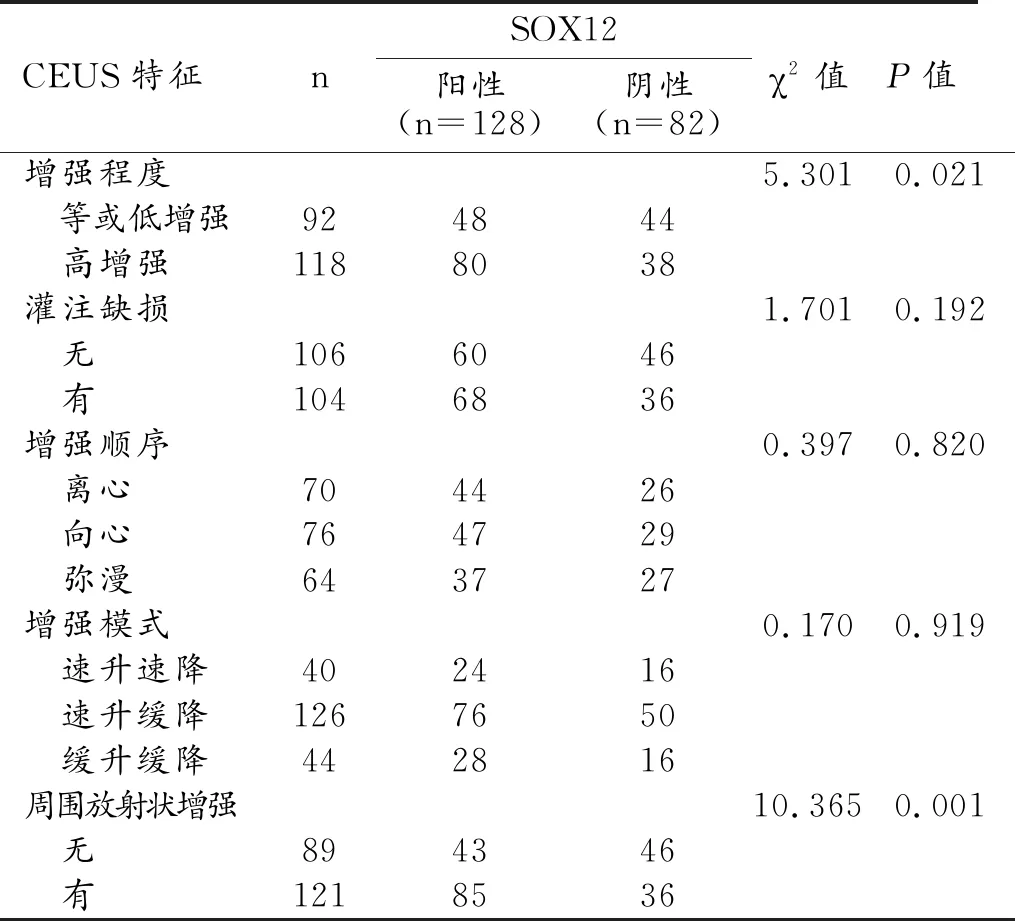
表6 乳腺癌SOX12不同表達狀態的CEUS特征比較 (例)
5.乳腺癌YEATS4、SOX12表達狀態與多模態超聲特征的多因素Logistic分析
對乳腺癌常規超聲特征、SWE特征和CUES特征進行賦值,結果見表7。分別以YEATS4、SOX12表達狀態為因變量(陰性=0;陽性=1),將各自單因素分析結果中有統計學意義的變量作為自變量進行多因素Logistic分析。結果表明,腫塊形態不規則、伴微小鈣化、出現硬環征及CEUS表現為高增強是YEATS4陽性表達的獨立危險因素(P值均<0.05);腫塊形態不規則、出現硬環征、CEUS表現為周圍放射狀增強是SOX12陽性表達的獨立危險因素(P值均<0.05,表8)。

表7 多模態超聲特征變量賦值
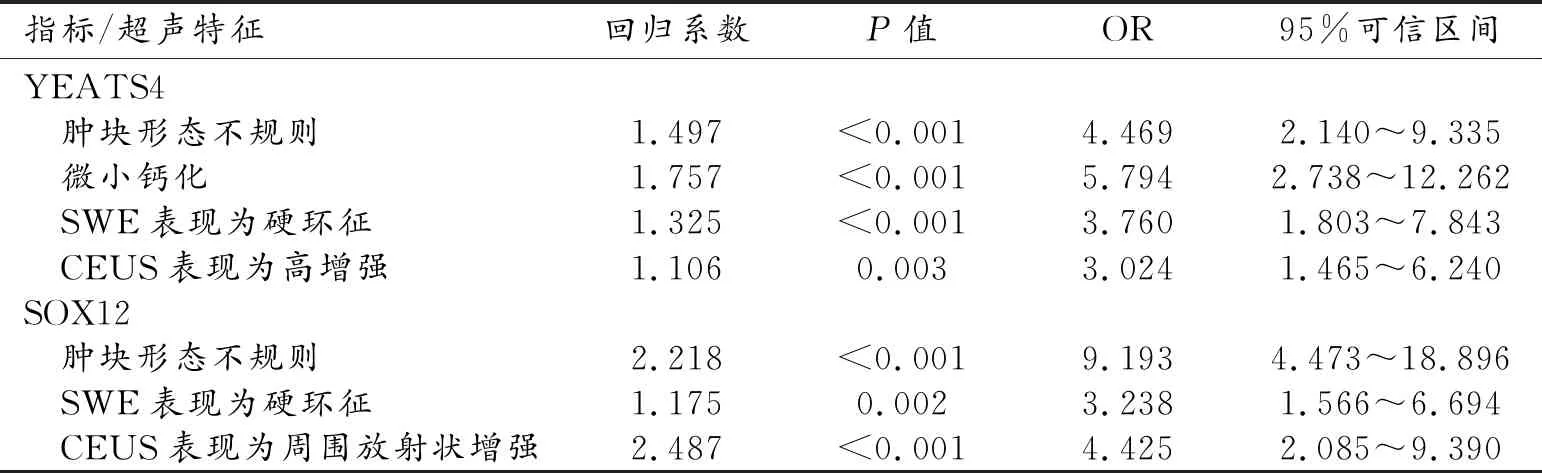
表8 多模態超聲特征與YEATS4、SOX12表達水平的二元Logistic分析
討 論
乳腺癌是女性發病率居首位的腫瘤。近年來,雖然我國醫療衛生事業取得了一定的進步與發展,使乳腺癌患者的生存率大幅度提高,但部分患者的預后仍較差,生命健康和生活質量受到嚴重威脅[4]。因此,尋找敏感的病理及預后分子標志物對探索乳腺癌的發病機制、制定合適的治療方案及改善患者預后具有重要意義。YEATS4是YEATS家族結構域蛋白家族成員,作為一種轉錄調控因子,可通過與一般轉錄因子TFIIF相互作用,從而調控RNA的轉錄過程[11]。相關研究表明,YEATS4在結直腸癌、胰腺癌和乳腺癌等多種腫瘤中表達上調,并與癌細胞的侵襲和轉移有關[5,11]。Li等[5]的研究表明,YEATS4在乳腺癌中表達顯著上升,并且在疾病進展和遠處轉移中發揮重要作用,可作為乳腺癌潛在的治療靶點和預后生物標志物。SOX12可調控多種細胞的增殖、分化,已被證明與肺腺癌、乳腺癌等腫瘤的疾病進展和預后密切相關[6]。李利等[12]在研究中分析了2437個肺癌樣本,結果顯示SOX12高表達患者的總生存期較低,預后較差。Xu等[6]的研究表明,SOX12表達的陽性率隨著乳腺癌的進展程度而逐漸增加,并且與疾病的遠處轉移和不良預后有關。本研究結果也顯示,YEATS4和SOX12在乳腺癌組織中的陽性表達率均顯著高于癌旁正常組織。因此,YEATS4和SOX12均可作為乳腺癌預后相關的分子標志物,在術前通過常規超聲、SWE和CEUS這些無創性檢查方式預測其在乳腺癌中的表達狀態,對疾病的臨床診治和預后改善具有一定參考價值。
目前,在乳腺病變檢查中,超聲是應用最廣泛的一種檢查方式,可準確判斷腫塊的部位、大小和性質。SWE能通過實時獲取局部組織的定性表現來直觀反映病變組織的空間分布[13],對鑒別診斷乳腺良惡性病變具有重要意義[14]。CEUS通過造影劑微氣泡而增強病灶與周圍組織對比度,在腫瘤微小血管分布、血管形態及血流灌注特點的深入觀察和評估等方面具有重要價值[15]。本研究結果顯示,腫塊形態不規則、伴微小鈣化、出現硬環征及CEUS表現為高增強是YEATS4陽性表達的獨立危險因素;腫塊形態不規則、出現硬環征、CEUS表現為周圍放射狀增強是SOX12陽性表達的獨立危險因素。相關研究表明,腫瘤邊緣區域超聲特征更能反映腫瘤生物學行為,腫塊形狀不規則的乳腺癌更有可能呈“侵襲性”生長,浸潤周圍組織,并且產生炎性反應[15]。微小鈣化是由于癌細胞生長過快,氧耗增加,但由于營養供應不足,從而發生變性溶解而引起鈣鹽沉積。相關研究表明,微小鈣化的發生率與腫瘤的惡性程度呈正相關,而惡性程度高的腫瘤往往預后也較差[16]。SWE征象中的硬環征與YEATS4、SOX12高表達有關。所謂“硬環征”,即與病灶內部及周圍組織相比,病灶邊界區域出現的呈環狀分布的局部硬度增高區,有學者認為這可能是病灶周圍形成促結締組織增生反應帶,也可能與腫瘤細胞向周圍組織間隙擴散有關[17]。相關研究表明,“硬環征”對乳腺癌的惡性病灶具有預測價值,在一定程度上提示疾病的預后較差[17]。CEUS特征中的高增強和周圍放射狀增強與預后分子標志物的表達狀態有關,乳腺癌是一種血管依賴性病變,新生血管由于缺乏肌層,管壁較薄且走形扭曲,容易形成動靜脈瘺,這可能會導致乳腺癌CEUS表現為高增強[16]。腫塊周圍放射狀增強體現了乳腺癌向周圍浸潤性生長的特征,相較于中央區,腫瘤邊緣區域血管更加密集,粗大迂曲的血管相互融合成片狀、胚竇狀,為腫瘤細胞沿導管浸潤性生長提供了營養環境[15]。因此,腫塊形態不規則、伴微小鈣化、出現硬環征及CEUS表現為高增強和周圍放射狀增強可能與預后分子標志物的表達狀態具有一定相關性。
綜上所述,乳腺癌多模態超聲特征可用于預測YEATS4、SOX12的表達狀態,從而有助于治療方案的選擇及術前無創性評估患者預后。

