DC-CIK聯(lián)合化療對結(jié)直腸癌根治術(shù)后肝轉(zhuǎn)移患者療效及對TRF1和TRF2表達(dá)的影響
樸龍鎮(zhèn),金蘭,李滕,胡烏云,梁雪
結(jié)直腸癌是臨床最常見的惡性腫瘤,具有較高的發(fā)病率和病死率,并呈逐年增長趨勢,已成為威脅人類健康的殺手之一[1-2]。結(jié)直腸癌根治術(shù)是臨床上重要治療手段之一,一般患者預(yù)后較好,但約50%患者會發(fā)生術(shù)后轉(zhuǎn)移,其遠(yuǎn)處轉(zhuǎn)移最常見部位為肝臟,若不采取有效治療,其5年生存率不足10%,因此提高其生存率,控制肝轉(zhuǎn)移是臨床的重大挑戰(zhàn)[3-4]。端粒功能失調(diào)是引發(fā)癌癥的重要分子機制之一,端粒長度與結(jié)構(gòu)的改變在直腸癌根治術(shù)后肝轉(zhuǎn)移發(fā)生發(fā)展過程中具有重要作用[5]。端粒重復(fù)序列結(jié)合因子1(TRF1)和TRF2對維持端粒的結(jié)構(gòu)及實現(xiàn)其功能具有重要意義[6]。樹突狀細(xì)胞—細(xì)胞因子誘導(dǎo)的殺傷細(xì)胞(DC-CIK)免疫技術(shù)是一種細(xì)胞生物免疫治療方法,是一種新抗腫瘤模式,目前已成為應(yīng)用最為廣泛的生物治療手段之一[7]。現(xiàn)對結(jié)直腸癌根治術(shù)后肝轉(zhuǎn)移患者給予DC-CIK聯(lián)合化療,觀察其療效及對TRF1和TRF2表達(dá)的影響,報道如下。
1 資料與方法
1.1 臨床資料 選取2014年1月—2015年3月延邊大學(xué)附屬醫(yī)院腫瘤科收治晚期結(jié)直腸癌伴肝轉(zhuǎn)移患者98例,按隨機數(shù)字表法分為對照組(49例)和觀察組(49例),2組患者性別、年齡、BMI、腫瘤原發(fā)部位、肝轉(zhuǎn)移灶大小、數(shù)目比較差異無統(tǒng)計學(xué)意義(P>0.05),具有可比性,見表1。本研究經(jīng)醫(yī)院倫理委員會審核批準(zhǔn),患者及家屬知情同意并簽署知情同意書。
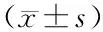
表1 2組患者臨床資料比較
1.2 病例選擇標(biāo)準(zhǔn) (1)納入標(biāo)準(zhǔn):①符合結(jié)直腸癌的診斷標(biāo)準(zhǔn)[8];②患者均發(fā)生肝轉(zhuǎn)移;③生存期>8周,均為單側(cè)病灶。(2)排除標(biāo)準(zhǔn):①伴有精神類疾病者;②拒絕配合,依從性極低者。
1.3 治療方法 對照組患者采用XELOX方案(奧沙利鉑+卡培他濱)化療:奧沙利鉑(江蘇恒瑞醫(yī)藥股份有限公司生產(chǎn))130 mg/m2,d 1;卡培他濱(江蘇恒瑞醫(yī)藥股份有限公司生產(chǎn))1 g·m-2·d-1,2次/d,d 1~21,21 d為1個周期。觀察組在對照組基礎(chǔ)上,第2次靜脈化療結(jié)束后第7天連續(xù)3 d采用靜脈回輸自體DC-CIK細(xì)胞,每次輸注>3×109個DC-CIK細(xì)胞,每療程輸注細(xì)胞總數(shù)>1×1010個。回輸完畢后,再次使用生理鹽水沖管,確保細(xì)胞回輸數(shù)量。
1.4 觀測指標(biāo)與方法
1.4.1 CD3+、CD4+、CD8+T細(xì)胞測定:治療前后,采集患者空腹肘靜脈血3~5 ml,分離提取血清,采用流式細(xì)胞儀(美國BD公司生產(chǎn))測定CD3+、CD4+、CD8+T細(xì)胞。
1.4.2 肝臟TRF1和TRF2表達(dá)檢測:治療前及治療后1個月,穿刺患者肝臟活檢,采用免疫組化染色法檢測肝臟TRF1和TRF2表達(dá)水平,相關(guān)試劑由美國Novus Biologicals公司提供。顯微鏡下細(xì)胞呈棕黃色則判斷為陽性。隨機抽取每張切片4個視野(400倍),計算陽性細(xì)胞所占百分比,并進(jìn)行百分比評分(PP):0分,無陽性細(xì)胞;1分,陽性細(xì)胞百分比<5%;2分,陽性細(xì)胞百分比5%~20%;3分,陽性細(xì)胞百分比>20%。對染色強度進(jìn)行評分(SI):0分,無染色;1分,淡黃色;2分,棕黃色;3分,棕褐色。最終計算出免疫反應(yīng)評分(IRS)=PP×SI[9],分值范圍0~9分,得分越高說明陽性表達(dá)強度越高。
1.4.3 生活質(zhì)量評分:治療后,采用QLQ-C30生活質(zhì)量評分標(biāo)準(zhǔn)(包括社會、情緒、認(rèn)知、角色、軀體及總健康狀況等6個功能性領(lǐng)域)對2組患者術(shù)后生活質(zhì)量進(jìn)行評價,將各項得分轉(zhuǎn)換為百分制,得分越高說明生活質(zhì)量越好[10]。
1.5 臨床療效評價 依據(jù)實體瘤療效評價標(biāo)準(zhǔn)[11],分為:完全緩解、部分緩解、疾病穩(wěn)定和疾病進(jìn)展,以完全緩解+部分緩解為客觀緩解率。
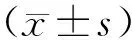
2 結(jié) 果
2.1 2組臨床療效比較 觀察組的客觀緩解率明顯高于對照組(67.35%vs.36.73%,χ2=13.848,P=0.003),見表2。

表2 2組患者臨床療效比較 [例(%)]
2.2 2組治療前后T淋巴細(xì)胞亞群水平比較 治療前2組各T細(xì)胞亞群水平比較差異均無統(tǒng)計學(xué)意義(P>0.05);與治療前相比,治療后,觀察組CD3+、CD4+、CD4+/CD8+水平升高,CD8+水平下降,且觀察組各指標(biāo)優(yōu)于對照組(P<0.01),見表3。
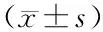
表3 2組患者治療前后T細(xì)胞亞群變化情況比較
2.3 2組治療前后肝臟TRF1和TRF2表達(dá)水平比較 治療前,2組TRF1和TRF2表達(dá)水平比較差異無統(tǒng)計學(xué)意義(P>0.05);治療后,觀察組肝臟TRF1表達(dá)水平高于治療前,且高于對照組,TRF2表達(dá)水平低于治療前,且低于對照組(P<0.01),見表4。
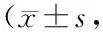
表4 2組患者治療前后肝臟TRF1和TRF2表達(dá)水平比較分)
2.4 2組生活質(zhì)量評分比較 治療后,觀察組生活質(zhì)量各項維度評分明顯高于對照組(P<0.01),見表5。
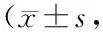
表5 2組患者治療后生活質(zhì)量情況比較分)
2.5 2組生存率比較 隨訪5年,應(yīng)用Kaplan-Meier對2組患者進(jìn)行生存率分析,觀察組患者生存率明顯高于對照組(χ2=4.513,P=0.023),見圖1。
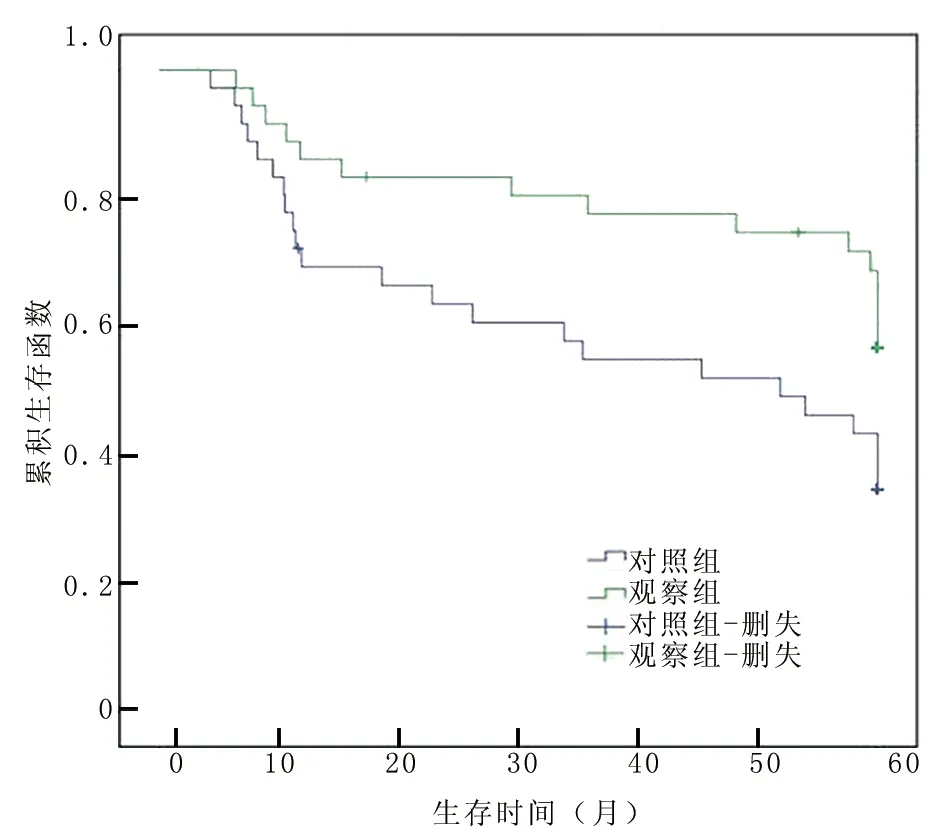
圖1 2組患者生存率分析
3 討 論
隨著我國居民生活習(xí)慣的改變及環(huán)境污染加重,結(jié)直腸癌的患病率不斷增長,其發(fā)病機制是多種因素協(xié)同作用所致,如消化道疾病(幽門螺桿菌感染、潰瘍性結(jié)直腸炎及克羅恩病)、生活習(xí)慣(肥胖、藥物、吸煙、飲酒及心理精神因素)、飲食(高脂、高蛋白飲食、微量元素攝入)及遺傳因素等[12-13]。手術(shù)治療是早期結(jié)直腸癌唯一可以治愈的手段,但25%~50%患者根治術(shù)后因肝轉(zhuǎn)移而復(fù)發(fā),其肝轉(zhuǎn)移的可能機制為根治術(shù)后,患者腹腔內(nèi)損傷的淋巴管和累積的殘留微小癌灶進(jìn)入血液或淋巴液中,從而造成癌細(xì)胞的遠(yuǎn)處轉(zhuǎn)移[14-16]。常規(guī)術(shù)后化療雖然可短時間內(nèi)抑制腫瘤的生長,但卻無法從根本上解決其轉(zhuǎn)移及擴散的問題,且化療毒副作用導(dǎo)致患者自身免疫力降低,進(jìn)而導(dǎo)致殘存的癌細(xì)胞迅速生長,加速病情的發(fā)展,因此如何預(yù)防、治療結(jié)直腸癌根治術(shù)后肝轉(zhuǎn)移成為臨床研究的熱點。
癌細(xì)胞缺少可激活T細(xì)胞的分子,不被T細(xì)胞識別,無法啟動主動免疫,因此導(dǎo)致結(jié)直腸癌在體內(nèi)發(fā)生轉(zhuǎn)移,CIK細(xì)胞可激活T細(xì)胞因子,完成主動免疫過程[17-18]。CIK具有超廣的殺瘤譜,對癌細(xì)胞的識別能力極強,可增強化療的敏感性,直接精準(zhǔn)的殺傷癌細(xì)胞,同時不會影響正常的組織與器官。DC是目前已知唯一能激活初始性T細(xì)胞的抗原遞呈細(xì)胞,其功能最強、最有效,與CIK協(xié)同作用,可解除部分結(jié)直腸癌患者術(shù)后T細(xì)胞的免疫無能,快速有效防止腫瘤局部復(fù)發(fā)和轉(zhuǎn)移,達(dá)到協(xié)同抗腫瘤作用。
結(jié)直腸癌根治術(shù)后肝轉(zhuǎn)移的發(fā)生與發(fā)展與免疫功能關(guān)系密切[19-20]。CD3+代表全部T淋巴細(xì)胞,CD4+對免疫起正調(diào)節(jié)作用;CD8+會破壞并殺傷感染細(xì)胞,對CD4+具有抑制作用,使免疫功能發(fā)生紊亂;CD4+/CD8+可反映機體的細(xì)胞免疫狀態(tài)[21]。本結(jié)果顯示,通過DC-CIK聯(lián)合化療,不僅可直接殺傷癌細(xì)胞,還能激活CD4+,同時抑制CD8+表達(dá),增強人體免疫能力,有效調(diào)動和增強機體自主的抗腫瘤免疫反應(yīng)。
端粒是存在于真核細(xì)胞內(nèi),用來穩(wěn)定細(xì)胞染色體功能的一種特殊帽狀結(jié)構(gòu),其長度與細(xì)胞癌變相關(guān)度高[22]。TRF1和TRF2是2種不同的端粒結(jié)合因子,兩者廣泛參與細(xì)胞核DNA復(fù)制及其損傷修復(fù)、維系端粒酶活性和調(diào)控端粒長度等生物學(xué)活動。TRF1蛋白可調(diào)節(jié)端粒長度,且這種調(diào)節(jié)為負(fù)性調(diào)節(jié),TRF1基因可能作為抑癌基因[23]。TRF2蛋白對端粒的長度具有正相性,TRF2基因則具有癌基因活性,可導(dǎo)致機體腫瘤易感性增加[24]。本結(jié)果顯示, DC-CIK聯(lián)合化療可將TRF1和TRF2作為潛在靶點,刺激TRF1表達(dá)增加,使細(xì)胞內(nèi)染色體端粒的長度縮短,進(jìn)而抑制乃至阻止癌細(xì)胞的增殖;同時下調(diào)TRF2表達(dá),阻斷其對端粒DNA閉環(huán)結(jié)構(gòu)的穩(wěn)定作用,進(jìn)而導(dǎo)致端粒的長度縮短,促進(jìn)癌細(xì)胞凋亡,從而有效防治結(jié)直腸癌根治術(shù)后伴肝轉(zhuǎn)移,提高患者的生存質(zhì)量,并延長其生存期。
綜上所述,DC-CIK對結(jié)直腸癌根治術(shù)后肝轉(zhuǎn)移具有較好的療效,可通過調(diào)節(jié)肝轉(zhuǎn)移病灶處TRF1與TRF2表達(dá)水平,抑制癌細(xì)胞生長,延長患者生存時間,值得臨床推廣應(yīng)用。
利益沖突:所有作者聲明無利益沖突
作者貢獻(xiàn)聲明
樸龍鎮(zhèn):設(shè)計研究方案,實施研究過程,論文撰寫;金蘭:圖表設(shè)計,整理資料;李滕、胡烏云:資料搜集整理,論文修改,查找文獻(xiàn)及參考書籍;梁雪:進(jìn)行統(tǒng)計學(xué)分析

