牙周炎患者Hp生長分布對口腔環(huán)境及牙周膜細胞成骨能力影響
鄧文革 張蕾 陳亞飛
(盤錦市中心醫(yī)院,(1.口腔修復科門診;(2.口腔治療科門診,遼寧 盤錦 124010;3.陳亞飛口腔診所口腔科,遼寧 盤錦 124010)
研究[1]發(fā)現(xiàn),口腔幽門螺栓菌(Hp)感染與牙周炎病程進展關系密切,牙周炎患者牙菌斑中的Hp檢出率普遍高于健康者。牙周膜干細胞(PDLSCs)是公認的有利細胞,具有增殖分化能力,但受到基質微環(huán)境的影響。成骨相關鈣化基因ALP、Runx-2表達,直接反映PDLSCs的成骨分化能力[2]。本文主要探討牙周炎患者Hp生長分布對口腔環(huán)境及牙周膜細胞成骨能力影響。
1 資料與方法
1.1一般資料 選取2015年1月至2017年12月我院收治的牙周炎患者120例作為觀察組,另選取30名同期于我院行口腔檢查證實為牙周健康者作為對照組。觀察組男68例、女52例,年齡15~45歲,平均(36.3±2.2)歲,按牙周炎程度分為輕度70例、中度27例、重度23例。對照組男18例、女12例,年齡14~46歲,平均(36.5±2.4)歲。納入者均經口腔X線檢查確診為慢性牙周炎;已排除處于妊娠期或哺乳期的婦女;3個月內患有感染性疾病或接受過抗感染治療;患有心肝腎等重要臟器疾病、惡性腫瘤或自身免疫病的患者。兩組一般資料比較差異無統(tǒng)計學意義(P>0.05)。患者均知情同意。
1.2方法 患者使用0.9%氯化鈉溶液含漱20 s,使用1 mL的無菌EP管收集含漱液,置于-80℃冰箱保存待檢。采用二氧化硅微粒法提取含漱液中的DNA,口腔Hp分布采用聚合酶鏈式反應(PCR)檢測。口腔Hp陽性結果判斷標準:CagA基因表達陽性為在397 bp處出現(xiàn)特異性條帶(CagA基因表達陽性)或294 bp條帶處出現(xiàn)特異性條帶(尿素酶 C基因表達陽性),上述位置出現(xiàn)一處特異性條帶即為口腔Hp陽性。兩組均選取同側1、4、6牙位,采用世界衛(wèi)生組織推薦的CPI牙周探針檢測牙周袋深度,記錄菌斑指數(shù),采用視診結合探針的方法進行檢查,用探針輕劃牙面,根據(jù)菌斑的量和厚度進行計分,菌斑指數(shù)=各牙齒斑計分之和與被檢查總牙數(shù)之比。將pH試紙裁剪為直徑6 mm左右的小圓片,插入牙周袋,30 s后取出,記錄牙周袋深度及齦溝液pH值。收集觀察組中因牙周炎拔出的新鮮牙的組織及對照組中因正畸治療需要拔除新鮮牙的組織,PBS反復沖洗,在超凈工作臺中刮取根中1/3牙周膜組織,盡可能剪碎,形成小組織塊,采用組織塊酶消化法分離細胞,進行PDLSCs原代培養(yǎng),待細胞生長密度達80%左右時,采用低密度法篩選,進行傳代培養(yǎng),取第4代細胞提取總 RNA,逆轉錄合成cDNA模板,采用PrimeScript TM RT reagent Kit逆轉錄試劑盒。采用RT-PCR 法檢測ALP、Runx-2表達情況,試劑盒購自Takara公司,儀器使用ABI 7000 RT-PCR儀,PCR引物委托上海生工生物工程技術有限公司合成。
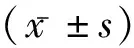
2 結 果
2.1口腔Hp分布情況的比較 觀察組的口腔Hp陽性率為84.17%,顯著高于對照組的43.33%,差異有統(tǒng)計學意義(χ2=21.937,P<0.05)。
2.2不同程度牙周炎的口腔Hp分布情況 隨著牙周炎程度加重,口腔Hp陽性率顯著升高(P<0.05)。見表1。

表1 不同程度牙周炎的口腔Hp分布情況[n(%)]
2.3兩組口腔環(huán)境比較 Hp陽性者的牙周袋深度、齦溝液pH值、菌斑指數(shù)均高于Hp陰性(P<0.05),觀察組顯著高于對照組(P<0.05)。見表2。
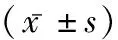
表2 兩組口腔環(huán)境比較
2.4兩組ALP、Runx-2 mRNA水平比較 對照組HP陽性者與陰性者的ALP、Runx-2 mRNA水平無顯著差異(P>0.05),觀察組HP陽性者的ALP、Runx-2 mRNA水平顯著低于Hp陰性者(P<0.05),觀察組顯著低于對照組(P<0.05)。見表3。
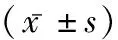
表3 兩組ALP、Runx-2 mRNA水平比較
3 討 論
研究[3]發(fā)現(xiàn),胃炎患者牙菌斑分離得到的Hp與胃粘膜Hp的生化特性、形態(tài)和免疫特性類似,因此推斷除胃以外,口腔是重要的人體Hp貯存地。口腔內環(huán)境直接影響口腔Hp生長及分布。本文結果顯示,觀察組的口腔Hp陽性率顯著高于對照組;隨著牙周炎程度加重,口腔Hp陽性率顯著升高,提示牙周組織破壞程度越嚴重,越有利于口腔Hp的生長分布。Hp陽性者的牙周袋深度、齦溝液pH值、菌斑指數(shù)均高于Hp陰性,觀察組顯著高于對照組。
ALP是一類由肝臟外排的同工酶,在人體胎盤、骨骼、肝臟、腎等多種組織均有分布,參與骨等礦化組織代謝再生。ALP 活性是成骨細胞早期分化的標志物,也是其分化程度及功能的指示指標。牙周膜細胞在牙周組織修復重建過程中扮演重要角色,研究[4]表明,牙周膜細胞具有成骨的能力,細胞ALP 表達水平直接反映成骨細胞活性。研究[5]發(fā)現(xiàn),Runx-2在骨組織形成和重建等過程中發(fā)揮重要作用,成骨細胞增殖分化時,Runx-2表達上調,說明兩者具有密切聯(lián)系。本文中,對照組Hp陽性者與陰性者的ALP、Runx-2 mRNA水平無顯著差異,觀察組Hp陽性者的ALP、Runx-2 mRNA水平顯著低于Hp陰性者,說明牙周炎患者牙周膜細胞成骨分化的礦化程度降低,成骨分化能力明顯降低,影響牙周組織的修復與重建。但Hp感染并不一定是導致牙周膜細胞成骨能力下降的直接因素。研究[6]發(fā)現(xiàn),口腔發(fā)生局部炎癥時,大量炎性因子分泌到胞外,刺激PDLSCs,削弱其分化能力,下調成骨能力,直接影響牙周組織再生。因此,推測可能是Hp感染加重了牙周炎患者的炎癥程度,炎性因子水平升高,進一步減弱牙周膜細胞成骨能力。

