熱電池用貧鋰相磷酸鐵鋰正極材料的理論計算研究
袁光明, 許 萍, 王 超, 周 萍, 強杉杉, 胡華榮*
(1.上海空間電源研究所,上海 200237;2.上海機電工程研究所,上海 201109)
引 言
熱電池屬于化學電源體系,通過電化學氧化還原反應將電極活性物質中的化學能直接轉化為電能,具有很高的能量轉換效率[1]。對于熱電池正極材料來說,其應具有以下特點:電極電位高,相對于鋰電位最好達到2.5 V~3 V;具有高的熱穩定性(700 ℃以上);與電解質不發生反應;具有電子導電性,能夠大電流放電;生成的反應產物能夠導電或能溶入電解質,減小內阻。現階段能夠真正用于生產的正極材料只有FeS2和CoS2,而二者的電壓平臺僅2 V,熱穩定性也相對較差,亟待開發電壓更高、安全性更好的材料。
橄欖石結構的LiFePO4材料是20世紀末才開發出來的鋰離子電池正極材料,一經問世便迅速成為研究熱點[2]。其對Li/Li+的氧化還原電勢為3.5 V,是一種為高電位正極材料。相比于其他鋰離子電池正極材料,LiFePO4最大的優勢在于高溫性能,而良好的熱穩定性恰恰是作為熱電池正極材料的先決條件之一。因此,貧鋰相LiFePO4(LixFePO4)可以作為熱電池正極材料實現正常放電,然而目前對于LixFePO4高溫電化學性能并沒有相關研究報道。為此,本文通過熱力學理論計算,分析研究不同溫度下LixFePO4的最多嵌鋰量以及對應的理論容量。
1 貧鋰相磷酸鐵鋰正極材料理論研究


對于LiFePO4電池,其電極反應如第9頁圖1a)所示,當電池放電時,電解質中的鋰離子在導電劑、活性材料及電解質同時存在的三相界面處發生電荷轉移反應,與導電劑上的電子一同嵌入活性材料,形成LiFePO4,并消耗掉由FePO4晶格構成的相應空位。方程式的左側為界面反應的氧化態,右側為還原態。只要能夠分別得到反應界面兩側的電化學勢,就能夠借助過渡態理論建立界面反應速率模型。
鋰離子嵌入FePO4形成部分嵌鋰的LixFePO4顆粒。在顆粒總體自由能最低的要求下,LixFePO4顆粒將發生相分離,形成貧鋰相與富鋰相的混合,如第9頁圖1c)所示。可以看出,LixFePO4顆粒的總體自由能在決定自身相變的同時,有作為界面反應的還原態而影響界面反應速率,是嵌鋰相變動力學機理的核心。因此,本文運用Cahn-Hilliard相場模型對相變型LixFePO4顆粒自由能進行分析建模,通過泛函變分得到相變過程驅動力——非線性擴散化學勢。該化學勢作為電極界面反應還原態的電化學勢,影響界面反應速率,決定電池開路電壓的曲線形狀。
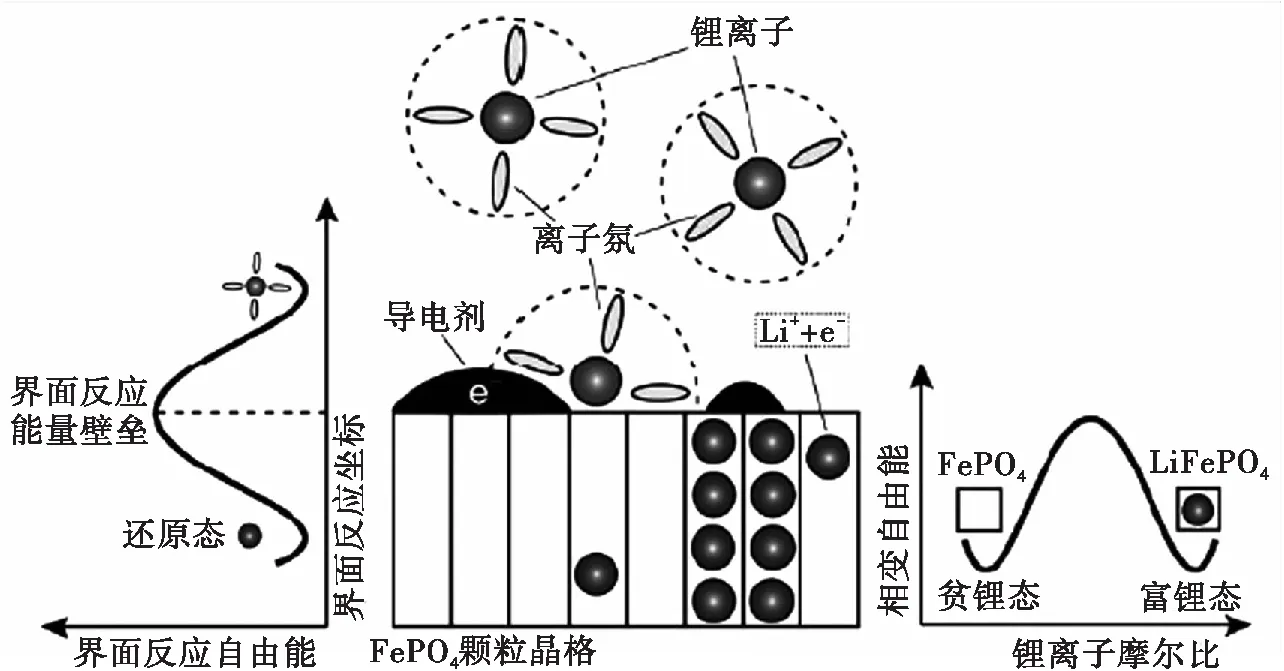
a)物理過程示意圖 b)界面反應能壘示意圖 c)相變過程能壘示意圖
1)Cahn-Hilliard自由能泛函
選取鋰離子在FePO4晶格中的局部摩爾比x作為有序參數,高濃度表征富鋰態,低濃度表征貧鋰態。濃度在整個晶體中連續分布,因而相界面就可以用擴散界面(濃度梯度)來表征。單個LiFePO4顆粒的總體吉布斯自由能就可以表達為Cahn-Hilliard泛函的形式,見式(1)。
(1)
其中,Gbulk為本體吉布斯自由能,Gint為相界面吉布斯自由能,gh(x)為均質自由能密度,K(x)2/2是由濃度梯度引起的能量,即相界面能量,K為梯度能量張量。
2)均質自由能
如果將鋰離子看作一種成分,將FePO4晶格所構成的空穴看作另一成分,那么LixFePO4即可以被看作是二元固溶體[3]。
對于兩相共存系統,可以運用規則溶液模型(regular solution model)對LiFePO4的均質自由能密度gh進行建模,見式(2)。
gh=Ωx(1-x)+2kBT[xlnx+(1-x)ln(1-x)]
(2)
其中,x為鋰離子局部摩爾比,(1-x)為空穴摩爾比;Ω為規則溶液系數;kB為Boltzmann常數;T為溫度。均質自由能密度gh由混合焓和混合熵兩部分組成。
當T=298.15 K時,Ω取0.183 eV,對gh(x)作圖得到圖2a)。圖2a)所示調幅點即為系統能量拐點,兩個調幅點成分xs1和xs2所確定的區間稱為調幅分解區。在該區域內,系統均質自由能二階導數小于0。

a)T=298.15 K,LiFePO4均質自由能密度gh(x)與鋰離子局部摩爾比x關系圖 b)均質擴散化學勢對應的電勢曲線
3)擴散化學勢
對均質自由能密度求一階導,即可得擴散化學勢[見式(3)]。
(3)
擴散化學勢適用于具有有限晶格空位的系統,描述鋰離子嵌入晶格并消耗相應空穴的過程。由于鋰離子總摩爾比的變化必然伴隨電荷的轉移,因此將化學勢除以單位電荷即可得到對應電勢曲線。與自由能曲線中的公切線對應,相變系統的電勢曲線將平衡到如圖2所示的一條水平線段上。均質擴散化學勢只是總體化學勢的一部分,必須將相界面對總體化學勢的貢獻考慮進來,圖2b)所示的平衡電勢曲線也不包含相界面能量的貢獻,通過對Cahn-Hilliard自由能泛函求變分,可得總體化學勢,見式(4)。
(4)
4)溫度效應
由于熱電池工作時,電池內部電堆溫度在400 ℃以上,必須考慮溫度對正極材料LixFePO4的性能影響。根據對LixFePO4顆粒均質自由能密度的分析,溫度的變化將引起混合熵-TΔsmix的變化[(圖3a)],從而導致均質自由能密度gh從“雙井型”曲線變化為“單井型”曲線[圖3b)]。在T>300 ℃時,LixFePO4的放電反應從貧鋰相-富鋰相兩相反應變為單相固溶體反應。對均質自由能密度gh求一階導數,獲得不同溫度下的擴散化學勢μh,將擴散化學勢μh除以單位電荷即可得到不同溫度下的對應電勢曲線,如圖3c)所示。
圖3可知,當T>300 ℃時,LixFePO4的放電曲線不再出現放電平臺,而是隨著x值(即嵌鋰量)的增大,電勢曲線以對稱形式下降,而在Li+嵌入最初與最末的時期,即x→0或1時,電勢曲線存在一個突變值;中間階段的電勢曲線則呈現線性下降的規律。為提高熱電池放電時的電壓精度,使正極材料表現出盡量寬的平臺電壓區域,則需要避開圖中所示的電壓快速下降區。由于熱電池要求電壓精度一般為0.9 U~1.1 U(U為可利用的放電階段的平均電壓)。即LixFePO4的平均電壓為3.0 V,則通過電勢曲線求得μh(x)/e在±0.3 V時對應的x值(x1和x2),即為放電前后LixFePO4中Li的含量,通過第11頁公式(5)可計算出對應的理論比容量,結果如圖3d)和表1所示。從表1中可以看出,500 ℃時LixFePO4的嵌鋰量需小于0.028,才能滿足電壓精度需求,放電理論比容量可以達到602 A·s·g-1。隨著溫度的升高,LixFePO4的嵌鋰量可以略微增大,700 ℃時的嵌鋰量最大可允許在0.060以內,理論比容量可以在561 A·s·g-1。
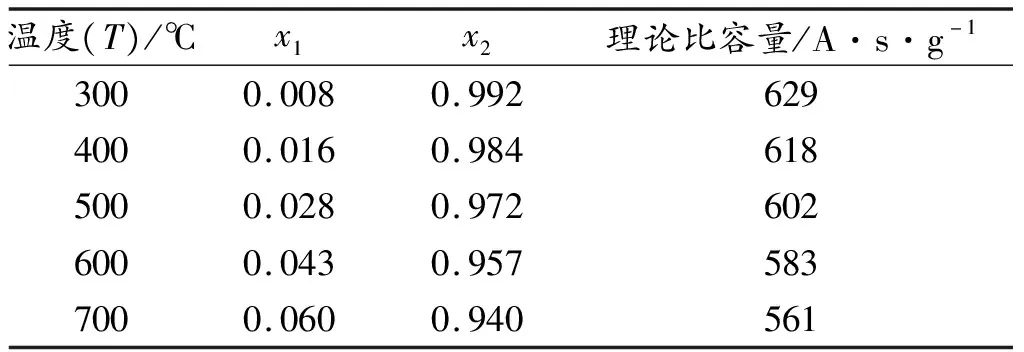
表1 不同溫度下,μh(x)/e在±0.3 V時對應的x值(x1和x2)及理論比容量
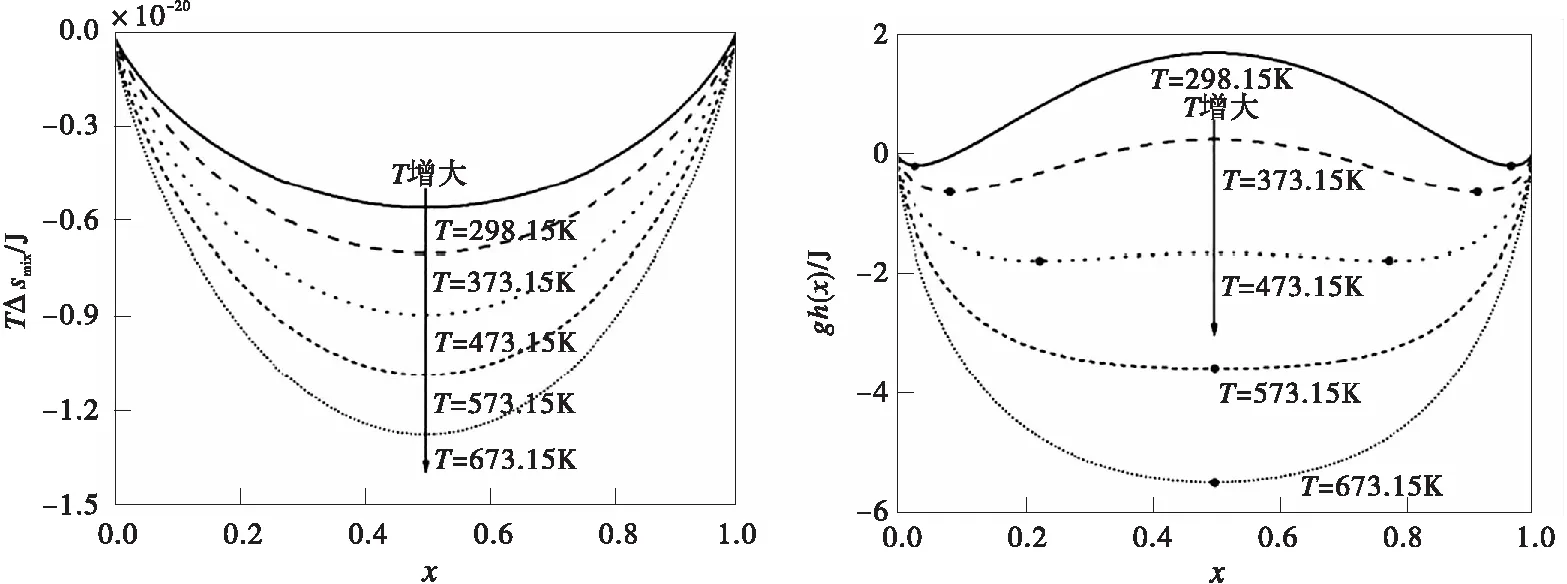
a)混合熵-TΔsmix隨不同溫度T的變化 b)均質自由能密度gh隨不同溫度T的變化
(5)
2 結論
本文介紹分析了LiFePO4材料的熱力學屬性,運用Cahn-Hilliard相場模型對相變型LixFePO4顆粒自由能進行分析建模,最終分析研究在高電壓精度前提下,基于貧鋰相LiFePO4正極的熱電池在高溫下的放電容量。研究結果表明,高溫500 ℃時,LixFePO4的嵌鋰量需小于0.028,才能保證電池高的放電容量。隨著溫度的升高,允許的嵌鋰量可以略微增大。其中,700 ℃時的嵌鋰量最大可允許在0.060以內,理論比容量可以達到561 A·s·g-1。

