光譜法與計算機模擬法研究六溴環十二烷與牛血清白蛋白的相互作用
庹 潯,宋繼敏,付 豪,呂小蘭*
1.南昌大學化學學院,江西 南昌 330000 2.南昌大學藥學院,江西 南昌 330000
引 言
六溴環十二烷(Hexabromocyclododecane,HBCD)是一類添加型的含溴阻燃劑,是繼多溴聯苯醚、四溴雙酚A后被廣泛使用的第三大溴系阻燃劑。2001年至2011年全球HBCD產量由16 700 t增至31 000 t,我國年生產量從500 t增至18 000 t,已成為HBCD的主要生產國[1]。2013年5月經締約方大會第六次會議審議,聯合國環境規劃署理事會將HBCD納入持久性有機污染物目錄,引發國際社會廣泛關注。
近年來的研究表明HBCD能夠進入大氣、土壤、水體等自然環境并且能夠在生物體內蓄積[1]。據文獻報道,中國各大城市的空氣中均檢出HBCD,土壤中HBCD含量檢出量高達11 700 ng·g-1,遠遠超過世界標準[2]。特別值得注意的是,在人跡罕至的北極地區的空氣及生物體內都檢測到HBCD的存在[3]。毒理學相關研究表明,HBCD對生物體具有生殖毒性、發育毒性、神經毒性等多種毒性[4]且具有生物放大效應,能夠通過食物鏈的傳遞最終嚴重威脅人類健康。例如:經HBCD染毒7天后,雌性大鼠肝臟中大量蛋白的表達發生改變[5],食物鏈高端的魚類體內HBCD含量高于食物鏈低端魚類[6],體外研究表明HBCD對人肝細胞和人肝癌細胞具有細胞毒性[7]。因此,研究HBCD對哺乳動物毒性作用機制,可為降低HBCD對人類健康的威脅提供理論支持。
血清白蛋白作為一種重要的生物分子,在過去的幾百年里一直為人們所關注。血清白蛋白是血液中重要的蛋白質成分,負責維持血液的滲透壓以及pH值。血清白蛋白在許多內源性物質(氨基酸、脂肪酸等)和外源化合物(藥物、環境污染物等)的轉運過程中發揮著關鍵作用[8]。持久性有機污染物同樣能夠與白蛋白結合[9],繼而被轉運至各個器官,由此可以推測血清白蛋白在HBCD的致毒機制中發揮著關鍵作用。目前,尚未見HBCD與血清白蛋白結合機制的研究。本文通過實驗研究和理論計算相結合的方式,探究HBCD與BSA的作用機制,以期為從分子水平揭示HBCD對人類毒性作用機制提供重要基礎信息。
1 實驗部分
1.1 儀器與試劑
帶溫控系統的F-4500熒光分光光度計(日本日立公司);紫外-分光光度計(UV-5500PC上海元析儀器有限公司);Cary eclipse熒光光譜儀(美國安捷倫公司);PHS-3C精密PH計(上海雷磁儀器廠);溶液:牛血清白蛋白(進口分裝)溶于超純水中配制成1×10-3mol·L-1的儲備液,六溴環十二烷(上海源葉生物,97%)溶于二甲基亞砜(國藥集團化學試劑有限公司,A.R.)中配成1×10-2mol·L-1的HBCD儲備液;Tris-HCl緩沖液:2.42 g三羥甲基氨基甲烷(Tris,上海源葉生物科技有限公司,純度為99.9%)和3.51 g NaCl溶于400 mL超純水中配制成pH 7.40的緩沖液;實驗用水均為超純水。
1.2 方法
1.2.1 熒光光譜、同步熒光的測定
固定研究體系中BSA濃度為3.33×10-6mol·L-1,改變HBCD的濃度(0,3.33,6.66,9.99,13.33,16.67,19.98)×10-6mol·L-1,以280 nm為激發波長,測定300~450 nm下的熒光發射光譜。
改變BSA-HBCD體系的溫度(288,293和298 K),以280 nm為激發波長,測定300~450 nm的熒光發射光譜。
固定λem-λex=15 nm,λem-λex=60 nm,分別測定260~320 nm下的同步熒光發射光譜。
改變體系中BSA和HBCD的比例,分別以280和295 nm為激發波長,測定發射波長345 nm下的熒光強度。
1.2.2 紫外光譜
固定研究體系中BSA的濃度為3.33×10-6mol·L-1,改變HBCD的濃度(0,3.33,6.66,9.99)×10-6mol·L-1,以相應的HBCD溶液作為參比,測定200~300 nm下BSA-HBCD體系的紫外光譜。
1.2.3 分子對接
通過ChemBio3D Ultra 14.0得到HBCD的結構,并通過MMFF94分子力場優化得到最佳的結構。從RSCB數據庫(http://www.rcsb.org/)中得到編號為1H9Z的白蛋白構象。通過Autodock4.2 程序進行分子對接并使用Ligplus+軟件對ΔG最低的構象進行分析。
1.2.4 分子動力學
利用分子動力學軟件GROMACS 2016.1程序模擬游離態和結合態的BSA結構的穩定性以及HBCD對BSA二級結構的影響,每個體系重復模擬3次。
2 結果與討論
2.1 HBCD與BSA體系熒光光譜、紫外光譜分析
BSA中含有酪氨酸(Tyr)、色氨酸(Trp)和苯丙氨酸(Phe)三種能夠產生熒光的氨基酸殘基,使得BSA具有一定的內源性熒光。由圖1(a)所示,隨著HBCD濃度的增加,BSA的熒光強度依次降低,表明HBCD與BSA間存在著相互作用且結合能力較強,易在體內被蛋白質儲存和轉運。

圖1 HBCD對BSA熒光光譜(a)和紫外光譜(b)的影響Fig.1 Effect of HBCD on the fluorescence (a) and UV absorption spectra (b) of BSA(a):[BSA]=3.33×10-6 mol·L-1;[HBCD]=(0,3.33,6.66,9.99,13.33,16.67,19.98)×10-6 mol·L-1;(b):[BSA]=3.33×10-6 mol·L-1;[HBCD]=(0,3.33,6.66,9.99)×10-6 mol·L-1

2.2 HBCD與BSA的結合位置
BSA具有兩個與外源性物質結合的結合位點,分別是結合位點Ⅰ和結合位點Ⅱ。運用Autodock4.2程序分別對HBCD與BSA在結合位點Ⅰ和Ⅱ處結合進行理論模擬研究。結果表明,當HBCD進入BSA結合位點Ⅰ處與其結合時吉布斯自由能(ΔG)為-6.5 kcal·mol-1,而進入結合位點Ⅱ處的ΔG為+4.3 kcal·mol-1。可見HBCD與BSA會更傾向于在結合位點Ⅰ進行自發結合。最佳模擬結果如圖2(a)和(b)所示。

圖2 HBCD與BSA在結合位點Ⅰ的相互作用圖(a):BSA與六溴環十二烷結合圖;(b):結合位點Ⅰ放大圖;(c):Ligplus+軟件分析2D圖;(d):Ligplus+軟件分析3D圖Fig.2 The interaction between HBCD and BSA at site Ⅰ(a):BSA and HBCD interaction model;(b):Enlarged view of binding site Ⅰ;(c):Analysis of figure using Ligpius+;(d):Analysis of 3D figure using Ligpius+
由于BSA的結合位點Ⅰ中有能夠產生熒光的氨基酸殘基有Tyr和Trp,而結合位點Ⅱ中僅有Tyr。因此,利用結合位點Ⅰ和結合位點Ⅱ結構的差異以及Tyr/Trp性質的差異,通過同步熒光和改變激發波長實驗可進一步確認HBCD與BSA的結合位點。
2.2.1 同步熒光實驗
固定λem-λex=15 nm時,測得蛋白質中Tyr的光譜;固定λem-λex=60 nm時,測得Trp的光譜。由圖3可見,隨著HBCD濃度的增加,Tyr的熒光強度下降幅度很小,幾乎不變[圖3(a)],而Trp的熒光強度呈現規律性下降[圖3(b)]。該結果表明HBCD與BSA的結合位點在Trp附近,即兩者在結合位點Ⅰ結合。

圖3 HBCD對BSA同步熒光光譜的影響Fig.3 Effect of HBCD on the synchronous fluorescence spectra of BSA[BSA]=3.33×10-6 mol·L-1,[HBCD]=(0,3.33,6.66,9.99,13.33)×10-6 mol·L-1(a):Δλ=15 nm;(b):Δλ=60 nm
2.2.2 不同激發波長下的熒光光譜實驗
當激發波長為280 nm時,Trp和Tyr的熒光同時被激發;激發波長為295 nm時,只有Trp的熒光被激發。因此,比較兩個不同激發波長處,熒光強度下降的程度,可以判斷出HBCD與BSA的結合位點。熒光實驗表明在HBCD濃度由3.33×10-6mol·L-1增至3.33×10-4mol·L-1的過程中,280 nm處熒光強度下降程度始終大于295 nm。當HBCD濃度達到3.33×10-4mol·L-1時,280 nm處熒光強度下降了64%,明顯大于295 nm處熒光下降強度47%,表明Trp和Tyr的熒光強度在HBCD與BSA作用過程中均被抑制,此實驗再次證明HBCD與BSA在結合位點Ⅰ進行結合。這一結果與分子對接結果、同步熒光光譜實驗結果一致。
2.3 HBCD與BSA體系結合位點數與結合常數的確定
小分子與蛋白大分子相互作用的結合位點數n與結合常數Ka可以由式(1)[10]得到
log[(F0-F)/F]=logKa+nlog[Q]
(1)
式(1)中,F0及F分別為BSA單獨存在以及加入HBCD形成復合體系后的熒光強度,Ka為結合常數,n為結合位點數,[Q]為HBCD的濃度。以log[(F0-F)/F]對log[Q]作圖,通過直線的斜率與截距得到n值與Ka值,結果列于表1中。不同溫度條件下,HBCD與BSA的結合位點數n均約為1,說明兩者發生結合作用時只有1個結合位點;隨著體系溫度的上升,結合常數Ka逐漸下降,表明HBCD對BSA的熒光的猝滅機制為靜態猝滅。
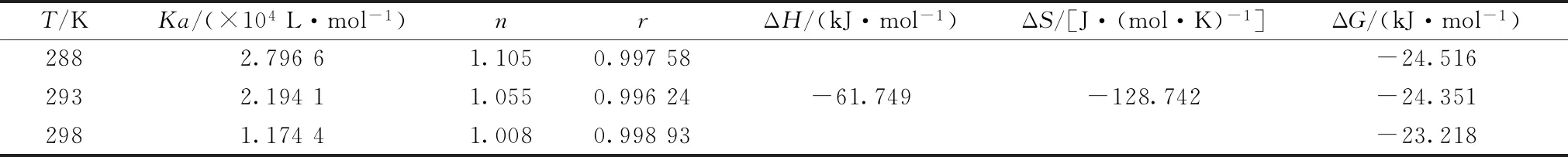
表1 六溴環十二烷與牛血清白蛋白結合作用的結合常數與熱力學參數Table 1 The binding constant and the thermodynamic parameters of BSA-HBCD at different temperatures
2.4 HBCD與BSA的熱力學參數及作用力類型
從本質上分析,有四種主要類型的非共價相互作用力存在于配體與蛋白質的結合過程中,分別是:靜電作用力,氫鍵,范德華力以及疏水作用力[11]。通過分子對接得到HBCD與BSA結合的最佳構象后,利用LigPlus+軟件分析HBCD與BSA之間的相互作用。如圖2(c)所示,HBCD與5種氨基酸之間具有疏水作用力,其中3種是疏水性氨基酸(Trp,Phe,Leu),2種是親水性氨基酸(Lys,His),由此可以初步推測HBCD與BSA結合的主要作用力是范德華力。
熱力學參數是確定分子間作用力的主要依據,為進一步確認HBCD與BSA的作用力類型,可通過不同溫度條件下的熒光光譜實驗得到三個不同溫度下的結合常數,結合式(2)和式(3),計算得到三個熱力學參數大小,進而判斷作用力類型。若ΔH>0和ΔS>0,表明兩物質間的作用力類型為疏水作用;若ΔH<0和ΔS>0,表明兩物質間的作用力類型為靜電作用力;若ΔH<0和ΔS<0,表明兩物質間的作用力類型為氫鍵或范德華作用力[12]。當溫度變化不大時,系統的焓變與熵變可視為常數。焓變與熵變通過式(2)計算得到,系統的吉布斯自由能變化通過式(3)計算得到。
lnKa=-ΔH/RT+ΔS/R
(2)
ΔG=ΔH-TΔS=-RTlnKa
(3)
式(2)和式(3)中,Ka為HBCD與BSA結合的結合常數,R是氣體常數,以lnKa對-1/T作圖,由直線的斜率和截距分別得到ΔH和ΔS,計算結果見表1。由表1可知,ΔG<0,說明HBCD與BSA的結合反應是自發進行的,ΔH<0和ΔS<0,說明HBCD與BSA之間主要作用力類型為范德華力或氫鍵。
2.5 HBCD與BSA間能量轉移
根據Forster能量轉移理論,兩種化合物分子間滿足供能體發出熒光,供能體的熒光發射光譜和受體的吸收光譜有重疊或者供能體和受體足夠的接近,且最大距離在7 nm范圍內時,將會有非輻射能量轉移。按照相關方程處理HBCD的紫外吸收光譜與BSA熒光光譜的重疊譜圖(圖4)。得到J=3.413×10-15cm3·mol·L-1,R=2.04 nm,r=3.45 nm。計算機模擬的結果表明BSA與HBCD間的結合距離為3.40 nm[圖2(d)],該值與實驗結果接近,進一步說明實驗的可靠性。r<7 nm表明HBCD與BSA間存在非輻射能量轉移,從而導致BSA熒光猝滅。
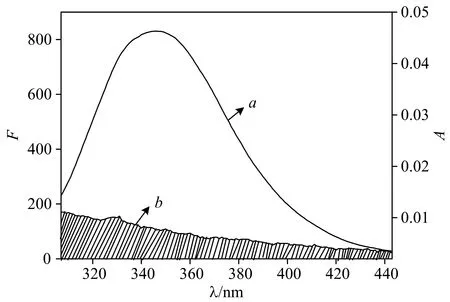
圖4 BSA的熒光發射光譜(a)和HBCD的紫外吸收光譜(b)Fig.4 Fluorescence emission spectra of BSA (a) and UV absorption spectra of HBCD (b)[BSA]=[HBCD]=3.33×10-6 mol·L-1
2.6 HBCD對BSA二級結構的影響
2.6.1 分子動力學模擬
通過分子動力學模擬(MD)可以研究HBCD與BSA復合物在水溶液中的動力學情況。根據均方根偏差(RMSD)及蛋白質二級結構變化可以判斷HBCD對BSA二級結構的影響。BSA與HBCD形成的復合體系的均方根偏差如圖5(a)。研究體系的RMSD值在2 ns以后變化幅度很小,說明HBCD能夠與BSA形成穩定的復合物,并且復合物體系穩定。進一步分析BSA處于游離態與穩定態時的二級結構,如圖5(b)所示,其中無規則卷曲(coil)、彎曲(Bend)、β-折疊(Turn)、α-螺旋(α-Helix)、5-螺旋(5-Helix)、3-螺旋(3-Helix)的含量都不發生變化,且具有統計學意義。說明HBCD不會改變BSA的二級結構。

圖5 HBCD對BSA的RMSD(a)和二級結構含量(b)的影響Fig.5 RMSD (a) and the average contents of Secondary structure (b) of BSA
2.6.2 HBCD與BSA的三維熒光光譜分析


圖6 BSA和BSA-HBCD的三維熒光光譜圖Fig.6 Three-dimensional fluorescence spectra of BSA and BSA-HBCD[BSA]=[HBCD]=3.33×10-6 mol·L-1
3 結 論
通過整合多種光譜學技術以及計算機模擬技術,本文探究了HBCD與BSA之間相互作用的化學本質。HBCD通過靜態猝滅和非輻射能量轉移導致BSA內源熒光猝滅;根據計算結果可知HBCD與BSA的結合位點數為1,結合常數為2.796 6×104L·mol-1(288 K),2.194 1×104L·mol-1(293 K),1.174 4×104L·mol-1(298 K);HBCD會自發地與BSA在結合位點Ⅰ進行結合,兩者的結合距離為3.45 nm。ΔH<0,ΔS<0,ΔG<0,表明HBCD與BSA之間自發結合過程是熵增加、吉布斯自由能減小的過程,結合作用力主要為范德華力或氫鍵;HBCD與BSA結合不會使BSA的構象發生改變。本實驗的研究結果能夠幫助人們在一定程度上理解溴系阻燃劑在生物體內的運輸機制,為研究HBCD的毒理機制提供重要的理論基礎。

