茵陳的化學成分、藥理作用機制與臨床應用研究進展
黃麗平,許遠航,鄧敏貞,周中流*
1嶺南師范學院,湛江 524048;2廣州中醫藥大學第二附屬醫院 廣東省中醫院 廣東省中醫藥科學院,廣州 510120
茵陳為菊科植物濱蒿(ArtemisiascopariaWaldst.et Kit.)或茵陳蒿(ArtemisiacapillarisThunb.)的干燥地上部分。茵陳最早記載于《神農本草經》,“主風濕寒熱邪氣,熱結黃疸”,其味微苦微辛,性微寒,入脾、胃、膀胱經,有清利濕熱、利膽退黃等功效,主治黃疸尿少,濕溫暑濕,聞瘡瘙癢等癥。茵陳主要含有香豆素類、黃酮類、有機酸類、揮發油類、萜類等化學成分。研究顯示,其具有顯著的保肝利膽作用、抗炎、抗氧化、抗腫瘤、抑菌和抗病毒等作用,臨床主要用于治療黃疸、母兒ABO血型不合、膽囊炎及肝內膽汁淤積癥、陰道炎、治療濕熱型濕疹等。目前雖有學者對茵陳化學成分及其藥理活性進行綜述,但隨著新成分的不斷發現和藥理活性的不斷擴充,現有綜述并不能對其“化學成分-藥理作用機制-臨床應用”進行全面的系統總結。本文對近年來國內外有關茵陳的“化學成分-藥理作用機制-臨床應用”的研究進展進行總結,以期為茵陳的合理開發提供科學依據和參考。
1 化學成分
1.1 香豆素類化合物
茵陳中的香豆素類成分主要為簡單香豆素和呋喃香豆素衍生物,除isosabandin(7)與sabandinsB(9)屬角型呋喃香豆素衍生物外,其余均屬線型香豆素,其母核結構見圖1。茵陳中主要的香豆素類化合物及其結構分別見表1、圖2。目前所發現的香豆素類化合物均在母核上進行取代,取代基有羥基(-OH)、甲氧基(-OCH3)和甲基(-CH3)等,常見于C-6位與C-7位取代,少數在C-5位、C-8位取代,極少數以不飽和烴在C-3位取代茵陳素(10)。
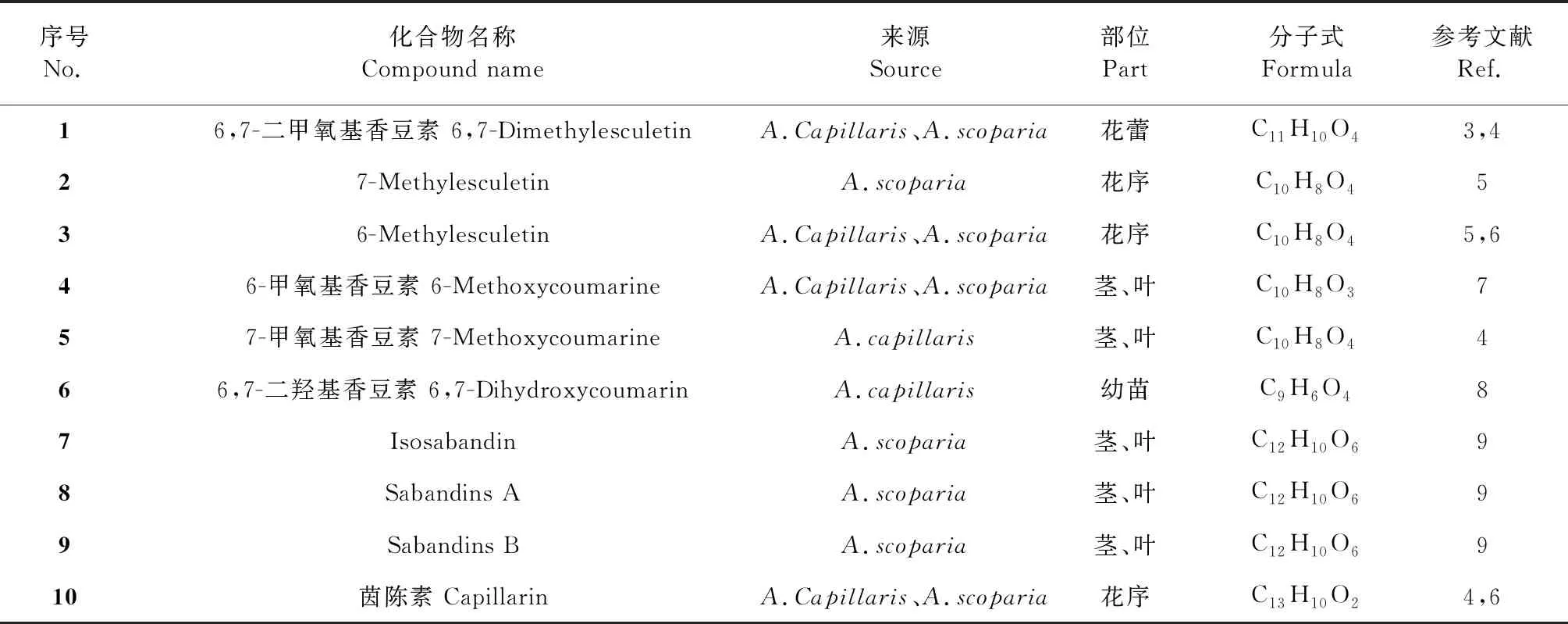
表1 茵陳中香豆素類化合物
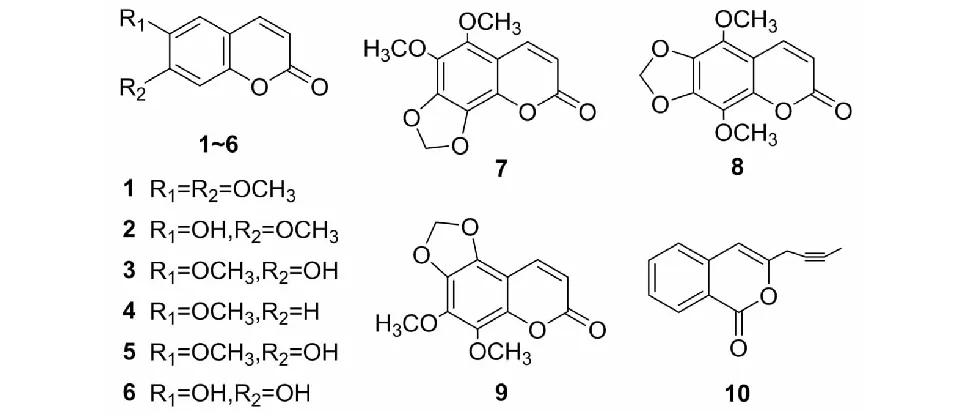
圖2 茵陳中香豆素類化合物結構
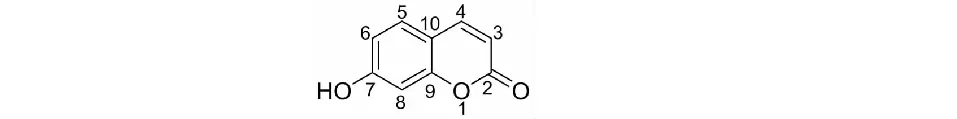
圖1 香豆素類化合物基本母核
香豆素類化合物治療肝病、抗氧化和抗腫瘤等活性與抑制黃嘌呤氧化酶(xanthine oxidase,XO)具有密切的關系,有學者[1,2]通過模擬對接實驗發現,香豆素母核內酯部位C-2位羰基和C-1位氧分別與XO的Arg880和Thr100以氫鍵的形式結合,6,7-二甲氧基香豆素(1)C-6位羥基能與E802強結合,使香豆素類化合物與XO具有高親和力。構效關系研究[2]表明母核上C-5位,C-7位甲氧基及C-6位短鏈烴基的取代,能夠有效地抑制促炎因子iNOS和COX-2的mRNA表達,下調NO的生成量,發揮抗炎的作用。C-6位取代基在其藥理活性上起重要作用:鹵素或甲氧基取代后,抗腫瘤活性大大增強;C-6位游離羥基是香豆素類化合物抗真菌活性所必須,而母核上C-7位甲氧基,C-6位游離羥基和(或)C-8位游離羥基是香豆素類化合物具有廣譜抗菌活性的結構。
1.2 黃酮類化合物
茵陳的黃酮類化合物以普通黃酮類(11、12)、黃酮醇類(13、22)和黃酮氧苷(24、36)為主,有個別二氫黃酮類(24)和色原酮類(25)。黃酮類化合物具有C3-C6-C3骨架結構,其基本母核結構見圖3,主要的黃酮類化合物見圖4、表2。現代構效關系研究發現[10],黃酮類化合物的抗氧化能力,尤其是清除自由基能力與取代羥基的數量成正比,相鄰取代羥基數目越多活性越強,且位于A環的羥基活性更大,而取代氧苷化或甲氧基化均會影響其活性。B環存在C-4位羥基與C環C-2位、C-3位雙鍵及C-3位羥基取代的黃酮類化合物在茵陳保肝利膽的藥理活性中起重要作用。黃酮氧苷因有羥基與糖基取代均具有一定的抗炎抑菌作用,經對比發現糖基對抑菌率的貢獻大于羥基,而抗炎能力隨糖基數目增加而增強。
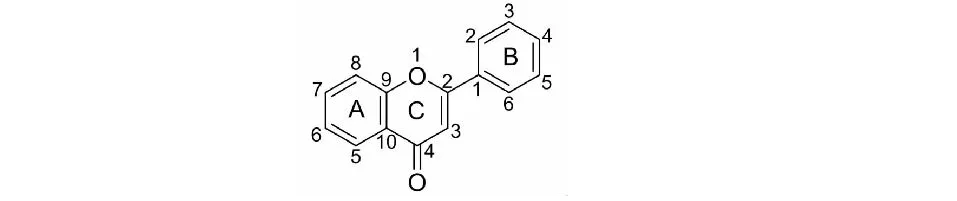
圖3 黃酮類化合物基本母核
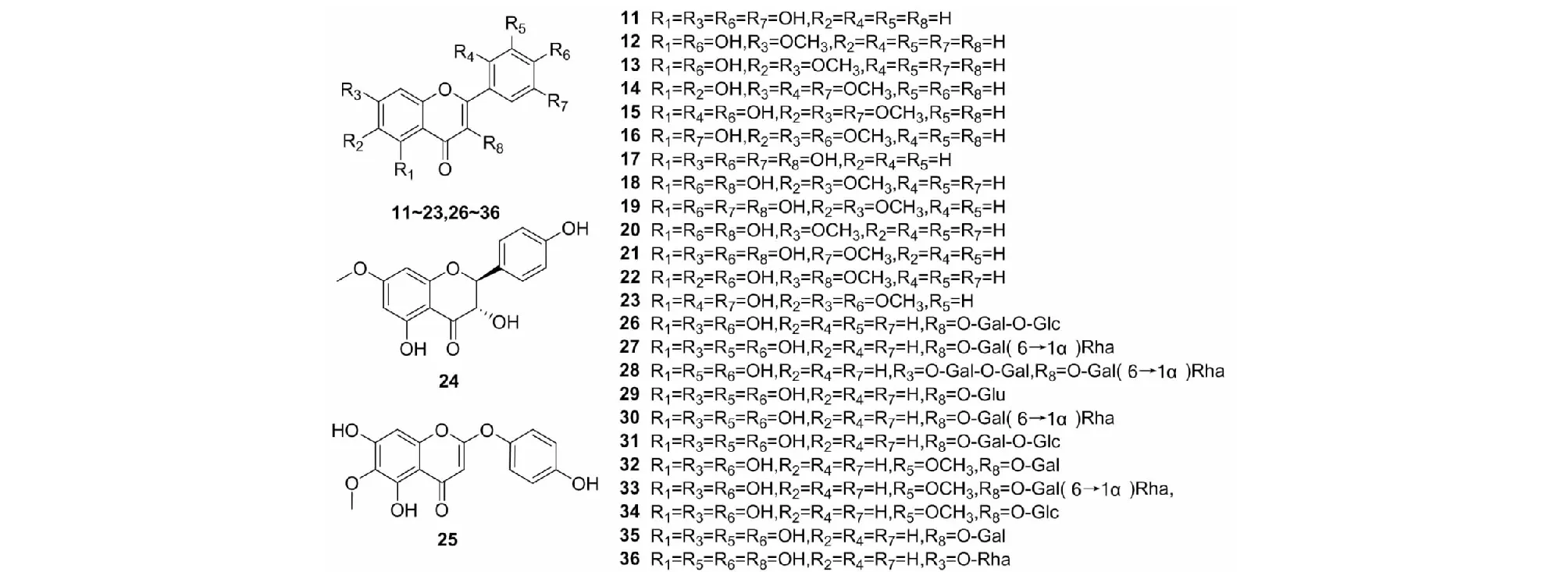
圖4 茵陳中黃酮類化合物結構
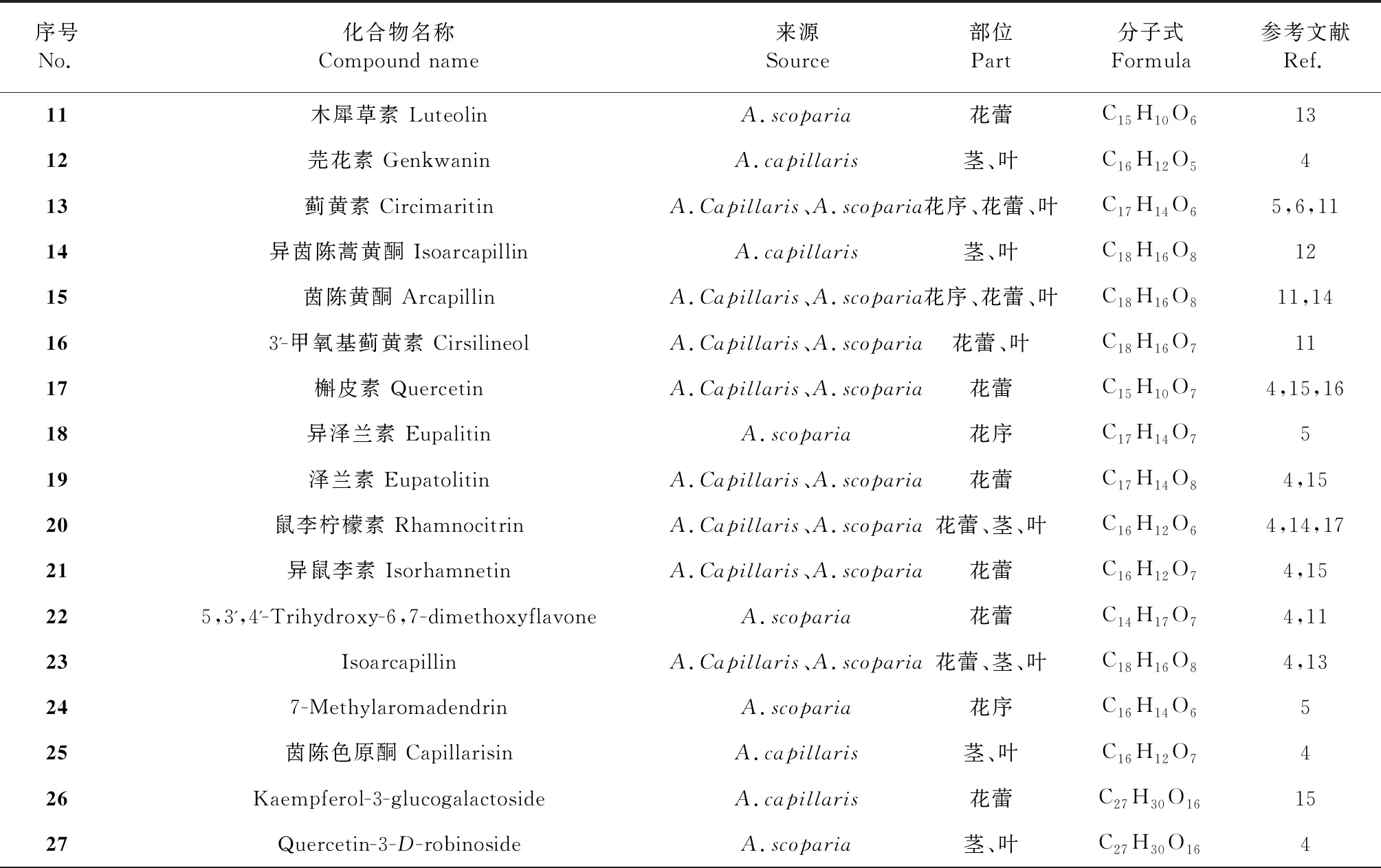
表2 茵陳中黃酮類化合物

續表2(Continued Tab.2)
1.3 有機酸類化合物
茵陳的有機酸類化合物多為酚酸類化合物,如綠原酸(41)、咖啡酸(45)等,具有明顯的抗菌消炎等藥理作用。主要有機酸類化合物見圖5、表3。迄今為止的研究發現[18],有機酸類化合物能通過參與微生物能量競爭、改變細菌外膜通透性、改變滲透壓及抑制生物合成等環節,發揮抑菌作用。茵陳所含有機酸的抑菌活性主要來自羧基和芳環的取代羥基。有機酸類化合物大多屬于弱酸,由于酸性基團的數量、位置及吸、斥電子基團的影響,而具有不同的pH值和不同的細胞穿透能力,并影響細胞、微生物的多個生物代謝過程。
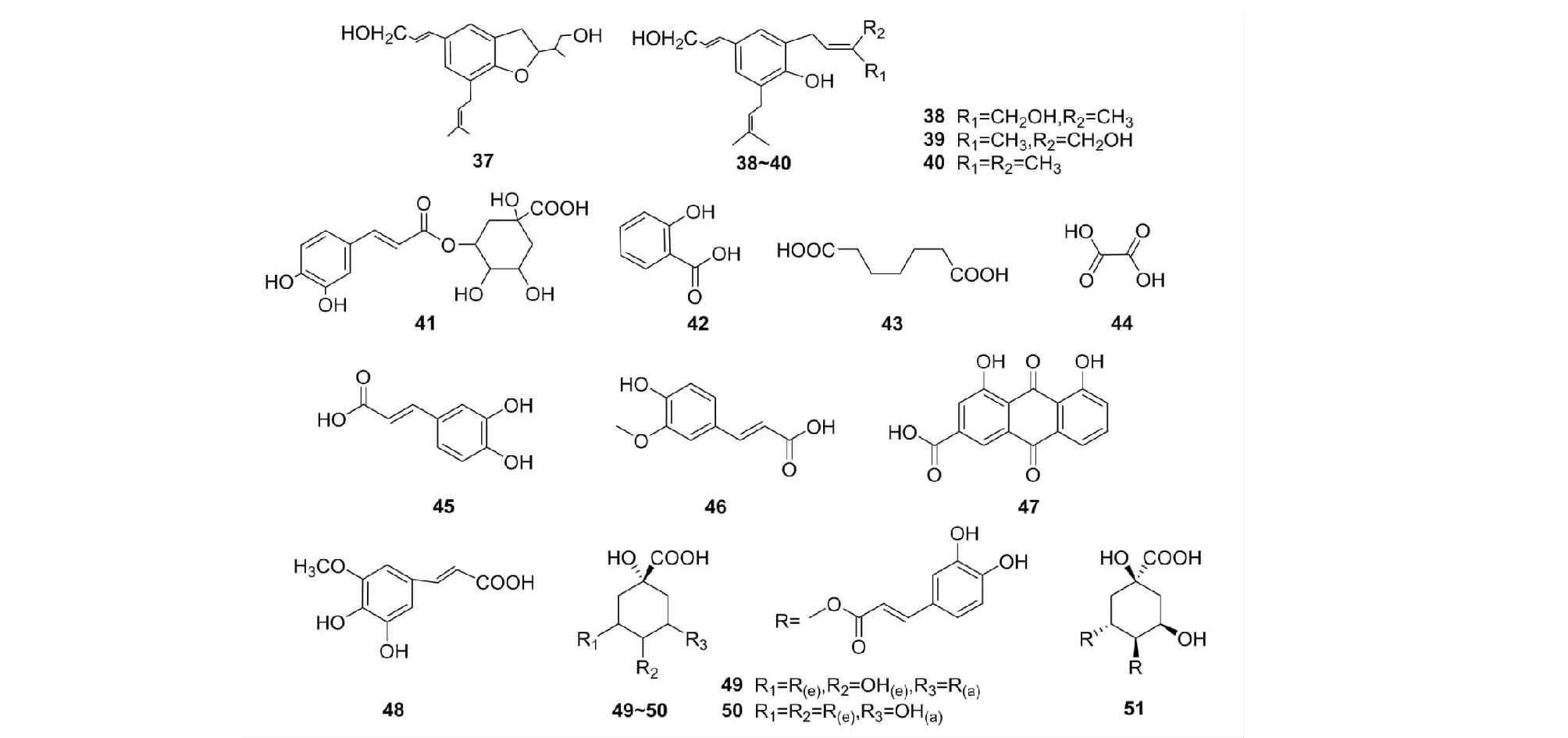
圖5 茵陳中有機酸類化合物結構

表3 茵陳中有機酸類化合物
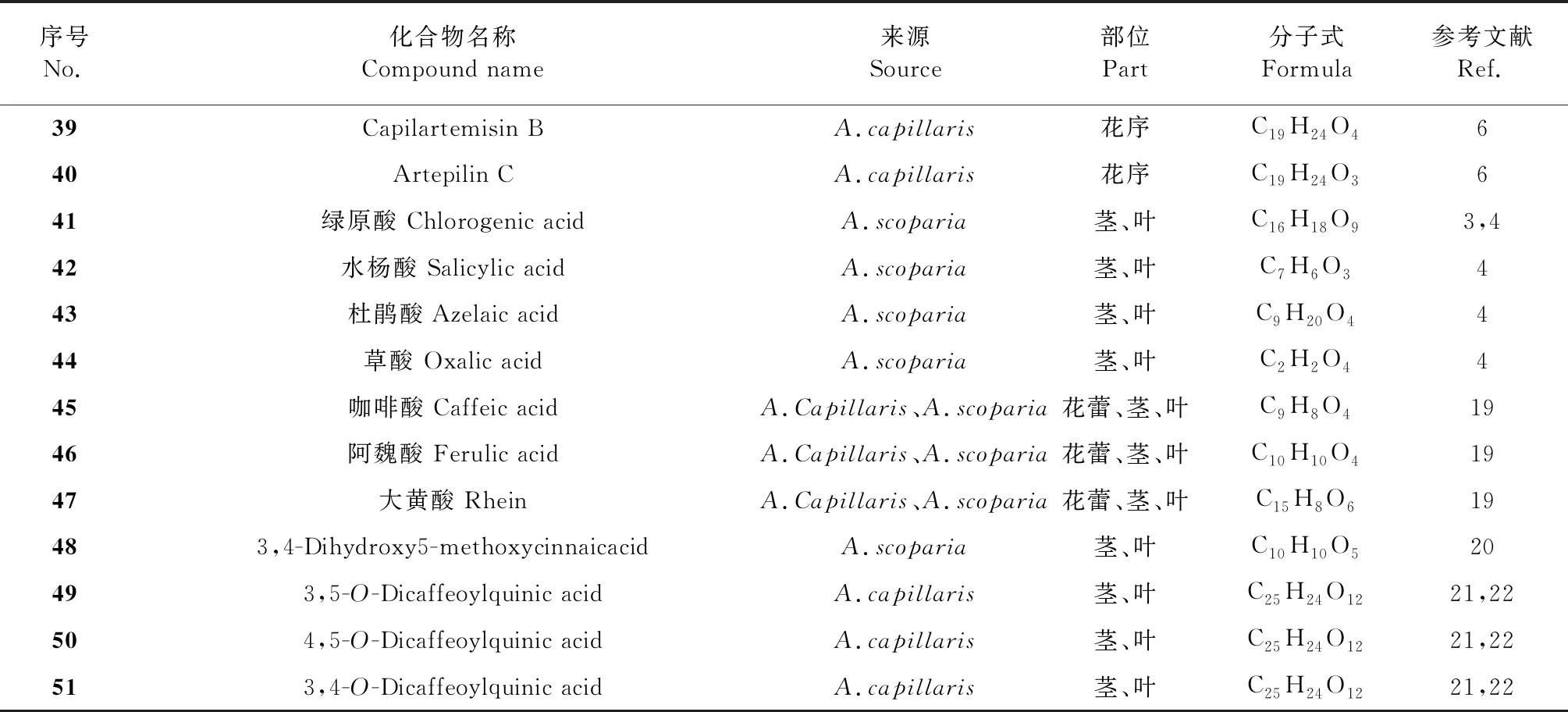
續表3(Continued Tab.3)
1.4 揮發油及萜類化合物
茵陳揮發油含量和色澤在不同時期[23],由幼苗期至成熟期逐漸增加,呈現不同的狀態,在幼苗期色澤為綠色,含量約為0.031 mL/100 g,立秋時期色澤為棕色,含量約為0.47 mL/100 g,在花期時色澤為棕黃色,含量達到頂峰為0.96 mL/100 g。茵陳揮發油含大量萜類和色原酮、烯炔、醛酮等揮發組分,如茵陳二炔、茵陳炔酮、茵陳二炔酮等,是利膽的主要活性成分;烯炔、醛酮、長鏈脂肪醇等,因含有大量不飽和基團,是抗氧化、抗衰老的主要活性成分。茵陳中主要的揮發油及萜類化合物見圖6、表4。
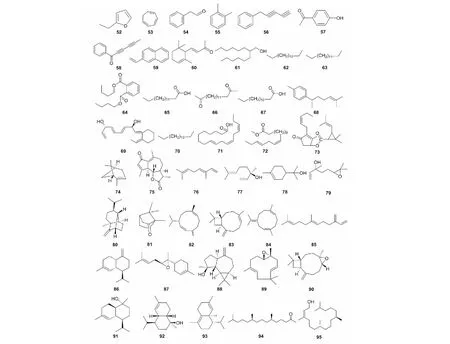
圖6 茵陳中揮發油及萜類化合物結構

表4 茵陳中揮發油及萜類化合物
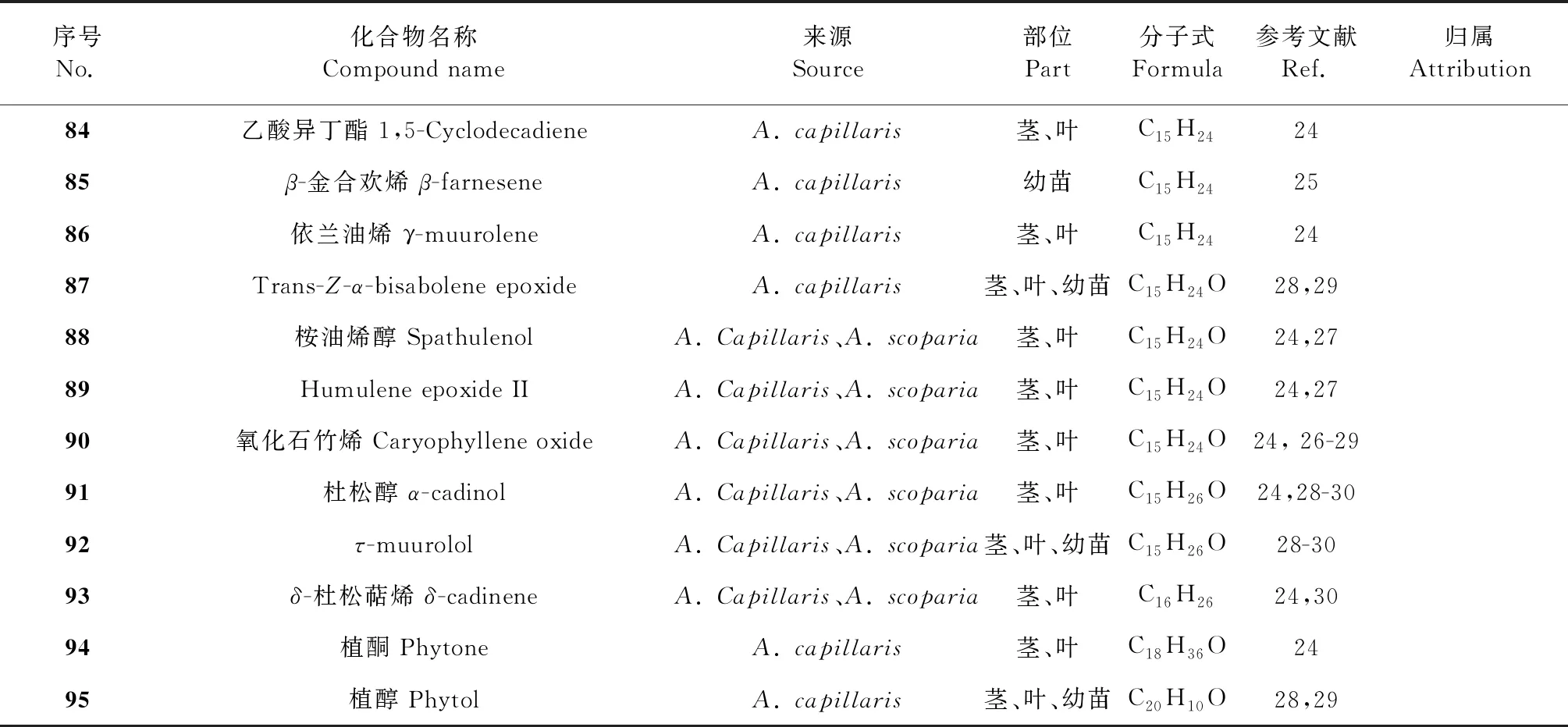
續表4(Continued Tab.4)
2 主要藥理活性及其相關機制
目前,茵陳藥理活性研究較多報道集中在6,7-二甲氧基香豆素、茵陳色原酮、綠原酸、茵陳二炔酮等單體化合物上,其他單體化合物研究報道甚少,更多研究停留在總提取物層面,且相關作用機制研究尚未深入報道。
2.1 保肝利膽作用
茵陳主歸脾、胃、肝、膽經,清濕熱、保肝、利膽退黃是其傳統藥用功能。現代藥理研究發現6,7-二甲氧基香豆素、6-methylesculetin、茵陳色原酮、綠原酸、β-蒎烯等化合物是其保肝利膽作用的物質基礎。此外,茵陳還具有抗ABO血型不合和改善新生兒黃疸的輔助治療作用。
2.1.1 脂肪肝
Shang[32]通過脂多糖(lipopolysaccharide,LPS)刺激誘導小鼠腹腔巨噬細胞實驗,發現茵陳中一種倍半萜內酯leucodin,具有抑制巨噬細胞炎癥反應并降低肝內脂肪蓄積的能力(機制見圖7)。
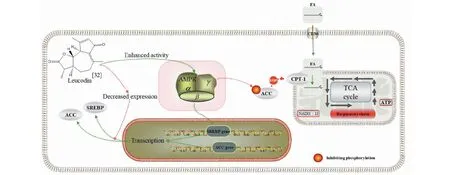
圖7 乙酰氧母菊素對LPS誘導的巨噬細胞的作用機制
2.1.2 肝纖維化
肝星狀細胞(hepatic stellate cell,HSC)的活化是肝纖維化的標志。Liu等[33]首次發現6,7-二甲氧基香豆素能抑制HSC-T6細胞Smad3磷酸化水平,α-SMA、I型膠原、III型膠原和NOX的表達,從而抑制HSC-T6的活化和增殖,具有較好地治療肝纖維化的潛力(機制見圖8)。
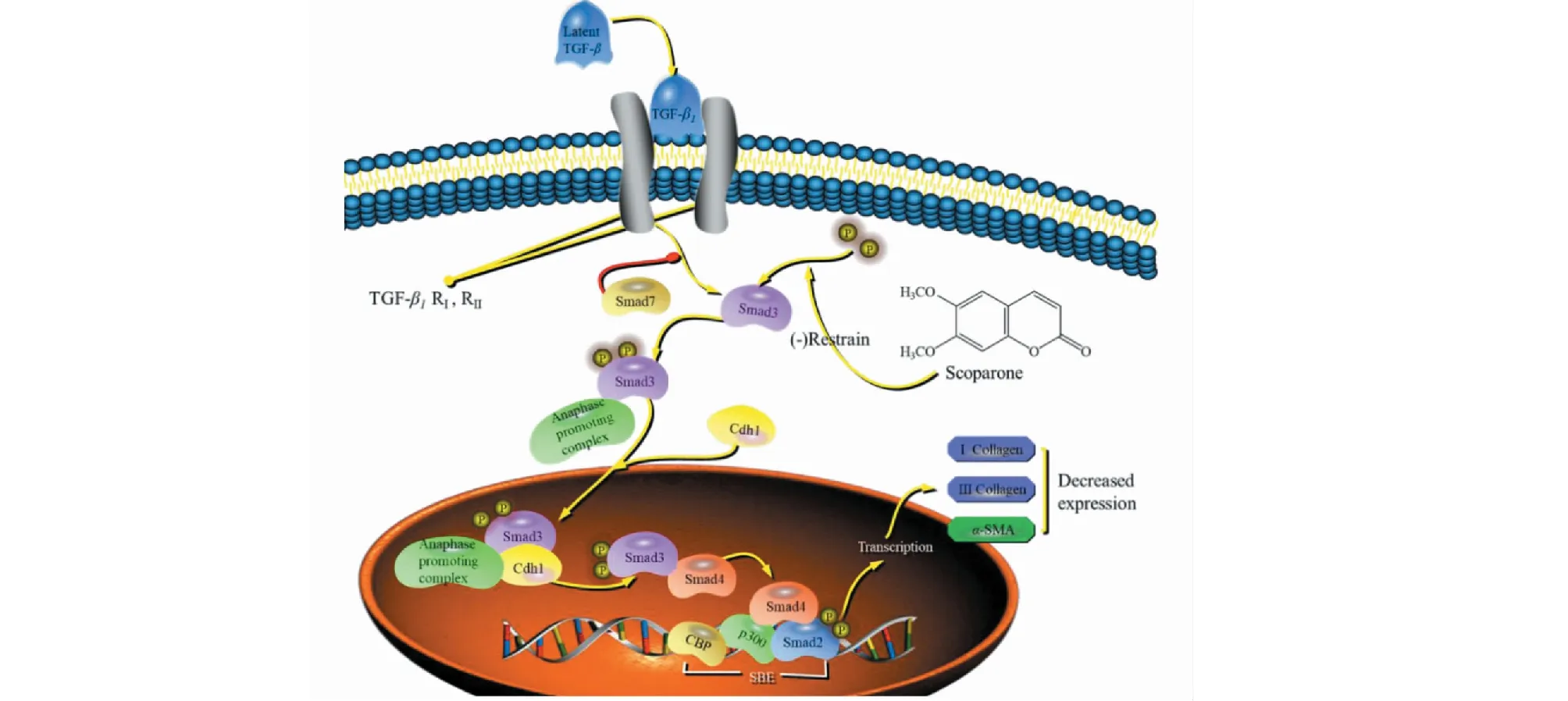
圖8 6,7-二甲氧基香豆素在HSC-T6細胞TGF-β1/Smad3的調節過程
2.1.3 肝損傷
茵陳可以保護肝細胞膜,改善肝臟微循環,激活葡萄糖醛酸酶,通過直接作用于肝代謝酶系,減輕急性肝損傷反應。Zhang等[35]報道,6,7-二甲氧基香豆素能顯著地降低CCl4致急性肝損傷大鼠模型血清中ALT活性及組織中MDA水平,且6-methylesculetin、茵陳黃酮、茵陳色原酮對CC14誘導肝毒性也具有治療作用。Yang等[36]、Gao等[37]、Wang[38]和Liu等[34]研究和報道茵陳水提物與茵陳揮發油在CCl4/EtOH致急性肝損傷動物模型中,具有改善ALT、AST、MDA、TG、GSH、GSH-Px、SOD、CAT、ALDH、ADH水平的作用,增強肝臟抗損傷、抗氧化能力和清除乙醛的能力(相關機制見圖9)。
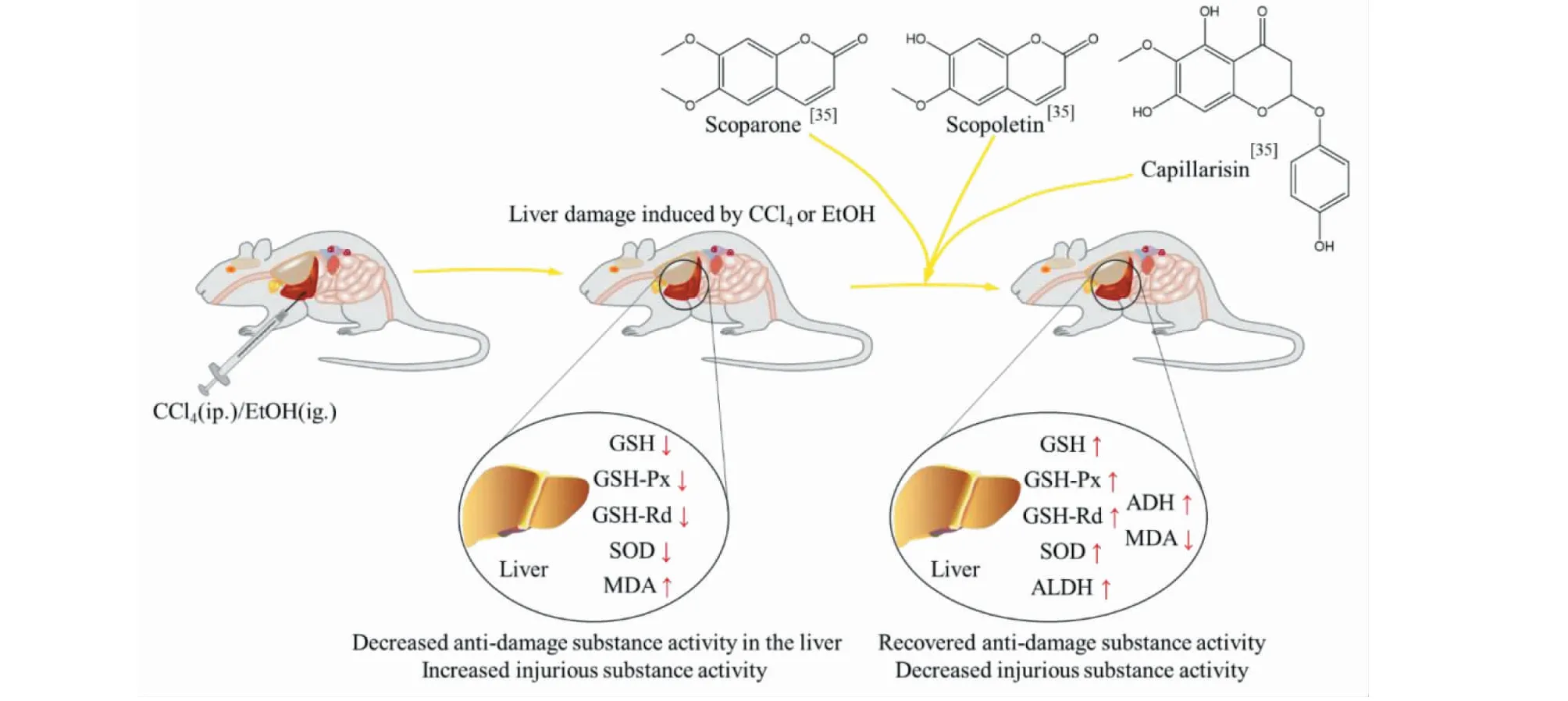
圖9 茵陳單體化合物對CCl4/EtOH致肝損傷小鼠的保護作用
2.2 抗炎作用
Tian[39]發現Quercetin-7-O-α-L-rhamnoside具有抑制巨噬細胞RAW264.7釋放致炎因子一氧化氮(nitrous oxide,NO)并抑制炎癥反應信號轉導的活性。Ryu等[40]和Lu等[41]研究發現6,7-二甲氧基香豆素可通過p38-MAPK途徑和PI3K/Akt/NF-κB通路,抑制促炎因子的表達與釋放,具有預防治皮膚光老化和抗骨關節炎的能力。Khan等[42,43]研究表明,茵陳色原酮也可作用于NF-κB通路,減少iNOS、COX-2、TNF-α的表達,腹腔注射茵陳色原酮還能顯著抑制小鼠足底注射完全弗氏佐劑(complete Freund’s adjuvant,CFA)引發的炎癥反應。Nam等[44]發現3,5-O-dicaffeoylquinic acid可降低caspase-1活性,顯著下調胸腺基質淋巴生成素的表達水平,阻斷NF-κB通路,改善肥大細胞介導的炎癥性疾病,如特應性皮炎[45](機制見圖10)。
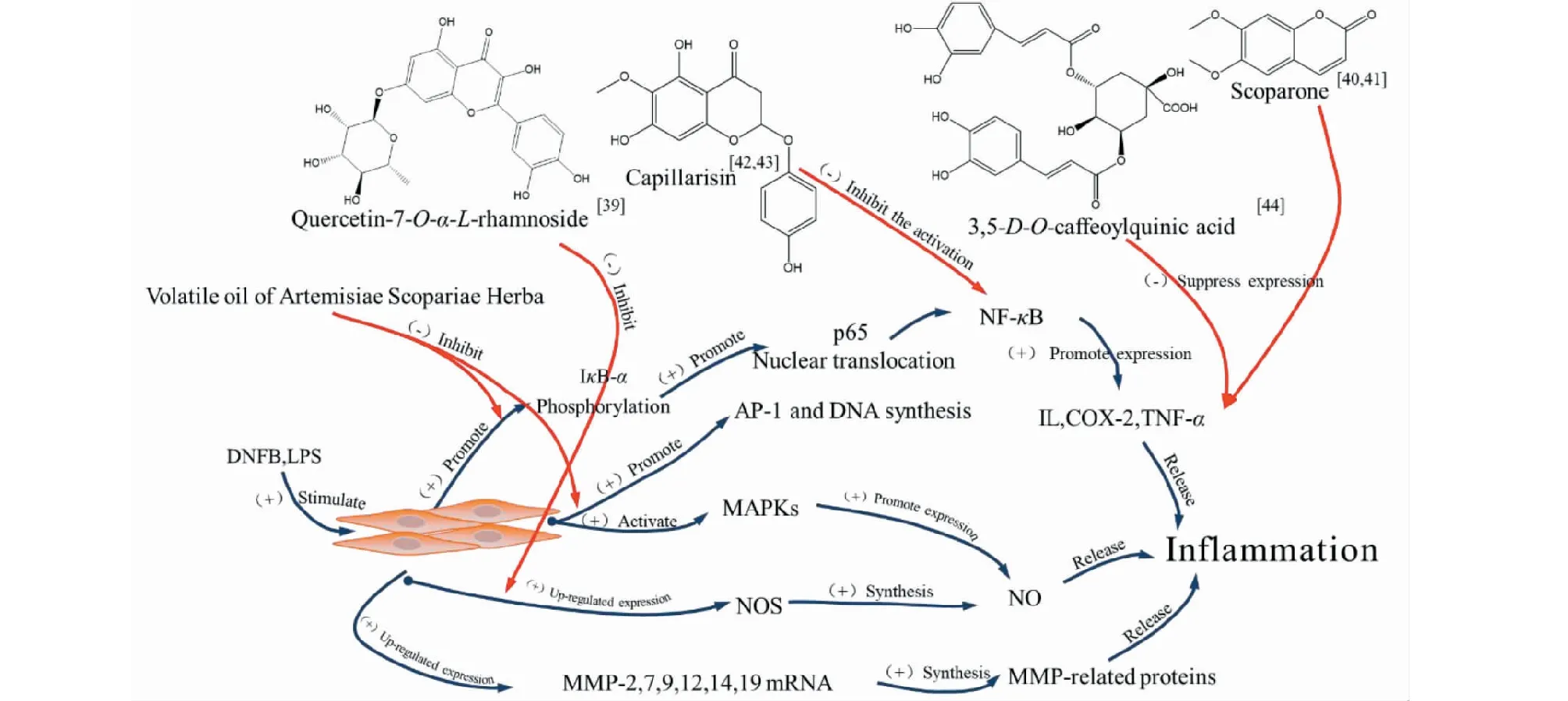
圖10 茵陳提取物及其單體組分對細胞炎癥的調節機制
2.3 抗腫瘤作用
Wu[46]經過體外研究發現大黃酸具有抗HepG2肝癌細胞增殖作用,而綠原酸和大黃酸具有抗ACHN人腎癌細胞增殖作用。Liu[47]通過抗腫瘤實驗發現6,7-二甲氧基香豆素能影響sacoma180移植性BALB/c小鼠腫瘤模型caspase-3蛋白活性,增強Bax基因表達水平,具有強抑制作用。Jang等[48]還發現6,7-二甲氧基香豆素能通過抑制IκB-α磷酸化與抑制NF-κB亞基蛋白移位,從而降低U937細胞IL-8和單核細胞趨化蛋白1(monocyte chemoattractant protein-1,MCP-1)的表達。Tsui等[49]研究表明,茵陳色原酮通過調整抑癌基因p21、p27的表達,改變細胞周期蛋白(monocyte chemoattractant protein,Cyclin)D1、A和B的表達量,并通過IL-6/STAT3通路,使癌細胞生長停滯,對前列腺癌細胞具有一定抑制作用。Masuda等[50]、Cha等[51]和Lee等[52]經細胞實驗發現,茵陳二炔酮能激活JNK通路,HL-60細胞線粒體釋放細胞色素C,誘導產生細胞毒性并導致細胞凋亡,由此推測茵陳二炔酮可能是一種潛在的抗癌藥物。Wu等[53]分離得到茵陳中的一種水溶性多糖(water-soluble polysaccharide,WACP),經實驗證實WACP能使線粒體釋放細胞色素C并活化caspase-3、caspase-9基因,誘導人鼻咽癌CNE-2細胞發生線粒體途徑凋亡。Yan等[54]發現茵陳乙酸乙酯部分也能改變線粒體膜電位,上調caspase-3表達水平,下調凋亡抑制基因Survivin、XIAP、Mcl1的表達,阻斷PI3K/AKT/mTOR信號通路,誘導肝癌細胞(hepatoma carcinoma cell,HCC)凋亡,抑制其生長遷移。Jung等[55]通過實驗發現茵陳乙酸乙酯部分能降低缺氧誘導因子-1和血管內皮生長因子(vascular endothelial growth factor,VEGF)的表達,抑制HCC的生長與血管生成。Jang等[56]發現茵陳提取物能夠通過IL-6/STAT3途徑,對HCC和W4P-NIH3T3起抑制作用。Kim[57]等研究發現茵陳氯仿部位主要成分樟腦和冰片對7,12-二甲基苯并蒽(dimethylbenzanthracene,DMBA)誘發小鼠表皮皮膚癌具有強烈的抑制作用。Woo等[58]經過實驗表明茵陳乙醇部分能通過下調酪氨酸酶(tyrosinase,TYR)、酪氨酸酶相關蛋白-1、-2(tyrosinase-associated proteins -1 and -2,TRP-1 and -2)等黑色素特異性蛋白的表達,抑制α-MSH誘導B16F10黑素瘤細胞的增殖(機制見圖11)。
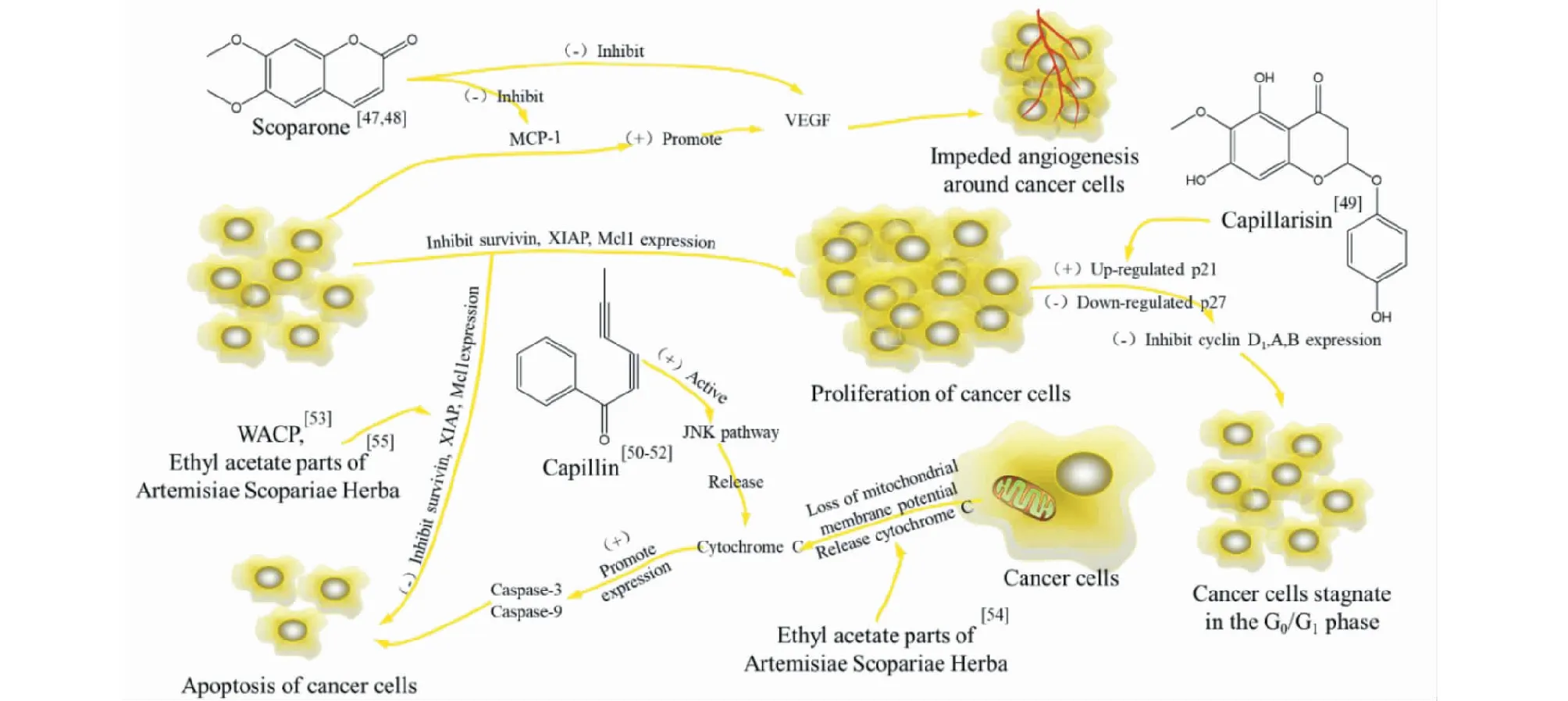
圖11 茵陳提取物及其單體組分對癌細胞/組織的調節機制
2.4 平喘作用
Cui[59]和Lin[60]研究發現加味茵陳蒿湯通過改善體內IL-10、IL-17表達與Th17/Treg失衡,在治療兒童濕熱哮喘持續期具有較高的安全性。Liu[61]和Lv[62]通過實驗發現,6,7-二甲氧基香豆素可上調支氣管哮喘豚鼠TSMC RyR2的表達,改善IFN-γ、IL-4、IgE的水平進而抑制哮喘。此外,Fang[63]和Chi[64]還發現,6,7-二甲氧基香豆素下調哮喘豚鼠血漿中IL-5、IL-2和肺組織細胞溶酶體磷脂酶A2(lysosomal phospholipase A2,PLA2)的含量,并在體外抑制豚鼠脾淋巴細胞轉化,是通過免疫學途徑抑制哮喘的途徑之一(機制見圖12)。
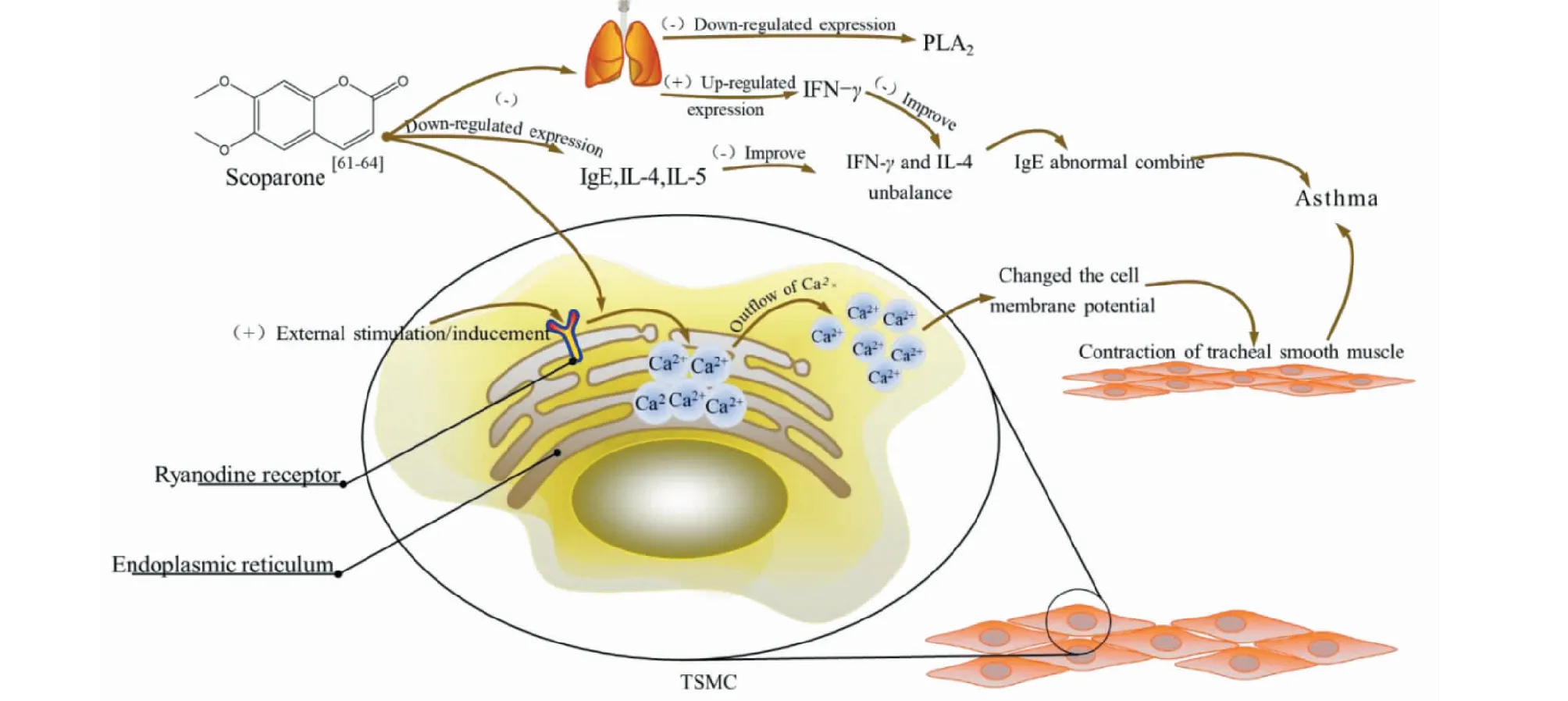
圖12 6,7-二甲氧基香豆素對哮喘豚鼠氣管平滑肌細胞的調節
3 茵陳的臨床應用
茵陳在臨床上多以復方的應用為主,主要包括以茵陳為“君藥”的茵陳蒿湯(由茵陳、大黃、梔子組成)、茵陳五苓散(由茵陳蒿、茯苓、澤瀉、豬苓、桂枝、白術組成)、茵陳四逆湯(由甘草、茵陳蒿、干姜、附子組成)等。臨床研究表明,茵陳復方多通過影響患者體內肝膽功能,如ALT、AST等水平,廣泛用于肝膽疾病的治療,如新生兒黃疸、肝炎、肝內膽汁淤積癥等(表5)。
4 結語
綜上所述,茵陳所含化學成分復雜,具有多種生物活性。近年來,國內外學者多圍繞其復方及單體化合物的藥理作用、生物活性及臨床方面開展較為深入的研究,歸納如下:①茵陳及其單體化合物可調控PI3K/Akt/NF-κB等信號通路,影響caspase-1、Smad3等蛋白和iNOS、COX-2、TNF-α等細胞因子的表達,發揮其保肝利膽、退黃利濕、抗炎、抗病毒、抗腫瘤和神經系統等藥理活性;②茵陳的臨床應用多以復方為主,如古方“茵陳蒿湯”、“茵陳五苓散”、“茵陳四逆湯”等,常用于肝膽疾病的治療。隨著研究的不斷深入,茵陳的藥理作用和功能主治將更加明確,這對指導臨床用藥和新藥開發是非常有必要的。但對茵陳的研究也存在以下問題:①目前茵陳的相關基礎研究較薄弱,如治療黃疸、利膽及其有效單體的相關機制和毒理研究較少;②對其主要單體及經典復方的藥理活性研究還不夠深入,構效關系不明確,有效成分的作用機制未能闡明,如復方多集中于肝膽疾病的治療,對其他疾病的研究較少。因此,今后應當加強其藥效學基礎及其相關分子機制的系統研究,或進行復方聯合治療的詳細研究,以促進茵陳單體及其復方制劑的研究開發與臨床應用的推廣。

