隱匿性腫瘤細胞在pN0期胃癌患者中的檢出率及對預后的影響
葉嬋娟 吳仲平 陳仲華
區域淋巴結轉移是影響胃癌患者預后的重要因素[1]。部分早期胃癌患者即使接受了根治性胃切除術,仍然會在短期內出現復發或轉移。Liu等[2]的研究顯示,淋巴結轉移陰性(pN0)胃癌患者的復發率為28%~47%。因此,當采用傳統的蘇木精-伊紅(HE)染色評估胃癌患者的淋巴結病理分期(pN)時,部分被診斷為pN0期的患者臨床分期可能被低估。隱匿性腫瘤細胞(OTC)可能在pN0期患者的復發中發揮了重要作用。淋巴結內的OTC根據腫瘤細胞群的直徑大小可分為微轉移(MM)和孤立腫瘤細胞(ITC)兩種[3]。目前,MM和ITC與胃癌患者預后的關系尚未明確。有研究認為淋巴結微轉移(LNMM)是影響胃癌復發的關鍵因素,并提出腫瘤細胞的高增殖活性可能促進腫瘤復發的假說[4]。Tavares等[5]綜合分析了24篇文獻后發現,大部分研究認為OTC與胃癌患者的預后不良存在相關性,但目前OTC在中國人群中仍缺少相關研究數據。本研究探討了OTC在pN0期胃癌患者中的檢出率及對預后的影響,旨在為進一步改善早期胃癌患者的預后提供更多依據。
1 對象與方法
1.1 研究對象
本研究為回顧性隊列研究,選擇2010年1月至2015年1月浙江金華廣福腫瘤醫院收治的73例pN0期胃癌患者作為研究對象。納入標準:(1)接受根治性手術,手術方式包括全胃切除或部分R0胃切除、D2淋巴結清掃;(2)無遠處轉移或淋巴結轉移的臨床證據;(3)未接受過新輔助化學治療或放射治療。排除標準:(1)因手術并發癥死亡或失訪;(2)臨床資料或隨訪資料不完全。73例患者中,男性35例,女性38例,年齡36~81歲,平均年齡為(63.5±11.5)歲。本研究獲得醫院醫學倫理委員會批準。
1.2 臨床資料收集及隨訪
通過本院電子病歷系統獲取患者的臨床資料。所有納入的患者均根據方案進行了系統的隨訪,包括對臨床病史、體檢及血細胞計數的完整評估。所有患者均通過門診或電話隨訪,隨訪截止時間為2019年12月,術后第1年每3個月隨訪1次,從術后第2年開始,每6個月隨訪1次,直至患者死亡或隨訪截止。此外,定期或在臨床需要時進行影像學檢查(胸腹盆腔計算機斷層掃描)和內窺鏡檢查。主要臨床資料包括患者的年齡、性別和外科手術類型等,病理評估包括腫瘤的位置、大小、組織學類型、是否存在淋巴管浸潤或血管浸潤等。根據《日本胃癌處理規約》第14版將腫瘤發生部位分為胃上部、胃中部和胃下部。依據美國癌癥聯合委員會出版的第8版《AJCC腫瘤分期手冊》中的TNM分期標準進行腫瘤分期。組織學類型按照Lauren分類系統分為腸型或彌漫型[6]。
1.3 OTC的定義及免疫組織化學檢測
根據第8版《AJCC腫瘤分期手冊》,淋巴結陽性的OTC樣本根據腫瘤細胞群的大小被分類為MM或ITC。MM被定義為直徑在0.2~2.0 mm的腫瘤細胞群;ITC被定義為最大直徑<0.2 mm的腫瘤細胞群,通常缺乏間質反應。每例淋巴結樣本在不同水平上進行3個切片,所有手術標本均經10%福爾馬林固定,石蠟切片,厚度為4 μm,標本先經HE染色,若判斷為陰性淋巴結,則再行角蛋白抗體AE1/AE3免疫組織化學染色。組織切片脫蠟,梯度乙醇脫水,微波10 min進行抗原修復,然后與抗AE1/AE3一抗(1∶50稀釋)孵育過夜,將生物素標記的二抗和辣根過氧化物酶標記的親和素與樣品共同孵育,DAB法染色。免疫組織化學染色的淋巴結切片由兩位觀察者分別評估,以出現棕黃色顆粒為陽性染色。根據染色結果將患者分為3組:無OTC組(n=43)、MM組(可同時合并ITC,n=20)和ITC組(n=10)。
1.4 統計學分析
所有數據均采用SPSS 20.0軟件進行統計學分析。計數資料以例(%)表示,計量資料以均數±標準差表示。Kolmogorov-Smirnov(K-S)檢驗用于正態分布檢驗,Levene檢驗用于方差齊性檢驗。采用卡方檢驗和Fisher檢驗來評估分類變量之間的相關性,采用t檢驗評估數值變量的相關性。生存情況采用Kaplan-Meier法分析,Log-rank檢驗分析組間生存差異。使用Cox比例風險模型分析影響患者生存率的因素。
2 結果
2.1 患者的臨床病理特點
本研究共納入73例pN0期胃癌患者,其中49%的腫瘤位于胃下部,36%的患者為T1期,腫瘤以腸腺癌為主(66%),淋巴管浸潤占44%,血管浸潤占47%。24例患者(33%)出現復發,全組病死率為27%。在復發的患者中,14例出現局部病變,7例發生遠處轉移,3例兩種情況同時發生。由表1可知,OTC與患者的復發、死亡顯著相關。
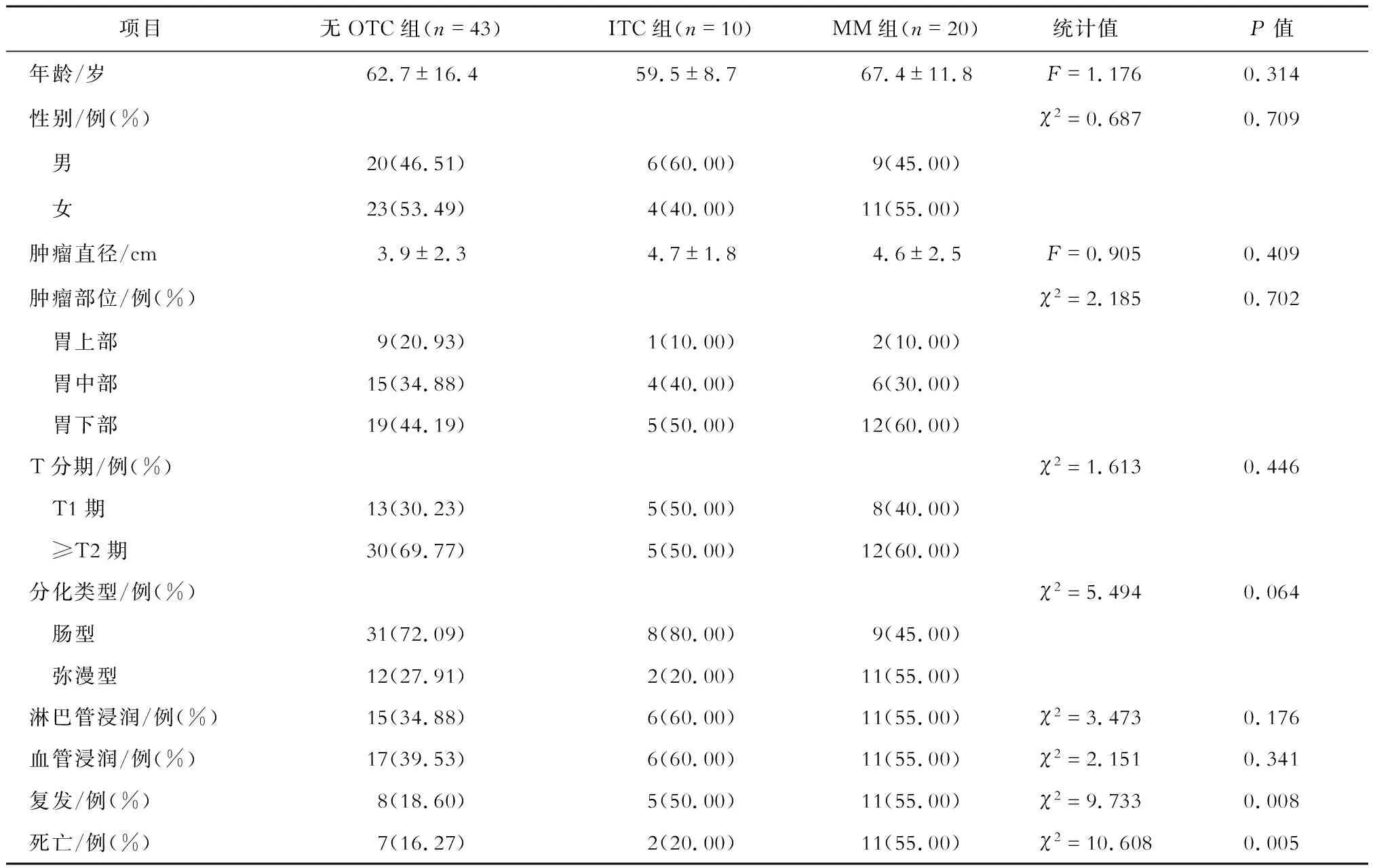
表1 各組患者的臨床病理特點
2.2 OTC免疫組織化學染色結果
73例患者中有30例(41%)檢測出OTC,其中20例檢測出MM(18例合并ITC),10例僅檢測出ITC。術中共分離出1 257枚淋巴結,其中90枚淋巴結顯示有OTC,陽性率約為7%。MM出現在38枚淋巴結中,ITC出現在83枚淋巴結中。在20例MM陽性患者中,受累淋巴結數目為70枚,平均每例患者3.5枚。在10例僅有ITC的患者中,受累淋巴結數目為20枚,平均每例患者2.0枚。具體見圖1。
2.3 MM和ITC陽性淋巴結數目與臨床病理特征的關系
臨床病理分析顯示,MM陽性淋巴結數目與胃癌分化類型、淋巴管浸潤發生率密切相關(P<0.05),彌漫型、合并淋巴管浸潤的胃癌患者淋巴結MM陽性率明顯較高(P<0.05)。ITC陽性淋巴結數目與T分期、淋巴管浸潤發生率密切相關(P<0.05),T分期較高、合并淋巴管浸潤的胃癌患者淋巴結ITC陽性率明顯較高(P<0.05)。見表2。

圖1 OTC免疫組織化學染色圖 SP法 ×400 A MM陽性 B ITC陽性
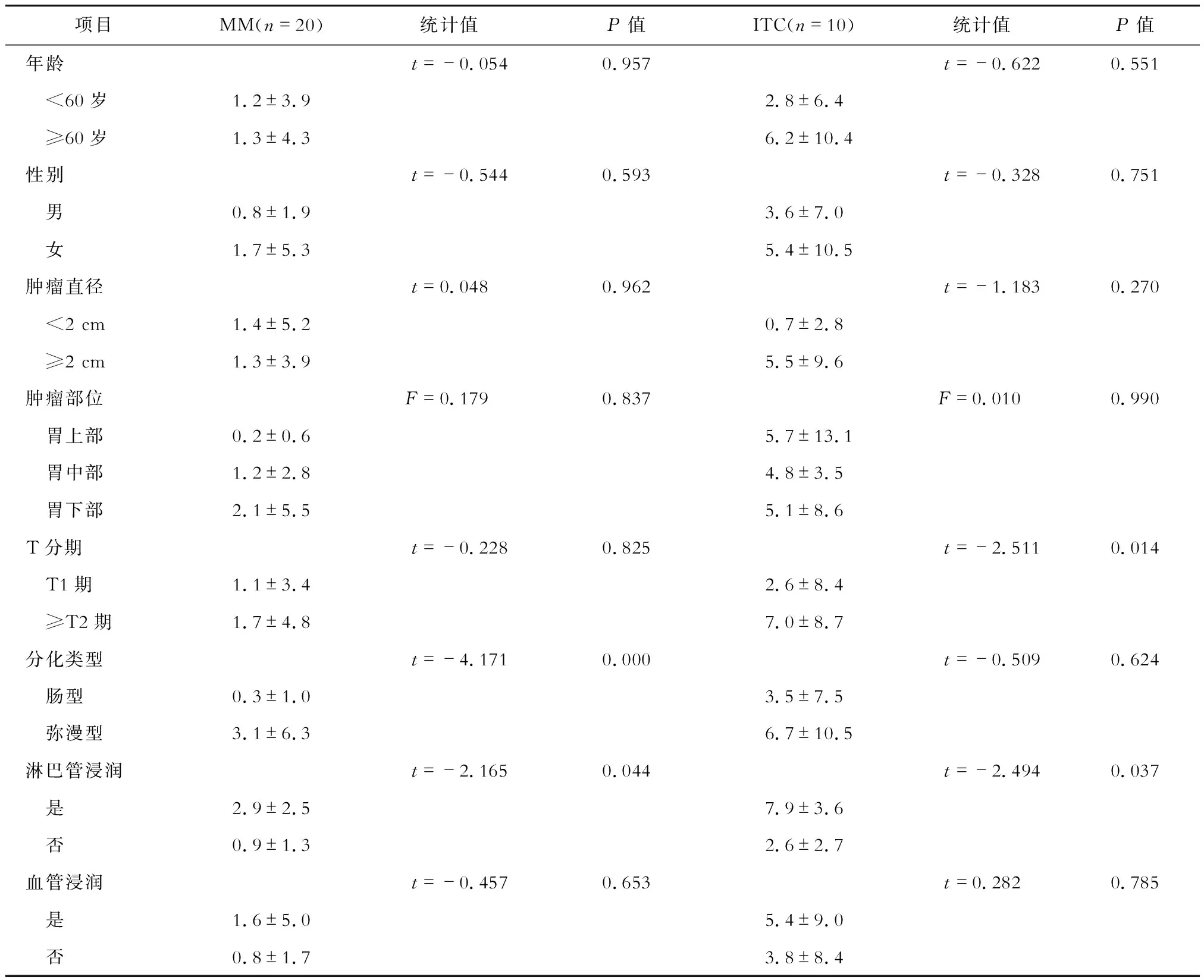
表2 MM和ITC陽性淋巴結數目與臨床病理特征的關系/枚
2.4 影響患者生存率的Cox多因素分析
隨訪結果顯示有20例患者死亡,病死率為27%。將臨床病理特征納入Cox回歸分析,單因素分析結果顯示,腫瘤直徑、分化類型、淋巴管浸潤、OTC、MM、ITC可能是影響患者預后的因素;多因素分析結果顯示,腫瘤直徑、分化類型、淋巴管浸潤、OTC、MM、ITC均是影響患者生存率的獨立危險因素。見表3。
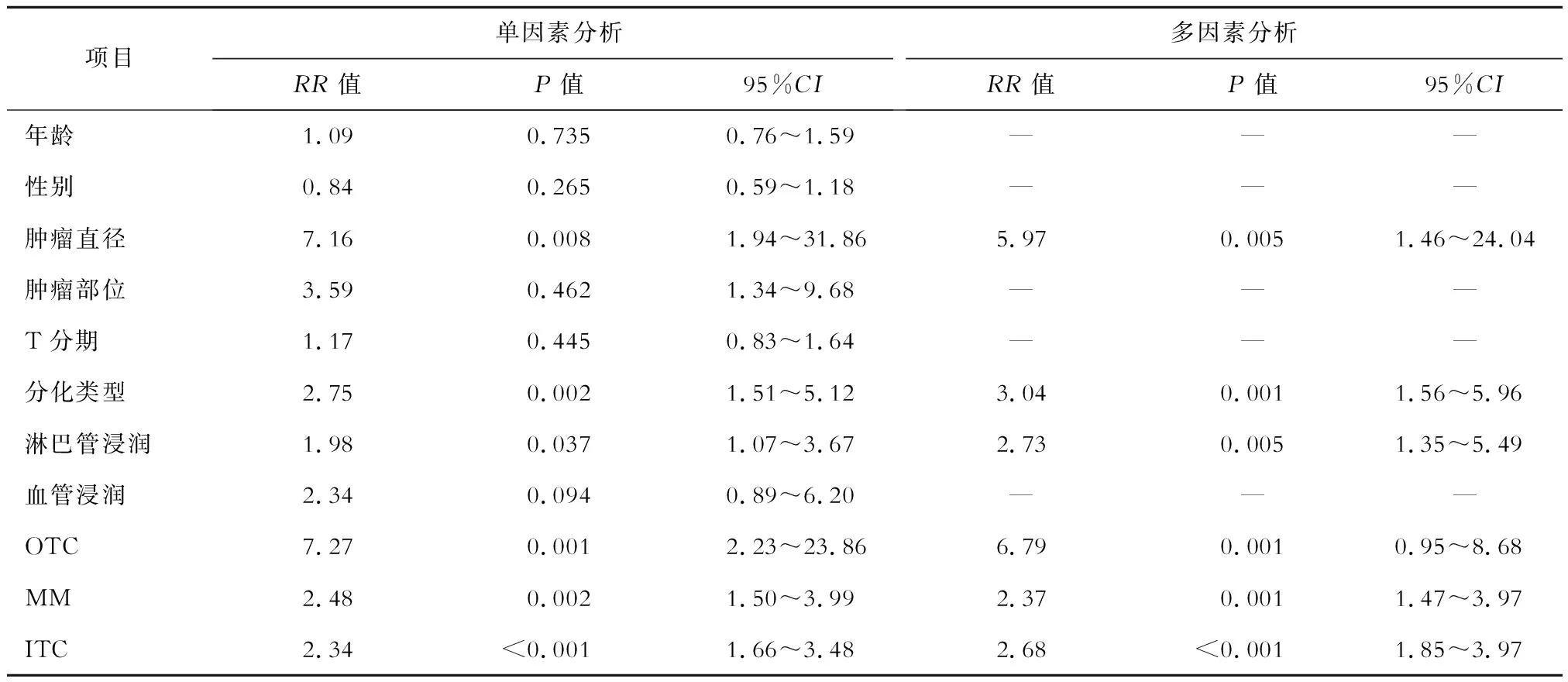
表3 影響患者生存率的Cox多因素分析
2.5 不同OTC狀態患者的生存率比較
73例患者的中位生存時間為84個月,OTC陽性組的中位生存時間為68個月,其中ITC陽性組為73個月,MM陽性組為63個月,而OTC陰性組為93個月。Log-rank檢驗結果顯示,OTC陰性組患者的生存率顯著高于OTC陽性組(χ2=8.146,P=0.004)。對OTC陽性組進一步行亞組分析,結果發現OTC陰性組、ITC陽性組及MM陽性組患者的生存率存在顯著差異(χ2=11.12,P=0.003);兩兩比較后發現,ITC陽性組及MM陽性組的生存率均顯著低于OTC陰性組(P均<0.05)。見圖2。
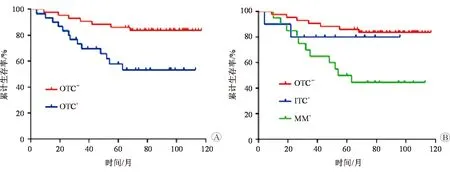
圖2 不同OTC狀態患者的生存率比較 A OTC陽性組、OTC陰性組患者的生存曲線 B OTC陰性組、ITC陽性組及MM陽性組患者的生存曲線
3 討論
在過去的30年里,多個版本的TNM分期系統對胃癌淋巴結的分期標準進行了調整。第8版《AJCC腫瘤分期手冊》將胃癌T1N3bM0期和T2N3bM0期分別歸類為ⅡB期和ⅢA期,T3N3bM0被重新歸類為ⅢB期,強調了術中足夠數量淋巴結清掃的重要意義,相較于之前版本突出了淋巴結轉移等特殊轉移方式潛在的臨床價值,但仍然未將OTC納入分期系統的考慮因素,這主要是由于目前相關研究結論尚存在爭議。目前檢測胃癌淋巴結中OTC常用的單克隆抗體為AE1/AE3[7]。Cai等[8]的研究發現,在被診斷為pN0期胃癌的患者中,仍有34%的患者檢測出OTC陽性。Miyake等[9]報道指出,將每枚淋巴結的切片數量增加至3片,可以獲得與反轉錄-聚合酶鏈反應(RT-PCR)法相近的敏感度。因此,本研究選擇在每枚淋巴結的不同水平上進行3個切片,以保證檢測結果的準確度。Horstmann等[10]的研究表明,pN0期胃癌患者中OTC的陽性率可達59%,提示傳統的HE染色法嚴重低估了pN0期胃癌患者的分期。本研究結果顯示,MM的檢出率為27%,ITC為38%,且OTC的存在與臨床病理特征有關,提示OTC與腫瘤的發生、發展存在相關性。
邊緣淋巴竇是淋巴循行通道,是淋巴從輸入管進入淋巴結的必經之路,也是淋巴結抵御腫瘤細胞侵襲的門戶。Harrison等[11]分析了pT1~4N0期腫瘤患者的5年生存率后發現,與免疫組織化學染色顯示淋巴結陰性的患者相比,淋巴結陽性患者的5年生存率顯著降低。Yonemura等[12]的研究顯示,早期胃癌中ITC的增殖率為46.6%,提示ITC的存在與預后不良有關。但也有部分研究認為OTC與患者預后之間沒有相關性。Fukagawa等[13]的研究納入了107例pT2~3N0期胃癌患者,結果表明LNMM的存在對患者的5年生存率和10年生存率均無顯著影響;Morgagni等[14]的研究納入了300例pN0期胃癌患者,同樣發現患者的5年生存率和10年生存率均不受LNMM的影響。本研究結果顯示,67%的復發患者合并有OTC,無OTC的pN0期患者與合并MM者的中位生存時間的差異具有統計學意義。在73例pN0期胃癌患者中有20例有MM,10例僅有ITC;生存分析結果表明,OTC對患者生存率有顯著不良影響。因此,本研究更傾向于在進行胃癌分期及預后判斷時,將OTC作為一項重要的參考因素。胃切除加區域淋巴結清掃是目前胃癌的標準手術方法。然而,較大的手術范圍與患者生活質量的長期下降有關。淋巴結轉移一般發生在前哨淋巴結。有研究指出,如果所有的前哨淋巴結都沒有腫瘤轉移,根據術中診斷,患者應接受有限的胃切除術,如部分或節段性胃切除加淋巴結清掃;但對于前哨淋巴結轉移陽性的患者,標準的胃切除加區域淋巴結清掃是十分必要的[15]。OTC的存在將對患者的預后產生重大影響,可直接影響治療策略的選擇,因此檢測OTC具有重要意義。
綜上所述,部分pN0期胃癌患者淋巴結中OTC的檢出率較高,這對患者的預后有明顯不良影響,應在胃癌淋巴結評估中將OTC作為考慮因素。

