脂蛋白(a)、同型半胱氨酸、超敏C反應蛋白和頸動脈內膜中層厚度與高血壓合并冠心病相關性研究
王丹,殷曉明,唐文娟,朱紅娟,常雙,周航
(安徽醫科大學附屬安慶醫院,a 老年病科,b 全科,安慶 246000)
高血壓并發冠心病的概率約為20%,對居民健康造成嚴重威脅[1-2]。研究顯示,頸動脈內膜中層厚度(IMT)與冠狀動脈病變嚴重程度存在相關性[3],頸動脈內膜中層厚度可以間接地反映全身動脈(包括冠狀動脈)粥樣硬化的程度[4]。目前關于高血壓或冠心病與脂蛋白(a)[LP(a)]、同型半胱氨酸(Hcy)、超敏C反應蛋白(hs-CRP)和IMT等因素之間關系的研究較為集中,而高血壓合并冠心病與這些因素之間關系的研究相對較少。本研究旨在發現LP(a)、Hcy、hs-CRP和IMT與高血壓合并冠心病患者的相關性。
1 對象與方法
1.1 研究對象 選取2019年6月至2020年1月在安徽醫科大學附屬安慶醫院門診就診或住院治療的原發性高血壓患者145例,根據是否合并冠心病分為原發性高血壓組(對照組)70例和原發性高血壓合并冠心病組(觀察組)75例。兩組患者的性別、年齡等一般資料差異無統計學意義(P>0.05),具有可比性(見表1)。本研究已取得安徽醫科大學附屬安慶醫院倫理委員會批準,受試者均知情同意。
1.2 診斷與排除標準 診斷標準:高血壓病診斷標準:根據《中國高血壓防治指南(2018修訂版)》標準[5],服用降壓藥物或在未使用降壓藥物的情況下,診室收縮壓≥140 mm Hg和(或)舒張壓≥90 mm Hg(1 mm Hg=0.133 kPa)。冠心病診斷標準:冠狀動脈造影檢查,觀察冠脈左主干、左前降支、左回旋支及右冠狀動脈的狹窄程度,按照美國心臟病學會和美國心臟協會冠狀動脈造影指南[6],當某一根冠脈狹窄≥50%則被診斷為冠心病。排除標準:繼發性高血壓、1個月內服用過葉酸、B族維生素等影響Hcy代謝的藥物、1個月內服用過影響脂蛋白(a)的調脂藥物、糖尿病、腎病、呼吸系統疾病、免疫性疾病、腫瘤、嚴重肝腎功能損害、嚴重感染等其他慢性病史、神志不清、昏迷者。
1.3 實驗室檢查 所有受試者均在清晨、空腹8 h狀態抽取靜脈血3 mL,所有標本由專業人員采集及保存,經離心后分離出上層血清進行檢測,采用羅氏cobas 8000全自動生化分析儀檢測LP(a)、Hcy、hs-CRP。
1.4 頸動脈超聲檢查 選擇深圳邁瑞mindrayDC-8彩色多普勒超聲儀行頸部血管超聲檢查,患者取仰臥位,探頭頻率為3~12 MHz,對頸總動脈、頸總動脈分叉處進行掃查,并記錄頸總動脈主干及分叉處IMT,多次測量取平均值。IMT<1.0 mm表示厚度正常,1.0 mm≤IMT<1.2 mm表示增厚,IMT≥1.2 mm表示斑塊形成。
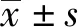
2 結果
2.1 血清LP(a)、Hcy、hs-CRP、IMT水平的比較 LP(a)、Hcy、hs-CRP平均水平及頸總動脈左主干、左分叉、右主干、右分叉內膜中層厚度見表1。其斑塊形成的比例分別為10例(6.9%)、50例(34.5%)、17例(11.7%)、52例(35.9%)。觀察組的LP(a)、Hcy、hs-CRP、IMT水平及斑塊形成的比例高于對照組,差異均有統計學意義(P<0.05),見表1。

表1 兩組一般資料和血清LP(a)、Hcy、hs-CRP、IMT及斑塊比例的比較
2.2 LP(a)、Hcy、hs-CRP、IMT與高血壓合并冠心病關系的多因素分析 如表2所示,以高血壓病是否合并冠心病為因變量(合并=1,未合并=0),以LP(a)、Hcy、hs-CRP、IMT為自變量,進行多因素logistic回歸分析。在調整年齡、性別后,LP(a)(OR=1.02,P<0.001)、Hcy(OR=1.30,P<0.001)、hs-CRP(OR=4.73,P<0.001)與高血壓合并冠心病呈正相關,且納入IMT變量后,正相關關系仍有統計學意義。
在調整年齡、性別后,IMT中左主干(OR=154.97,P<0.001)、左分叉(OR=52.74,P<0.001)、右主干(OR=183.64,P<0.001)、右分叉(OR=77.31,P<0.001)均與高血壓合并冠心病呈正相關。斑塊形成組與高血壓合并冠心病相關性,其中左分叉(OR=4.83,P<0.001)、右主干(OR=9.34,P<0.001)、右分叉(OR=5.88,P<0.001)均為危險因素,但調整LP(a),Hcy,hs-CRP后,該正相關不具有統計學意義,見表2。

表2 LP(a)、Hcy、hs-CRP、IMT與高血壓合并冠心病的logistic回歸分析
3 討論
目前,高血壓和冠心病嚴重威脅我國居民健康,給患者家庭、社會造成了沉重負擔[4]。本研究結果表明,在高血壓合并冠心病組的患者中,其血清LP(a)水平高于單純高血壓患者。由于LP(a)中同時含有LDL顆粒及載脂蛋白(a),故相較于等量的LDL,LP(a)致動脈粥樣硬化的作用更顯著,當LP(a)≥300 mg/L,動脈硬化的危險性上升2倍[7]。
此外,LP(a)其結構與血漿纖溶酶原高度同源,故它可以與纖溶酶原共同競爭血管內皮細胞表面的受體,抑制其激活,從而延緩血栓溶解和血管壁損傷的修復,導致動脈粥樣硬化進程加快[8-9]。
本研究結果表明,在高血壓合并冠心病組的患者中,血清Hcy水平高于單純高血壓患者。有研究[10-11]結果顯示:高血壓合并冠心病組的患者血清Hcy水平明顯高于單純高血壓患者,本研究結果與之一致。血清中Hcy水平升高導致動脈發生粥樣硬化的機制可能為:通過影響血管內皮細胞功能,在其代謝過程中Hcy發生自身氧化,引起過多強氧化劑的產生,導致血管內皮細胞的功能及其結構的損害,引起內皮細胞的凋亡;Hcy使得巨噬細胞對LDL的攝取增加,并使脂肪加快在血管壁的黏附;Hcy能使血管平滑肌細胞增生、使血管內皮細胞的生長受到抑制[12];Hcy能使NO的活性降低,使膠原堆積的速度加快,能促進中性粒細胞和單核細胞黏附與內皮[13]。
本研究結果表明,在高血壓合并冠心病組的患者中,血清hs-CRP水平高于單純高血壓患者,hs-CRP對炎性反應的識別、預測斑塊和心血管事件的穩定性具有重要意義。hs-CRP是發生炎性反應產生的急性時相蛋白,也是臨床用于診斷人體非特異性炎性反應的敏感指標之一。hs-CRP是強烈的促炎性因子,可通過激活炎性反應,引發機體的氧化應激,使LDL-C氧化為氧化型低密度脂蛋白(OX-LDL)而直接損傷血管內皮細胞,也可通過下調血管內皮功能,加速血管炎性反應的過程,使冠狀動脈內的斑塊更不穩定,甚至破裂[14],導致一系列的病理和生理過程,如白細胞黏附、血小板活化和血栓形成。其血清水平高低在一定程度能夠反映冠心病患者冠狀動脈粥樣硬化程度[15],高濃度的hs-CRP可促進并加重動脈粥樣硬化。
頸動脈超聲檢查簡便無創,臨床易推行,相關研究表明,它可以作為心血管疾病患者治療效果評估的關鍵指標[16-20]。而本研究未納入LP(a)、Hcy、hs-CRP變量時,頸動脈IMT與高血壓病合并冠心病呈正相關,但納入這些變量后,未發現頸動脈IMT增厚及斑塊形成與高血壓合并冠心病的關聯性,顯示LP(a)、Hcy、hs-CRP對于高血壓合并冠心病的重要性可能大于頸動脈內膜中層厚度,由于頸動脈內膜中層厚度本身與LP(a)、Hcy、hs-CRP變量之間存在相關性,因此三者間的關系仍然值得進一步研究。
綜上所述,LP(a)、Hcy、hs-CRP均可能為高血壓病合并冠心病的獨立危險因素,這些指標目前在臨床上應用較為普遍,可作為預測心腦血管疾病發生、發展的重要指標,能幫助臨床醫生及時對疾病做出診斷并開展相應的診療活動,積極干預心腦血管疾病的發生發展,從而總體改善患者預后。

