杉木根際溶磷菌的篩選鑒定及溶磷能力分析
初 旭胡 霞劉 靜李亞超羅明燕李 明,
(1.福建農林大學林學院,福建 福州 350002;2.福建農林大學人工林可持續經營福建省高校工程研究中心,福建 福州 350002)
磷是植物生長發育不可缺少的營養元素[1],是植物進行光合作用、呼吸作用等物質和能量代謝等重要生命活動必不可少的營養元素。南方林地土壤對磷具有強烈的吸附固定作用,土壤磷大多以林木無法直接吸收利用的難溶性Fe?P、Al?P和閉蓄態磷的形式存在,導致土壤中全磷含量豐富而有效態磷素匱乏[2],林木呈現“遺傳學缺磷”現象。同時,生產上磷肥的大量施用不僅造成成本增加和環境污染,施入土壤中的磷肥也很容易重新被固定為難溶性磷,導致磷肥的當季利用率極低。杉木(Cunninghamia lanceolata)是我國特有的速生用材樹種,具有生長快、材性優、用途廣的特點,在我國南部18個省區廣泛栽培,其人工林面積和蓄積量均居我國人工林樹種的首位[3]。然而,長期的集約化純林經營導致杉木人工林地土壤中氮、磷等必需營養元素的大量消耗,生產上多代連栽的經營模式加劇了杉木人工林地力衰退,導致土壤有效磷缺乏成為杉木人工林產量和質量提升的重要限制因子[4-5]。
溶磷細菌是一類具有降解難溶性無機磷和有機磷的微生物[6]。溶磷菌在土壤中的分布具有明顯的植物根際效應,主要表現在根際土壤中的數量明顯高于非根際土壤數量,溶磷菌能夠定殖在植物根際周圍,并將土壤中難以被植物直接吸收利用的磷轉化為有效態的可溶性正磷酸鹽[7]。大量研究表明:植物根際溶磷菌可以通過分泌和產生有機酸、分泌質子、分泌胞外多糖,以及細胞壁的吸附作用等形式將土壤中的難溶性磷轉化為有效態磷,從而提高植物的磷素營養并促進植物生長[8]。當前國內外對于溶磷菌的研究包括利用溶磷菌對污染土地進行生態修復,高瓊等利用溶磷菌可對多種重金屬污染的農田進行修復[9-12];以及對具有不同特性溶磷菌的篩選,Sarikhani等從55 ℃處理16 h的土樣中篩選具有耐高溫特性的溶磷菌,對克服微生物肥料生產和儲存具有重要作用[13];此外還有對其他林木根際土壤的溶磷菌的篩選工作,王俊娟等從油松(Pinus tabuliformis)根際土壤中篩選出一株泛菌屬的溶磷細菌,對于增強土壤肥力,促進林木生長具有明顯作用[14]。宋賢沖等[15]從廣西馬尾松(Pinus massoniana)根際土壤中篩選出一株伯克氏菌,對磷酸三鈣具有較好的降解效果,而在杉木根際土壤的溶磷菌篩選報道甚少。李蓉等[16]對于杉木根際土壤的溶磷菌及其特性進行了初步研究,但并未對菌種進行分子鑒定以及測定菌種對其他難溶性磷的降解能力。本研究不僅篩選出了杉木根際土壤中的多種溶磷細菌,并測定了對3種不同難溶性磷的降解能力,同時揭示了杉木根際溶磷菌的最適溶磷條件,此外還發現了新型溶磷菌株?云南微球菌和孢子型乳酸菌。因此,篩選和鑒定能夠定殖在林木根際的溶磷細菌,并通過生物工程的方法制備微生物菌肥,是改善林木根際磷素營養環境,促進人工林可持續經營的一種有效途徑。
本研究從杉木根際分離和篩選溶磷細菌,并進行細菌的形態和分子鑒定。研究各溶磷菌株的溶磷能力,從而獲得具有優良溶磷能力的杉木根際細菌,為開發和利用適合杉木的溶磷微生物菌肥提供基礎。
1 材料與方法
1.1 樣品采集
采樣地位于福建省福州市南嶼國有林場,于2018年9月使用土鉆分別采集南坡和北坡10年生和20年生杉木人工林的根系,共采集20個樣點。將杉木細根抖落土壤后放入含純水的離心管中洗脫,存于冰盒運回實驗室,并于4 ℃冰箱保存。
1.2 試驗方法
1)培養基配置。利用含難溶性磷酸三鈣的固體PKO培養基篩選杉木根際溶磷細菌,內含有10 g/L葡萄糖,10 g/L Ca3(PO4)2,0.3 g/L MgSO4·7H2O,
0.3 g/L NaCl,0.3 g/L KCl,0.03 g/L FeSO4·7H2O,0.03 g/L MnSO4·4H2O,0.5 g/L(NH4)2SO4和15 g/L瓊脂粉,pH值為7.0~7.2。使用液體LB培養基保存菌株,內含有5 g/L酵母提取物,10 g/L胰蛋白胨,10 g/L NaCl,pH值為7.0~7.2[17]。
2)溶磷細菌的分離。使用搖床將杉木根際土壤洗脫液置于PKO液體培養基中,在30 ℃、180 r/min避光條件下進行富集,3 d后取上清液作為溶磷細菌的原始菌液,利用10倍梯度稀釋法配置成土壤懸液,加入純水依照蔡璐等的稀釋方法進行改進,稀釋至10?9[18],并分別取各個稀釋梯度菌液100 μL懸液涂布到PKO篩選培養基平板上。在30 ℃條件下避光培養5~10 d,觀察具有溶磷圈的菌落,待無新菌落產生后將溶磷菌落挑出培養在LB固體培養基上,并分離提純單菌落,以上步驟均設置3組重復[19-20]。
3)各菌株溶磷活性分析。將溶磷菌單菌落接種在PKO培養基上,30 ℃避光條件下培養7 d,觀察并測量各菌落產生的溶磷圈大小和菌落大小,計算各株菌落的圈徑比,設置3次重復,根據溶磷圈大小分析各菌株的溶磷能力。
4)細菌形態和分子鑒定。在光學顯微鏡下觀察獲得的溶磷菌菌落形態特征,通過革蘭氏染色觀察細菌菌體特征,利用鞭毛染色觀察細菌鞭毛著生位置和數目,參照《伯杰氏細菌鑒定手冊》[21]對細菌進行形態鑒定。采用Omega細菌DNA提取試劑盒提取細菌DNA,并使用通用引物fD1(AGAGTTTGATCCTGGCTCAG)和rP1(ACGGTTACCTTGTTACGACTT)PCR擴增各菌株的16S rDNA序列。PCR產物在福州鉑尚測序公司測序,獲得的堿基序列在NCBI數據庫Blast,篩選同源性高的序列使用軟件Clustalx 1.83進行比對,并利用MEGA 5.0軟件構建系統發育樹,鑒定目的菌株類別[22]。
5)溶磷能力測定。將溶磷菌單菌落接入液體LB培養基進行3 d的活化,在50 mL離心管中分別加入25 mL LB液體培養基并接種1 mL活化的不同菌種菌液,設置3組平行試驗,分別每組加入5 g/L的3種不同難溶性磷酸鹽(磷酸鋁,磷酸鐵和磷酸鈣),并設置不接種菌液為對照,在30 ℃,140 r/min搖床內避光振蕩培養。培養7 d后,將離心管在4 ℃和4 000 r/min下離心10 min,取上清液,使用鉬銻鈧比色法測定可溶性磷含量[23-24]。
6)溫度和pH值對菌株溶磷能力的影響。為分析環境溫度和pH值對獲得的溶磷菌株溶磷能力的影響,本試驗選取對磷酸鋁,磷酸鐵和磷酸鈣分別具有最強降解能力的3株菌株,測定其在20、25、30、40 ℃的菌液溫度和5~10的菌液pH下溶磷能力的變化,使用鉬銻鈧比色法測定菌液可溶性磷含量。
1.3 數據分析方法
試驗數據采用SPSS 22.0進行分析,差異顯著性分析采用F檢驗。
2 結果與分析
2.1 溶磷細菌菌株分離與鑒定
定期觀察涂布的PKO培養基平板,結果表明10?3、10?4梯度濃度下溶磷菌較多。試驗共初篩到10株具有溶磷能力的菌株,各菌株在接種1~2 d開始出現溶磷圈(圖1為CX?2、CX?7的溶磷圈),隨后溶磷圈迅速擴大,在6~7 d速度明顯下降,個別菌株溶磷圈停止增長。菌株溶磷活性分析顯示,10株菌株溶磷圈的直徑大小在多處于1.2~1.9 cm之間,溶磷圈直徑與菌落直徑之比在1.5~2.5之間,其中CX?2菌株具有最大圈徑比,培養7 d時的圈徑比為3.83(圖2)。
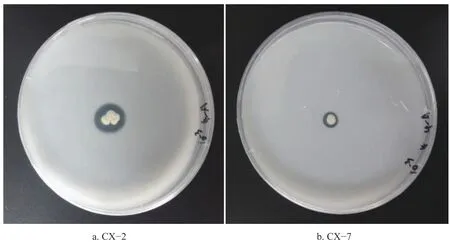
圖 1 土壤溶磷細菌溶磷圈Fig.1 Soil phosphorus dissolving bacteria phosphorus dissolving circle
對篩選獲得的10株溶磷菌進行形態鑒定和分子鑒定,結合顯示其分別隸屬于放線菌門、變形菌門和厚壁菌門細菌的5個菌屬、9個菌種(表1、圖3)。菌株CX?2隸屬于伯克氏菌科(Burkholderiaceae),副伯克氏菌屬(Paraburkholderia),抗金屬副伯克氏菌(Paraburkholder-ia metalliresistens)。菌株CX?9、CX?1和CX?6為孢子型乳酸菌(Sporolactobacillus laevolacticus)、熱帶伯克霍爾德菌(Burkholderia tropic)和海水芽孢桿菌(Bacillus aquimaris)。菌株CX?7隸屬于芽孢桿菌科(Bacillaceae),芽孢桿菌屬(Bacillus),蘇云金芽孢桿菌(Bacillus thuringi-ensis)。菌 株CX?3和CX?4為 洋 蔥 伯 克 氏 菌(Burkholderia cepacia)。菌株CX?5隸屬于微球菌科(Micrococcaceae),微球菌屬(Micrococcus),云南微球菌(Micrococcus yunnanensis)。菌株CX?8 為盧里達假單胞菌(Pseudomonas lurida),菌株CX?10為成團泛菌(Pantoea vagans)。
2.2 溶磷細菌菌株溶磷能力測定
對篩選所得的10株溶磷菌進行溶磷能力測定(磷標準曲線:c=1.869 9×A+0.003 2,R2=0.999 0,A為660 nm處樣品吸光度)。結果表明CX?7菌株對磷酸鋁具有較強的溶磷能力,較其他菌株差異顯著,溶磷量為157.5 mg/L,相對于對照組增加了12.12%;這一難溶性磷源,CX?5菌株對磷酸鐵具有較強的溶磷能力,較其他菌株差異顯著,但對于CX?2差異不顯著,溶磷量為135 mg/L,相對于對照組增加了10.38 %;CX?2菌株對磷酸鈣具有較強的溶磷能力,較其他菌株差異顯著,溶磷量為144 mg/L,相對于對照組增加了11.08 %(表2~4)。綜合表明CX?2菌株對難溶性鐵磷、鈣磷都具有較好的溶磷效果,而對于難溶性磷鋁磷,CX?7菌株則具有最好的溶磷效果。
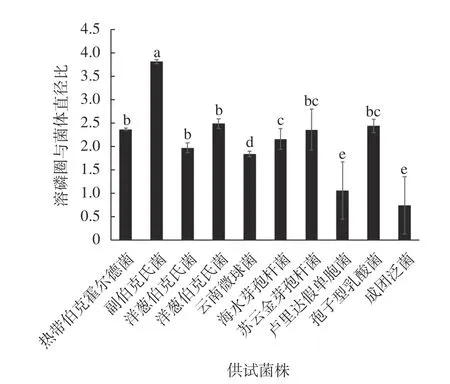
圖 2 土壤溶磷細菌降解磷酸三鈣產生的溶磷圈與菌落的直徑比率Fig.2 Ratio of diameter of dissolved phosphorus ring to colony produced by soil phosphate solubilizing bacteria

表 1 土壤溶磷細菌的形態鑒定Table 1 Morphological identification of soil phosphorus-dissolving bacteria
2.3 溫度和pH值對菌株溶磷能力的影響
本試驗測定了不同的溫度及pH培養條件下,CX?2、CX?5和CX?7分別對磷酸鈣、磷酸鋁和磷酸鐵的溶磷量變化曲線。結果顯示,pH值為6時各菌株的溶磷量對pH值為5時差異不顯著,對其余pH值呈顯著差異。CX?7對磷酸鋁的溶解能力在pH值為5時最高,CX?5對磷酸鐵的溶解能力在pH值為6時最高,CX?2對磷酸鈣的溶解能力在pH值為5和6時較高且差異不大(圖4)。隨著pH值的不斷變化,3株溶磷菌的溶磷能力均呈先上升后下降的趨勢,各菌株的最適溶磷pH值為5~6。溫度變化結果顯示,溫度為20~30 ℃時,各菌株溶磷能力差異不顯著。CX?7對磷酸鋁的溶解能力在20~30 ℃時較為穩定;CX?5在25 ℃時對磷酸鐵的溶解能力略有下降,在30 ℃溶磷能力達到最高;CX?2對磷酸鈣的溶解能力在25 ℃上升到最高,而后隨著溫度升高逐漸降低(圖5)。溫度超過30 ℃后,3株菌株的溶磷能力均呈現顯著下降的趨勢,且差異顯著,因此各菌株的最適溶磷溫度為20~30 ℃。
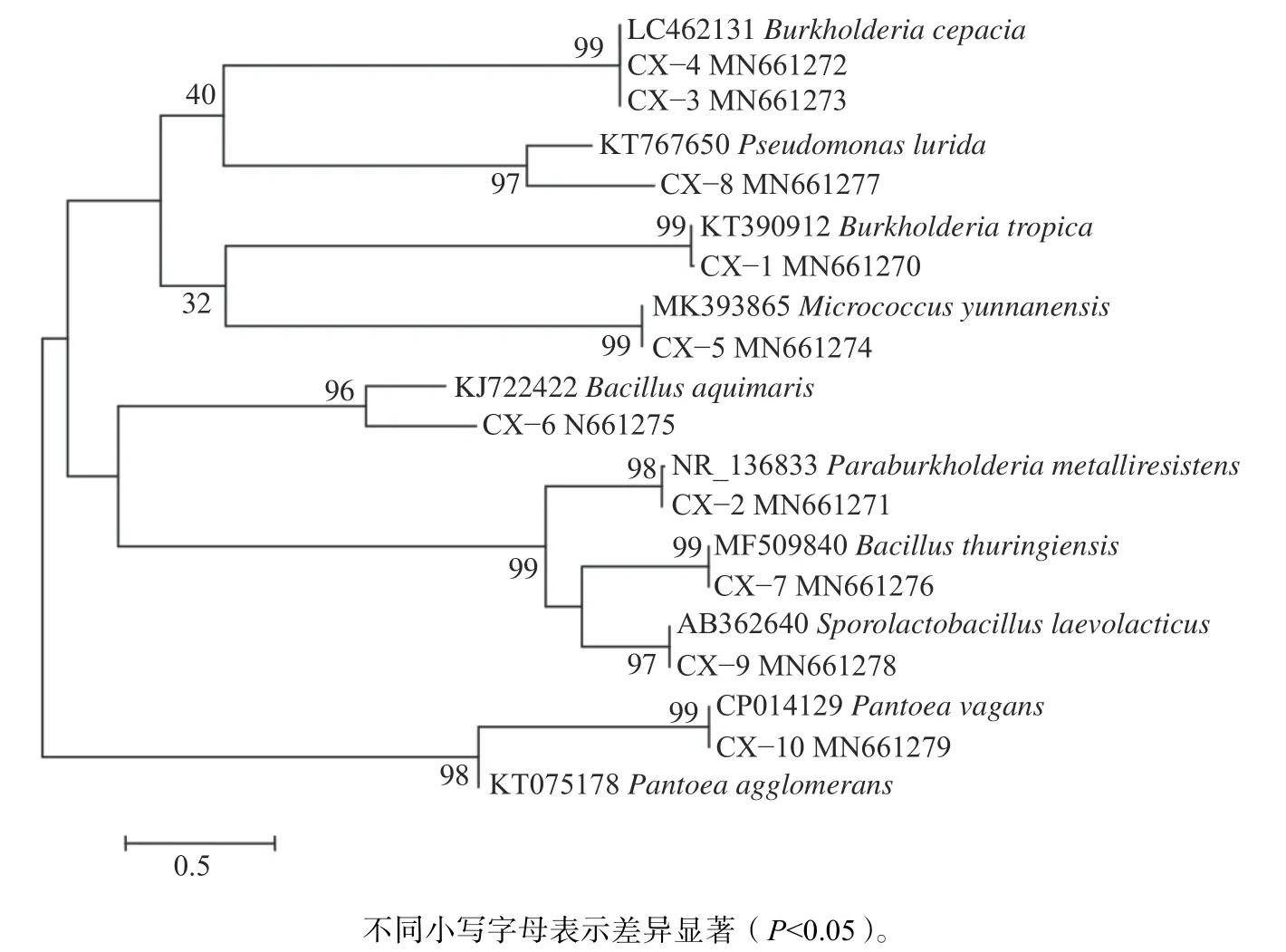
圖 3 土壤溶磷細菌16SrRNA系統發育樹Fig.3 Soil phosphorus-dissolving bacteria 16SrRNA phylogenetic tree

表 2 10種菌株對于磷酸鋁的溶解能力測定Table 2 Determination of the solvency of 10 strains for aluminum phosphate
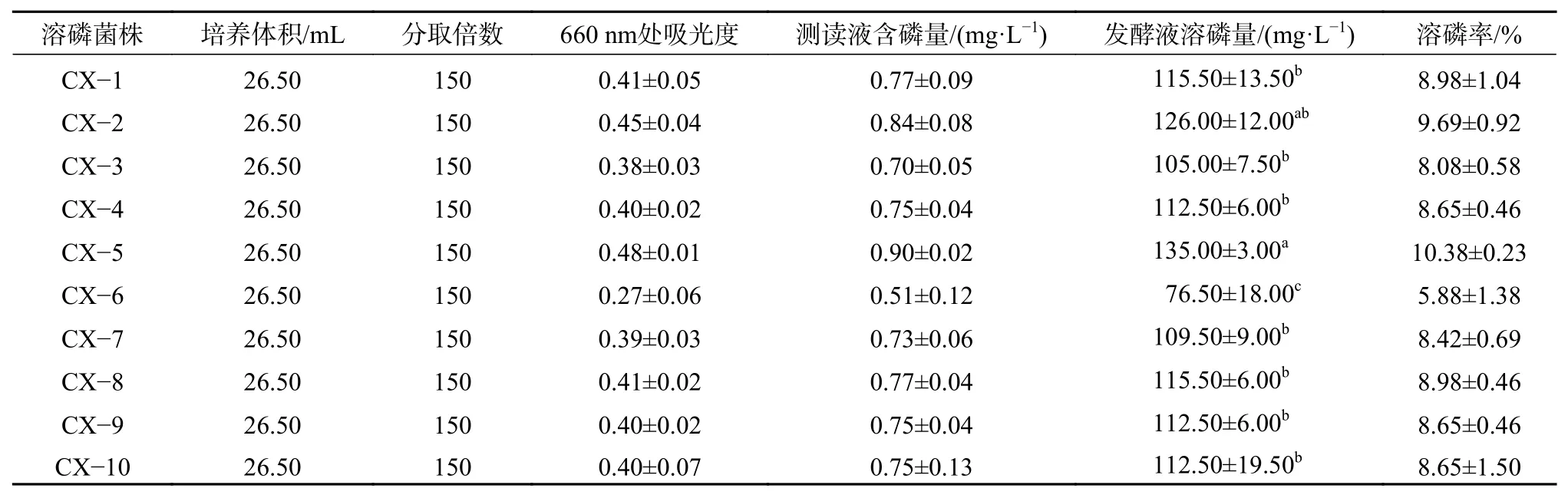
表 3 10種菌株對于磷酸鐵的溶解能力測定Table 3 Determination of the solvency of 10 strains for iron phosphate
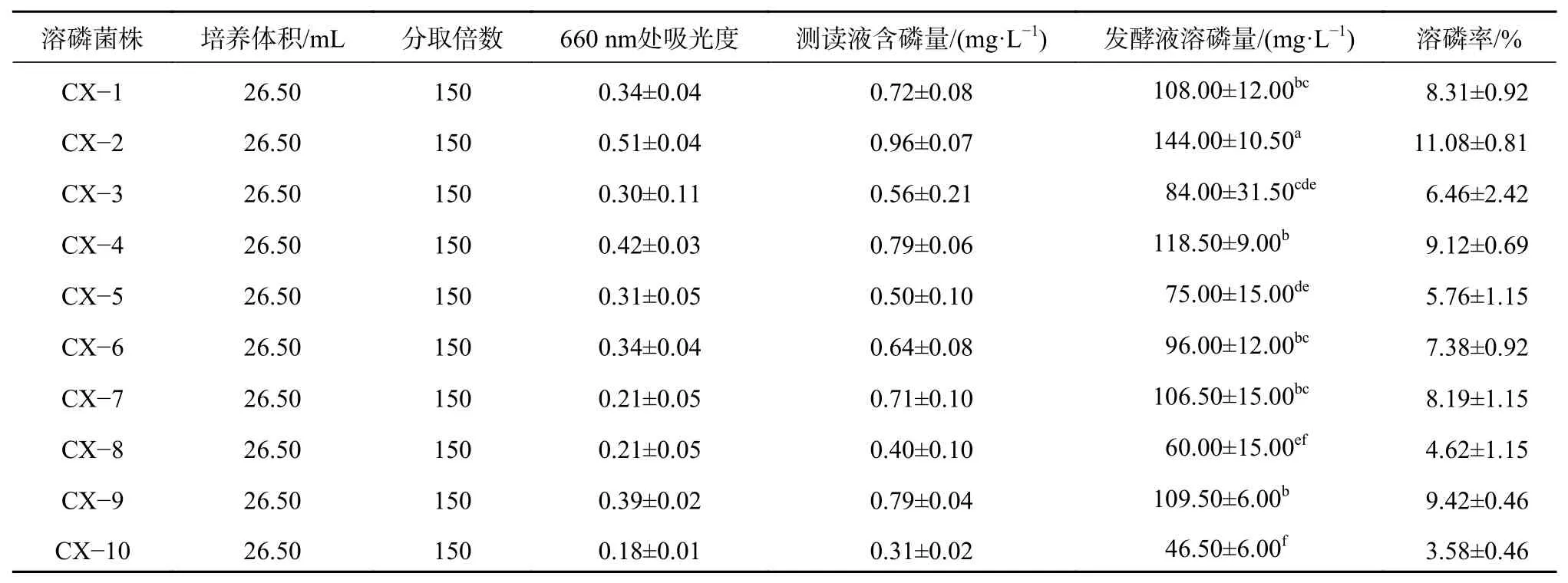
表 4 10種菌株對于磷酸鈣的溶解能力測定Table 4 Determination of the solvency of 10 strains for tricalcium phosphate
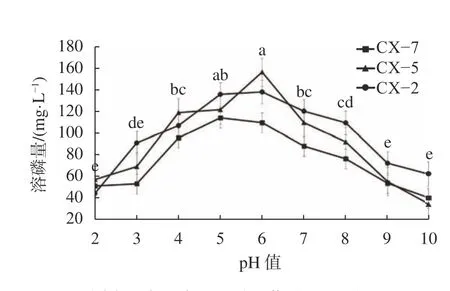
圖 4 pH值變化對3株溶磷菌溶磷能力的影響Fig.4 Effect of pH change on phosphorus solubilization ability of 3 phosphorus solubilizing bacteria

圖 5 溫度變化對3株溶磷菌溶磷能力的影響Fig.5 Effect of temperature change on the ability of 3 strains of phosphate solubilizing bacteria to dissolve phosphorus
3 結論與討論
長期以來,南方紅壤區土壤固定態磷含量豐富而有效磷長期不足,這已成為限制杉木人工林可持續經營的關鍵因素之一。植物根際的溶磷菌可以將土壤中難溶性礦物磷溶出,提高土壤有效磷含量,并為植物根際提供較好的磷素營養環境。研究表明,施用溶磷微生物肥料能夠改善作物磷素營養,進而提高作物產量和質量,并且緩解長期施用化學肥料引起的土壤退化、板結等問題。因此,篩選和鑒定杉木根際溶磷菌,是開發杉木專用微生物菌肥,提高杉木人工林可持續經營水平的重要途徑[25]。因此本試驗從福建省南嶼林場杉木人工林根際土壤中篩選獲得了10株溶磷菌,3株優勢溶磷菌CX?2、CX?5和CX?7分別隸屬于伯克氏菌屬的副伯克氏菌、芽孢桿菌屬的蘇云金芽孢桿菌和微球菌屬的云南微球菌。其中,CX?2、CX?5和CX?7分別對磷酸三鈣、磷酸鐵和磷酸鋁具有較好的溶磷效果,液體培養7 d后溶磷比率分別為11.08%、10.38%和12.12%。相較于王春紅等[26]在大豆根際土壤中篩選的溶磷菌溶磷量顯著增加,同時也高于趙小蓉等[27]報道的溶磷菌的溶磷量,同時發現了鮮有報道的云南微球菌和孢子型乳酸菌作為新型溶磷菌株,此外3種菌株不僅對一種難溶性磷源表現出較強的溶解效果,對于其他2種無機磷源也具有一定的降解能力,CX?2對于磷酸鋁和磷酸鐵溶解量達到8.31%和9.69%,CX?5對于磷酸鋁溶解量達到9.46%,CX?7對于磷酸鐵和磷酸三鈣溶解量達到8%以上。對于菌肥材料來講較為適宜和平衡。且在環境pH為5~6和溫度為20~30 ℃下表現出穩定的溶磷能力,可以作為杉木專用溶磷微生物菌肥研制的優質菌株。
其中,在所獲得的杉木根際土壤溶磷細菌中,伯克氏菌屬細菌占比最大,對3種難溶性磷的降解均在8%以上。伯克氏菌屬細菌在植物根際土壤中廣泛存在,且該屬中有多個菌種已被發現有較強的溶磷能力。管國強等在作物根際土壤中篩選出一株洋蔥伯克霍爾德氏菌,并發現使用草酸銨作為氮源供溶磷菌發酵培養能使其發揮更好的溶磷能力[28];劉云華等從磷礦區植物根圍土中分離出伯克霍爾德氏菌,并對其溶磷條件進行了優化[29]。目前研究表明,在溶磷微生物代謝過程中分泌的各種小分子量有機酸能與復合磷酸鹽中的鈣、鐵和鋁螯合釋放出磷酸根形成穩定的可溶性復合物而被植物體吸收利用[6],這表明較低的pH條件與溶磷菌的溶磷量息息相關,與本實驗結果相符。
此外,對于不同的難溶性磷源,芽孢桿菌屬同樣表現出較好的降解效果。芽孢桿菌廣泛分布在世界各地,能夠在土壤、水、空氣以及動物腸道等環境中存活,與林木生長相關的包括能夠防治植物真菌性病害的益生芽孢桿菌、具有很高殺蟲活性的蘇云金芽孢桿菌以及制作微生物菌肥的地衣芽孢桿菌等。同時,許多芽孢桿菌也具有難溶性磷的降解活性。邢芳芳等從玉米(Zea mays)根際土壤中篩選出一株地衣芽孢桿菌,且發現其具有非常好的生產性能及抗逆、定殖能力[30]。相較伯克氏菌,芽孢桿菌在微生物菌肥生產應用方面已得到廣泛認可,本實驗篩選獲得具有較強溶磷能力的芽孢桿菌,為制作多功能高效微生物菌肥提供菌種。
本實驗還篩選出了具有較好溶解磷酸鋁和磷酸三鈣的溶磷菌株,經過鑒定為云南微球菌和孢子型乳酸菌。微球菌多存在于土壤和水中,也見于人和動物的皮膚上,為非致病菌。乳酸菌廣泛存在于人、畜腸道和許多食品中,不僅可以提高食品的營養價值,還具有特殊生理活性和營養功能。在以往的土壤溶磷菌篩選研究中這兩種菌在土壤解磷方面研究甚少,在杉木根際土壤中發揮的功能尚不清晰,極有可能為微生物菌肥的制作提供新材料。
解磷微生物菌肥是提高林木磷素營養的重要發展方向,目前國內外已從林木根際篩選和分離到多種具有高效解磷能力的優質菌株,并已利用芽孢桿菌等具有溶磷功能的細菌研制了微生物菌肥。本研究篩選獲得的杉木根際溶磷菌對難溶性無機磷具有較好溶解能力,且在正常土壤環境溫度和pH下表現出穩定的溶磷能力,可以作為杉木專用溶磷微生物菌肥研制的優質菌株。微生物菌肥的研制還需要考慮溶磷菌在植物根際的定殖能力、適生能力、多功能特性和對作物促生效果,篩選出在杉木根際溶磷活性高、適生定殖能力強、促生效果好的多功能溶磷菌是杉木微生物菌肥的研究方向。

