新型冠狀病毒肺炎患者肺泡內滲出液特性對氣道開放壓力影響的計算模擬
陳正龍 鐘鳴 陶嘉樂 呂杰 胡兆燕 張春元 張偉國 陳翠翠 宋元林
1上海健康醫學院醫療器械學院201318;2復旦大學附屬中山醫院重癥醫學科,上海200032;3復旦大學附屬中山醫院呼吸與危重癥醫學科,上海200032;4國家藥品監督管理局呼吸麻醉設備重點實驗室,上海201318
新型冠狀病毒肺炎 (COVID-19)是一種由嚴重急性呼吸綜合征冠狀病毒2感染而引起的傳染性疾病,目前已成為全球流行的重大公共衛生事件。據WHO 的報道,截至2020年12月15日,全球已有200多個國家和地區累計報告COVID-19確診患者超過7 000萬例,累計死亡超過160 萬例[1]。COVID-19患者肺組織穿刺和尸體系統解剖結果表明COVID-19主要累及深部氣道和肺泡損傷:肺內支氣管黏膜部分上皮脫落,同時支氣管腔內見膠凍狀黏液附著,小氣道內可見大量黏稠的黏液及黏液栓形成;肺泡內充滿膠凍樣的炎性滲出物,Ⅱ型肺上皮細胞顯著增生,部分細胞脫落,少數肺泡過度充氣,肺泡隔斷裂或囊腔形成[2-4]。這些病理學的變化與COVID-19 患者臨床雙肺所見磨玻璃密度影、伴肺實變和空氣支氣管征以及“白肺”等主要的影像學特征相符[5-7]。
大量氣道黏液和膠凍狀肺泡滲出物的存在,使得氣道堵塞和肺泡氣體交換功能下降,因此如何清除氣道肺泡內液,保持氣道通暢,成為當下COVID-19臨床機械通氣治療最為迫切的難題。對于COVID-19 患者,在保證氣道平臺壓≤35 c m H2O (1 c m H2O=0.098 k Pa)的情況下[8],能否保證各級氣道的開放? 患者氣道肺泡內液能否用氣管鏡吸引出來? 多大的負壓可以吸引出來? 這些都是臨床醫師最為關心的問題。由于現有醫學成像設備時空分辨率的局限,我們尚不能原位觀察某一吸氣壓力下小氣道或者肺泡實時地開放的動力學,因此我們將借助于氣道開放有關的流體力學模型,大致估算正常或者疾病狀態下氣道襯里液表面張力和粘稠度等流變學參數對氣道開啟壓力的影響,期望為COVID-19 的臨床治療提供理論上的參考。
1 資料與方法
1.1 氣道開放的理論模型 健康成人肺通氣容積較小時可能出現遠端氣道的關閉,而氣流阻塞性患者在較高的肺容積通氣時可能出現氣道的關閉。氣道關閉兩種可能的機制是:半月形氣液界面形成和氣道順應性塌陷。一般認為,氣道關閉出現在終末細支氣管的水平,對正常的肺來說,文獻測量表明關閉氣道的直徑小至0.25 mm,大至2~4 mm[9-11]。
在一系列氣道開放有關的流體力學研究中,有學者提出的模型最能代表臨床觀察到的氣道開放過程[12-13]。如圖1所示,圓柱形氣道一端閉合形成一帶狀區域,柔性氣道壁之間的管腔內充滿氣道襯里液,充當黏性的膠合劑。管道開口部分的半徑為R,關閉部分液體薄膜層的厚度為H。假定氣道壁處于松弛的狀態,直到氣道完全充氣后產生軸向張力T 改變氣道壁的力學特性 (即橫切面積與跨壁壓關系)。氣道內氣體受到正壓以后,半月形氣液界面以速度U 沿氣道前進并打開氣道。
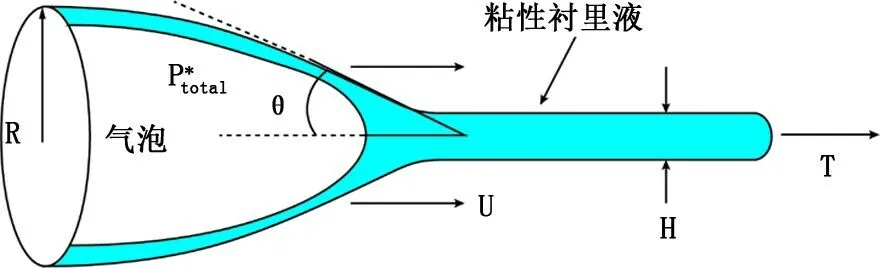
圖1 氣道開放模型

使用類似于圖2所示的氣道開放模型,有學者分別研究了牛頓流體襯里液的表面張力和粘度、非牛頓流體襯里液的粘彈性以及非牛頓流體襯里液的剪切稀化效應和屈服應力對氣道開放的影響[12-18]。通過在不同的管道直徑R 和襯里液膜厚度H 下重復多次氣道開放實驗,Low 等[17]得到了一組描述氣道充氣壓力與氣道開放速度關系的回歸公式(表1)。本研究將直接使用表1中的有關公式估計健康或疾病狀態下的氣道開啟壓力。
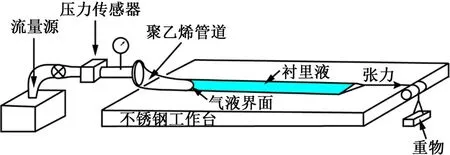
圖2 氣道開放實驗裝置示意圖
1.2 模型參數 在使用表1中的經驗公式大致估算氣道開放壓力之前,首先需要明確各級氣道的幾何結構,以及健康或者疾病狀態下氣道阻塞液的表面張力和流變學參數的大致范圍。如1.1所述,實驗觀察關閉氣道的直徑約為0.25~4 mm,根據Weibel人肺形態學測量的結果,這一尺寸大約對應于第8 代氣道向下直到肺泡的直徑。大約從第15代氣道開始,氣道從單純的傳導功能過渡到具備氣體交換功能,氣道幾何學也不再是嚴格的管狀結構。考慮表1回歸公式的適應性,本研究僅估計8~14代傳導性氣道開放所需要的壓力。為了大致估計各級氣道的開放速度,設定潮氣量VT為400 ml,吸氣時間Ti為1 s,當所有氣道處于臨界開放狀態時,根據各級氣道的總橫截面積可求得各級氣道的平均開放速度Un(n=8~14)。
Schürch等[19]用液滴法直接測得了肺泡表面張力值。正常情況下離體大鼠肺容積為總肺容積時,肺泡襯里液表面張力為29.7 dyn/c m;在肺容積為功能殘氣量時,肺泡襯里液表面張力為7 dyn/c m。由于呼吸窘迫綜合征表面活性劑的分泌不足或者功能障礙,有可能導致肺泡襯里液表面張力升高到接近水的表面張力 (72.8 dyn/c m 溫度20 ℃),Hsu等[16]測得狗鼻腔分泌物的表面張力約為50 dyn/c m。
本課題組前期研究中測得臨床ARDS患者氣道襯里液樣本的表面張力為13~25.5 dyn/c m (尚未發表的結果)。本次計算取正常氣道襯里液表面張力為γ=25 dyn/c m,疾病狀態升高到γ=50 dyn/c m。
文獻測得氣道黏液在非常低的剪切速率下表觀粘度為200~1 000 P (P:泊,動力粘度單位,1 P=0.1 Pa·s),而在高剪切速率下降至1~10 P;屈服應力約為550 dyn/c m2,表面張力為60~120 dyn/c m[20]。本課題組前期研究中測得臨床ARDS 患者氣道襯里液樣本的粘度為0.01~780 P[21]。同時,由于COVID-19患者下氣道黏液顯著性增多的特點,計算假定氣道內襯里液膜厚度H 為正常值的1~5倍,即H=10~50μm。
1.3 模擬氣道阻塞液 基于1.2,假定模擬牛頓流體襯里液的粘度為:健康狀態μ=0.01 P;疾病狀態下粘度升高1~3 個數量級,即μ=0.1、1、10 P。同時考慮以下2 種模擬非牛頓流體襯里液[18]。第一,假塑性流體 (羧甲基纖維素鈉和聚氧化乙烯)。這類流體最明顯的特點是其表觀粘度隨剪切速率 (˙γ)或剪切應力 (τ)的增加而減小,稱為剪切稀化現象。假塑性流體的本構方程通常用冪率模型表示:τ=m˙γn,m 為黏稠度指數,n(<1)為冪率指數。m 越大,流體黏性越高;n越小,剪切稀化效應越明顯。第二,屈服假塑性流體 (酥油、潤滑油、花生醬和蛋黃醬)。這類流體當外加的剪切應力小于某一定值(屈服應力)時,剪切速率為0;當剪切應力大于屈服應力時,流體從靜止開始運動,并呈現與假塑性流體類似的性質。其本構方程常用Herschel-Buckley模型描述:τ-τy=m˙γn,這一流動方程除了包含屈服應力τy以外,在形式上與冪率方程非常相似。模擬氣道襯里液特性如表2所示,其屈服應力τy為164~600 dyn/c m2,表面張 力 為25 ~70 dyn/c m, 粘 稠 度 為3.7 ~255 (dyn/c m2)·sn,與文獻報道的正常或者疾病狀態人類氣道襯里液流變學參數范圍具有很好的可比性[18-20]。

表1 不同氣道襯里液時無量綱壓力-速度關系[17]

表2 模擬氣道襯里液表面張力和流變學參數a
2 結果
2.1 牛頓流體型氣道襯里液 圖3和圖4表示氣道襯里液為牛頓流體時,粘度和表面張力的變化對氣道開放壓力的影響。由圖3可以看出,當氣道襯里液表面張力和粘度取正常值時 (γ=25 dyn/c m,μ=0.01 P),對應8~14級氣道的臨界開啟壓力為2.1~3.8 c m H2O,小于ARDSnet小潮氣量通氣協議推薦的最小呼氣末正壓值5 c mH2O[22]。其次,隨著表面張力或者粘度的升高,各級氣道開啟壓力也逐漸升高,特別地,倘若疾病狀態下氣道襯里液表面張力保持不變,粘度升高到10 P 時 (類似于藥用甘油25℃時的粘度),對應8級氣道的開啟壓力將升高到36 c m H2O,如果表面張力也同時增加到50 dyn/c m,則對應8~14級氣道的開啟壓力均超過35 c m H2O,最高開啟壓力可達41.8 c mH2O (第8級氣道)。
2.2 假塑性非牛頓流體氣道襯里液 圖5和圖6表示假塑性非牛頓流體氣道襯里液表面張力和流變學特性對氣道開啟壓力的影響。注意到3種襯里液的表面張力相當(約60~70 dyn/c m),盡管2%羧甲基纖維素鈉的黏稠度 (255.1 dyn/c m2·sn)數值上約為3.2%聚氧化乙烯 (41.9 dyn/c m2·sn)的6倍、1%羧甲基纖維素鈉 (24.9 dyn/c m2·sn)的10倍,但由于強烈的剪切稀化效應 (冪率指數n=0.375),使得其對應的各級氣道開啟壓力并沒有明顯地高于其他兩種襯里液填充下的氣道開啟壓力。其次,仔細比較模擬襯里液④ (圖4)與2%羧甲基纖維素鈉 (圖5),發現盡管后者表面張力和黏稠度均大于前者 (表面張力50 dyn/c m比68 dyn/c m; 黏 稠 度 10 dyn/c m2·sn比255.1 dyn/c m2·sn),但后者對應的各級氣道開啟壓力 (均不超過10 c m H2O)卻明顯地低于前者(均大于35 c m H2O),進一步證明了假塑性非牛頓流體存在的剪切稀化效應使得氣道開啟壓力減小。最后,比較圖5與圖6可知,氣道開啟壓力隨假塑性非牛頓流體襯里液膜厚度H 的增加而升高。
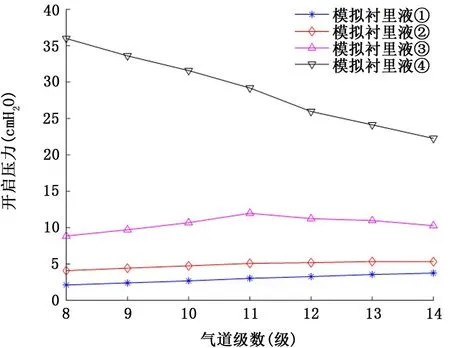
圖3 健康狀態牛頓流體襯里液表面張力和不同粘度對8~14級氣道開啟壓力的影響

圖4 疾病狀態牛頓流體襯里液表面張力和不同粘度對8~14級氣道開啟壓力的影響
2.3 屈服假塑性非牛頓流體氣道襯里液 具有屈服應力的假塑性非牛頓流體襯里液流變學特性對氣道開啟壓力的影響如圖7和圖8所示。首先類似假塑性流體,氣道開啟壓力隨著屈服假塑性流體襯里液膜厚度的增加而增加。其次當氣道為相對低黏稠度的襯里液酥油 (n=3.7 dyn/c m2·sn)或者剪切稀化效應強烈的蛋黃醬 (冪率指數n=0.471)所填充時,對應各級氣道的開啟壓力相對較低:襯里液膜厚度H=10μm 時,開啟壓力均不超過5 c m H2O (圖7);即使襯里液膜厚度增加到H=50μm,各級開啟壓力也不超過6.5 c m H2O (圖8)。但是當流變學特性類似花生醬 (黏稠度n=130.8 dyn/c m2·sn,屈服應力τy=400 dyn/c m2,冪率指數n=0.705)的襯里液填充氣道時,氣道開啟壓力依襯里液膜厚度的不同,開啟壓力可高達30.1 c m H2O (圖7)甚至48.9 c m H2O (圖8)。
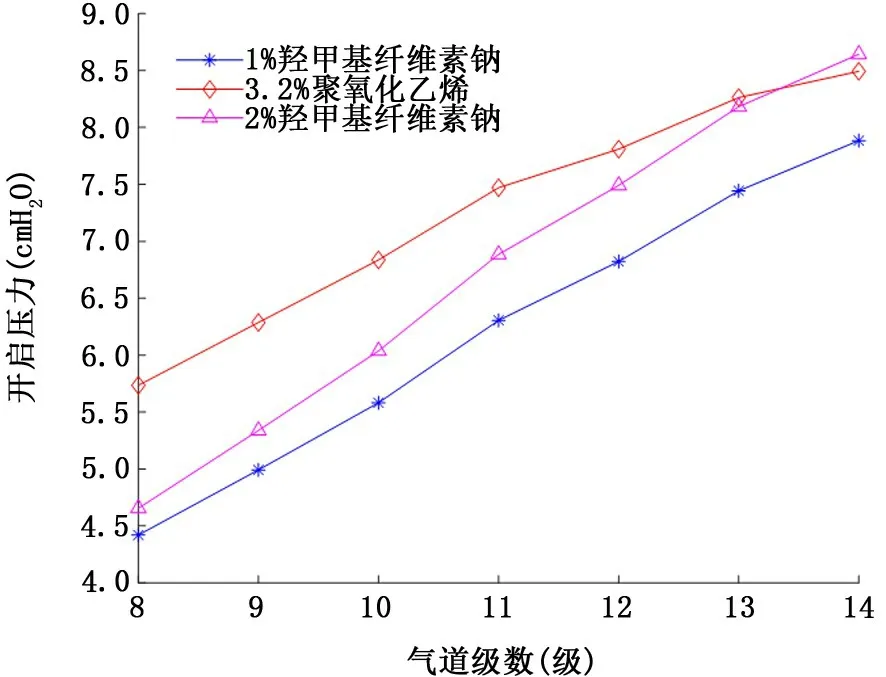
圖5 假塑性非牛頓流體襯里液表面張力和流變學特性對8~14級氣道開啟壓力的影響 (襯里液膜厚度H=10μm)
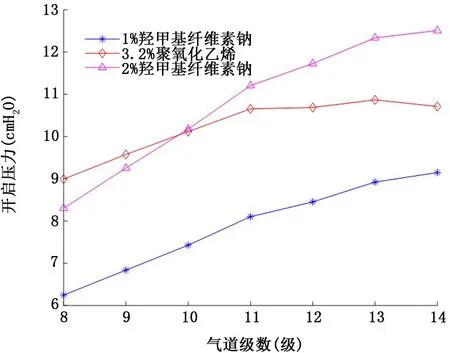
圖6 假塑性非牛頓流體襯里液表面張力和流變學特性對8~14級氣道開啟壓力的影響 (襯里液膜厚度H=50μm)
3 討論
基于人類肺結構的Weibel模型和氣道開放的流體動力學研究,本文從理論上估算了不同氣道阻塞液表面張力和流變學參數下,打開8~14級氣道大致所需要的壓力幅值。結果表明氣道的臨界開放壓力與氣道內襯里液的表面張力、粘稠度、屈服應力、襯里液膜厚度以及氣道半徑和氣道開啟速度有關。在健康狀態,襯里液表面張力為肺表面活性物質平衡表面張力值約25 dyn/c m,粘度為0.01 P,對應8~14 級氣道的開啟壓力大約在2.1~3.8 c mH2O;但是,當疾病狀態下襯里液粘度升高3個數量級到10 P左右,類似于醫用甘油的粘度時,預測的氣道開啟壓力可高達35 ~42 c m H2O,如果氣道被流變學特性類似花生醬樣的屈服性非牛頓流體所填充,則氣道開啟壓力可高達30~49 c m H2O。因此,對于一部分COVID-19重癥患者,肺保護性機械通氣下的低氣道平臺壓力(≤35 c m H2O)可能不足以保證氣道的完全開放,低血氧癥得不到改善,機械通氣失去其應有的作用。3.1 計算模型的有效性 首先是模擬氣道阻塞液表面張力和流變學參數的生理相關性。計算使用模擬氣道襯里液參數基于文獻對慢性支氣管炎、支氣管擴張、肺炎、囊性纖維化以及ARDS 患者氣道襯里液粘度和表面張力的測量結果,盡管目前尚無COVID-19患者肺泡內滲出液或者氣道襯里液黏稠度和表面張力的直接測量,但是考慮到COVID-19重癥患者可能發展為ARDS[23-24],同時COVID-19本質上是病毒感染引起肺部炎癥,因此這些疾病在氣道黏液或者肺泡滲出液的組成上應該具有很大程度上的類似性,主要包括黏液素、血漿蛋白、炎癥細胞、DNA、細菌和病毒等[25],故推測COVID-19患者肺內液粘度和表面張力值應該落在本文所討論的范圍之內。
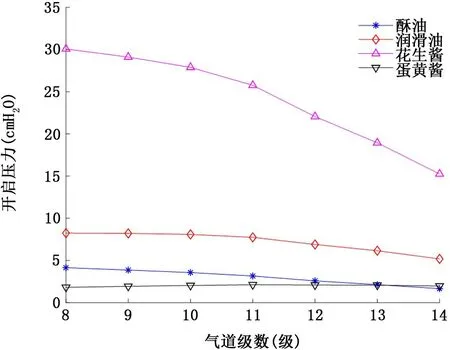
圖7 屈服假塑性非牛頓流體襯里液流變學特性對8~14級氣道開啟壓力的影響 (襯里液膜厚度H=10μm)
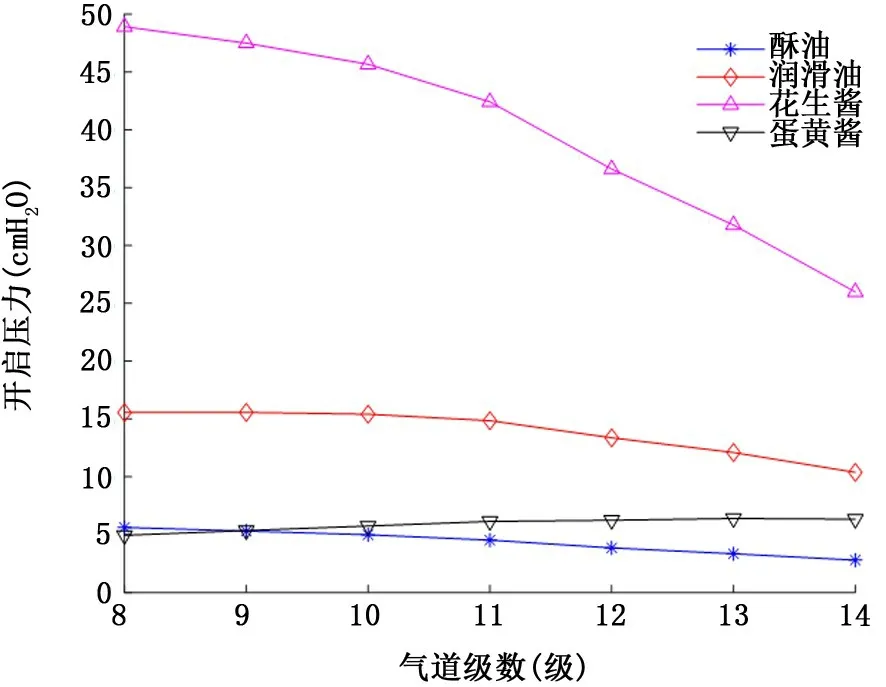
圖8 屈服假塑性非牛頓流體襯里液流變學特性對8~14級氣道開啟壓力的影響 (襯里液膜厚度H=50μm)
Mackle m 等[18]研究發現,當氣道內襯有表面活性物質時,直徑0.5 mm 氣道的開啟壓力為5~9 c m H2O,如果假定平衡表面張力為γ=25 dyn/c m,那么這一壓力對應為5~9γ/R,與表1中公式 (2a)毛細壓力P*cap≈4.39γ/R 基本一致,利用公式 (2a),計算得到直徑0.5 mm 的氣道對應的開啟壓力約為5.6 c m H2O。Cr otti等[26]研究了5例臨床急性肺損傷或ARDS患者的開肺壓力,發現在3例患者當中,出現頻率最高的臨界開肺壓力在20 c m H2O附近;在另外2例患者中,出現頻率最高的臨界開肺壓力為30~35 c m H2O。我們在COVID-19患者的臨床診療中也發現,盡管使用30 c m H2O的平臺壓,許多重癥患者的血氧飽和度依然沒有改善。這些研究數據與臨床發現證明了當前計算模型的合理性。
3.2 吸痰壓力的估算 目前常用的支氣管纖維鏡尖端部直徑一般為3.5~5 mm,工作長度為550~600 mm,最多可嵌入4~5級節段性支氣管。行支氣管纖維鏡吸痰操作時,單次吸痰的時間不超過15 s,吸引負壓一般為7~10 k Pa,最高不超過13 k Pa[27]。為了簡單起見,本研究僅估算支氣管纖維鏡吸痰時的沿程壓力損失。假定支氣管纖維鏡的工作長度為600 mm,為了保證痰液在15 s以內吸出,痰液運動速度(U)至少大于4 c m/s。對于直徑為5 mm的支氣管纖維鏡,鉗孔直徑 (d)為2 mm,對應0.2 ml痰液柱的長度 (L)為6.4 c m,那么吸痰負壓的沿程損失ΔP 可由下式計算ΔP=32μLU/d2(5)。示中μ表示痰液的粘度。代入相關的數值,可得不同痰液粘度對應的沿程壓力損失(表3)。可以看出,當痰液的粘度較低 (類似純水20.2 ℃的粘度值<0.01 P)時,壓力損失也較小(ΔP=0.02 k Pa);當抽吸類似高脂肪含量的奶油樣痰液時,壓力損失已經不能忽略 (ΔP=2.04 k Pa);當抽吸類似藥用甘油樣 (25 ℃時粘度<10 P)的痰液時,壓力損失ΔP=20.37 k Pa,高于臨床常規吸痰操作允許的最高壓力13 k Pa。這表明當痰液粘度升高到類似藥用甘油的表觀粘度值時,常規的支氣管纖維鏡不僅很難將患者氣道內的痰液吸出,而且高吸痰負壓可能進一步引起遠端氣道的塌陷。
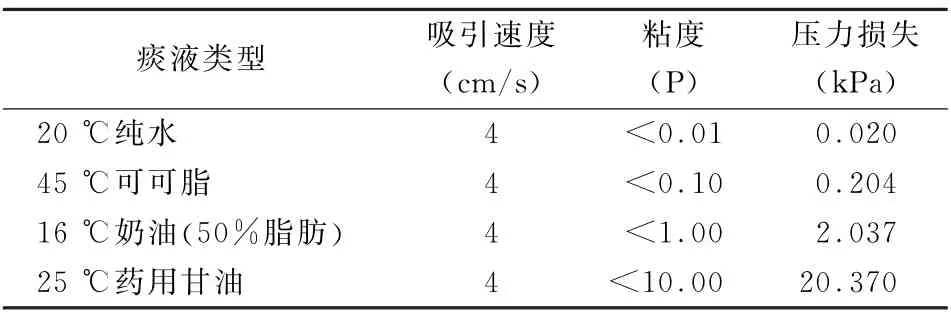
表3 支氣管纖維鏡吸引不同類型痰液的沿程壓力損失
3.3 局限性 當前的研究存在以下幾方面的局限性。第一,剪切應變率的估計可能和真實的氣道開放有所出入,進一步影響到公式2~4 中 (表1)氣道開放速度的準確性。體外模型實驗表明這一剪切應變率與襯里液流體類型、流體厚度和氣道半徑有關。第二,由于實驗儀器的限制,現階段我們無法對COVID-19 患者肺泡滲出液和氣道黏液的表面張力和粘度進行在體的測量。同時由于樣本難以獲得,甚至連體外測量的數據都未見報道。第三,在估計各級氣道的臨界開放速度時,考慮肺各向同性,所有的氣道處于臨界開放的狀態,COVID-9患者肺應該是高度異質性的,因此各級氣道開啟的時間和速度必定存在差異,但這并不影響我們對最高氣道開啟壓力的估計。因為在各向異質性的情況下,各級氣道的開啟速度更高,所以當前的氣道開啟壓力估計值是比較保守的。最后,在吸痰負壓的估計中,我們僅考慮非常少量的痰液(0.2 ml)在支氣管纖維鏡內的壓力損失,實際上從最終末的氣道(肺泡)到第5級氣道的壓力損失更大,一方面這些氣道的直徑相對更小,另一方面肺泡到第5級氣道的長度可達到5.5 c m 左右。綜合考慮,我們實際上極大地低估了吸痰沿程的壓力損失。另外,值得注意的是,吸痰的氣道幾何學與氣液界面驅動氣道開放的幾何學存在根本的不同,因此公式2~4不能用于估計吸痰所需克服的毛細壓力和黏性壓力。
鑒于COVID-19 晚期下氣道黏稠分泌物增多這一病理特點,當前COVID-19 患者,尤其是重癥患者的機械通氣治療面臨兩個迫切需要回答的問題,第一是肺保護性通氣策略規定的最高不超過35 c m H2O的吸氣平臺壓能否有效地開肺[8,22]。當前的理論計算表明,當痰液具有類似藥用甘油的粘度時,8~14級傳導性小氣道的開肺壓力可升高至40 c m H2O 以上;當痰液為類似花生醬樣的非牛頓流體時,開肺壓力可進一步升高至48 c m H2O 以上。因此至少在相當一部分COVID-19 患者中,35 c m H2O 的吸氣平臺壓不能有效和充分地開啟各級氣道,機械通氣失去應用的作用。這些理論計算進一步解釋了我們在COVID-19 的臨床治療中觀察到的現象,COVID-19患者偶爾進食、排便或者屏氣等日常動作后突然的窒息死亡:患者胸腔內壓的升高使跨肺壓力減小,而正常人自主呼吸時所能達到的最大胸腔內負壓值約為20 c m H2O,高粘度的氣道肺泡黏液使得患者無法自主開肺,最終像溺水一樣窒息死亡。但是正如最新版診療方案中COVID-19的病理學描述[8],過高的吸氣壓力將造成肺泡上皮細胞的脫落甚至肺泡隔的拉斷,因此臨床需要回答的第二個問題是:是否有可能把遠端氣道的黏液抽吸出來? 如果可以的話,需要多大的負壓? 當前的研究數據肯定地表明:如果肺泡氣道內充滿的黏液粘度升高到10 P左右的數量級,具有類似于藥用甘油常溫下的粘度時,使用支氣管纖維鏡在常規的吸痰負壓7~13 k Pa下,根本無法把深部氣道的黏液吸引出來。提示COVID-19 吸痰操作前,可以考慮先用生理鹽水對痰液進行稀釋,或者使用有效的化痰藥物溶栓,降低黏液的粘度。在之后的機械通氣治療當中,可根據吸出痰液的表觀粘度,來設定個性化的吸氣平臺壓或者呼吸末正壓。對于黏液表觀粘度過高的患者,因地制宜地考慮肺復張或者體外膜肺氧合等治療手段。
利益沖突 所有作者均聲明不存在利益沖突

