青少期應激誘導抑郁共病認知損害的GABA能突觸調節機制
青少期應激誘導抑郁共病認知損害的GABA能突觸調節機制
中國科學院心理健康重點實驗室王力研究組的王瑋文研究團隊探討了BDNF信號下游GABA能抑制性突觸傳遞在不同的抑郁共病模式中的作用。相關成果發表于Neuropharmacology。BDNF指內側前額葉腦源性神經營養因子,GABA能系統是腦內主要的抑制性神經系統,也是BDNF-TrkB信號通路的下游通路。該研究為未來抑郁癥患者認知功能障礙快速治療提供了潛在靶點。研究結果提示,mPFC BDNF信號下游的GABA能突觸傳遞主要參與了青少期社會應激所致的抑郁癥共病認知功能損傷的發生,而非抑郁共病焦慮樣行為。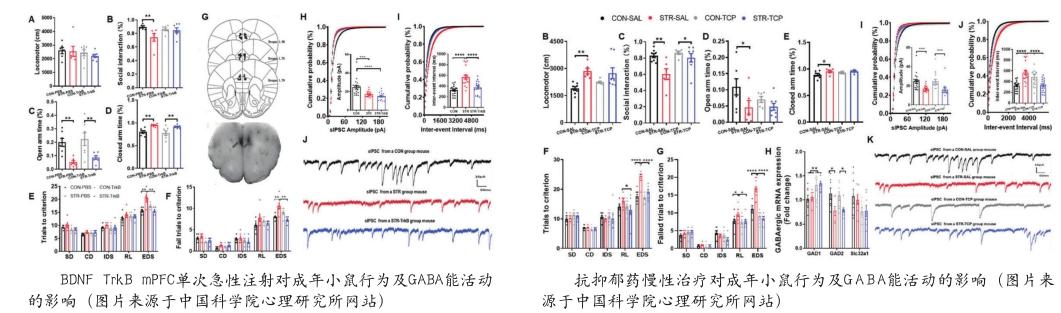
揭示糖尿病腎病新機制
山東大學基礎醫學院易凡教授等人開展糖尿病腎病等腎臟病發病機制的研究。相關論文發表于Cell Metabolism。研究發現,JAML(連接黏附分子樣蛋白)在糖尿病腎病小鼠腎小球中表達顯著升高;體外模擬糖尿病腎病條件刺激腎小球固有細胞,足細胞中JAML的表達水平呈特異性升高;更值得注意的是,在糖尿病腎病及其他伴有蛋白尿的慢性腎病,如局灶性節段性腎小球硬化和膜性腎病患者的腎活檢樣本中,JAML的表達水平顯著升高,并與血肌酐和脂質沉積呈正相關,與腎小球濾過率呈負相關。該研究發現JAML在糖尿病腎病等多種蛋白尿性腎病中通過調控足細胞內脂質代謝,在足細胞損傷的發生發展過程中發揮重要作用。
腫瘤診斷靶點鑒定研究進展
中國科學院蘇州生物醫學工程技術研究所腫瘤生物標志物實驗室研究團隊發現DMDRMR是一個m6A調控的長鏈非編碼RNA,能夠作為m6A閱讀蛋白IGF2BP3穩定靶基因及促腫瘤的協同分子,為腎透明細胞癌臨床診療的新策略和新靶點提供理論基礎。相關成果發表于Cancer Research。DNA甲基化修飾是表觀遺傳的重要調控方式,其復雜而精準地調控基因表達,長鏈非編碼RNA在多個水平上也能調控基因的表達,二者均參與調節腫瘤多種生物學過程。目前,在腫瘤研究中,DNA甲基化異常調控編碼基因譜已被廣泛研究,并證實其驅動腫瘤的發生與發展。
克服腫瘤乏氧提高化療和光動力治療療效研究進展
北京大學第三醫院超聲診斷科梁曉龍課題組在克服腫瘤乏氧提高化療/光動力療效方面取得重要進展。相關研究成果發表于ACS Nano。研究團隊開展了高強度聚焦超聲響應的超穩定全氟化碳硅質體納米液滴用于減輕腫瘤多藥耐藥和上皮-間充質轉化相關研究,開發了一種“抗乏氧氟碳硅質體納米粒”,用以實現氧氣和化療藥物阿霉素(DOX)在腫瘤區域的定點可控遞送;同時,開展了卟啉氟碳納米粒抗腫瘤乏氧增效光動力治療并抑制結腸癌肝轉移相關研究,研制了新型“抗乏氧卟啉-氟碳納米粒”,有助于高效地實現光敏劑和氧氣的同步輸送。
新冠肺炎的傳播動力學與非藥物性干預措施效果研究
復旦大學公共衛生學院余宏杰課題組牽頭,聯合湖南省疾病預防控制中心、美國國立衛生研究院等團隊,在新型冠狀病毒肺炎的傳播動力學與非藥物性干預措施的防控效果研究領域取得重要進展。相關成果發表于Science。論文揭示了由接觸模式與非藥物性干預措施共同決定的新冠肺炎傳播的異質性,估算了各種接觸模式下新冠肺炎的傳播風險,分析了針對個體與群體水平的干預措施對接觸模式與新冠肺炎傳播的影響,評估了生物學因素、行為學因素與非藥物性干預措施對新冠肺炎傳播的相對貢獻。相關結論為放松和/或重新實施干預措施時提供科學證據,力爭最大限度地減少新冠肺炎對全球健康、社會和經濟的影響。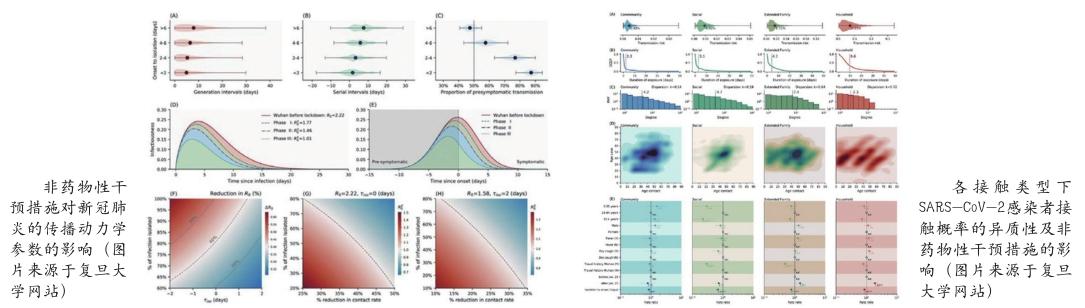
GLIM標準在老年腫瘤患者營養評估及生存預測中的作用
首都醫科大學附屬北京世紀壇醫院石漢平教授團隊報道了全球領導人營養不良倡議(Global Leadership Initiative on Malnutrition,GLIM),標準不僅可以用于老年腫瘤患者營養不良的診斷,并且能夠用于預測患者生存結局。相關成果發表于Clinical Nutrition。為了統一營養不良的診斷標準,美國腸外腸內營養學會、歐洲腸外腸內營養學會、亞洲腸外腸內營養學會及拉丁美洲腸外腸內營養學會組成工作組,并制定了全球領導人營養不良倡議(GLIM)。回顧性分析發現GLIM標準診斷的營養不良發生率在主要數據集為48.4%,在驗證數據集為46%。基于GLIM診斷標準構建的臨床預測模型可對老年腫瘤患者1年和2年總體生存率進行判斷。
雙相情感障礙的遺傳基礎研究
中國科學院昆明動物研究所李明研究員、上海精神衛生中心方貽儒教授等人聯合報道了我國大陸地區漢族人群雙相情感障礙遺傳基礎的首次大樣本探索。相關成果發表于JAMA Psychiatry。該研究對我國雙相情感障礙患者所攜帶的遺傳風險進行了全面探索,鑒定到了多個疾病相關變異及一個風險基因TMEM108,進一步鑒定出多個與雙相情感障礙顯著相關的基因(如VRK2、RHEBL1、CACNA1C、ANK3、HDAC5、TRANK1和SCN2A等),同時也證實雙相情感障礙在我國人群和歐洲人群中共享許多重要的遺傳風險。這些結果為認識該病的發生遺傳機制提供了線索。
USP38通過調控組蛋白泛素化/甲基化連鎖反應抑制炎癥的機制
中山大學生命科學學院崔雋教授團隊鑒定了一個新的組蛋白H2B的特異性去泛素化酶USP38,揭示其通過抑制組蛋白H2B K120位點的單泛素化,以及通過募集并穩定去甲基化酶KDM5B,協同促進IL-6、IL-23a等促炎癥細胞因子啟動子附近的組蛋白H3K4的去甲基化,從表觀遺傳學水平抑制炎癥應答的新機制。相關成果發表于Advanced Science。炎癥(inflammation)是生物組織受到外傷、感染等損傷因子等刺激所發生的一系列以防御反應為主的生理過程,炎癥過程需要被精確調控。在急性炎癥應答過程中,短時間內釋放的大量炎癥因子可能引發機體的劇烈損傷,進而導致一系列病理進程,如急性腸炎、細菌性敗血癥等。

