超級增強子長鏈非編碼RNA LINC01232在大腸癌組織中的表達及其對癌細胞生物學行為的影響*
陳緩緩,鄭鈞予,江盼,嚴楓(南京醫科大學附屬腫瘤醫院&江蘇省腫瘤醫院&江蘇省腫瘤防治研究所檢驗科,南京210009)
大腸癌是最常見的惡性腫瘤之一,其發病率和死亡率每年呈不斷上升趨勢[1-2]。早期診斷和有效治療可以在一定程度上提高患者的生存率,因此,盡早發現腫瘤生物標志物和治療靶點對大腸癌的診斷和治療有著重要的意義。
長鏈非編碼RNA(LncRNA)是一種轉錄本大于200 nt,且不具有編碼蛋白質能力的RNA[3]。超級增強子長鏈非編碼RNA(SE-LncRNA)是一類由超級增強子區域轉錄或與其相互作用的LncRNA[4-5]。研究表明,SE-LncRNA在腫瘤的發生、發展過程中發揮重要的作用[6]。有學者通過基因芯片在大腸癌組織中篩選差異表達的SE-LncRNA,結果發現LINC01232呈異常高表達,且證實其在胰腺癌和食管鱗狀細胞癌中呈高表達,并可通過多種不同機制調節癌癥的發生、發展[7-8]。然而,目前關于LINC01232在大腸癌中的表達和作用的研究國內尚未見報道。本研究旨在探討和分析LINC01232在大腸癌組織中的表達水平及其對大腸癌細胞增殖、侵襲和遷移等生物學行為的影響。
1 材料和方法
1.1標本采集 收集2017年10月至2019年12月南京醫科大學附屬腫瘤醫院就診的大腸癌患者經外科手術切除的35對癌組織及相應的癌旁組織(距離病灶邊界>2 cm,無癌細胞),隨機抽取4對進行基因芯片分析,另外31對進行臨床及實驗分析。納入標準:(1)經病理組織學確診為大腸癌,并無其他癌癥病史;(2)無任何放化療、生物免疫劑等治療史;(3)無任何腸炎癥病史;(4)臨床資料完整。排除標準:(1)非首次確診患者;(2)圍手術期發生嚴重的并發癥。其中31例患者中,男16例,女15例,年齡(58±12)歲,TNM分期Ⅰ~Ⅱ期17例,Ⅲ~Ⅳ期14例。本研究通過南京醫科大學醫學倫理委員會批準[批準號:南醫大倫審(2019)843號],患者及家屬知情同意。
1.2細胞系、主要試劑及儀器 大腸癌細胞系HCT-116和HT-29購自中國科學院細胞庫。McCoy5A′培養基、胰蛋白酶、磷酸鹽緩沖液(PBS)、CCK-8檢測試劑均購自江蘇凱基生物公司,胎牛血清、Opti-MEM培養基購自美國Gibco公司, TRIzol試劑購自美國Life technologies公司,Quick Amp標記試劑盒(Agilent p/n 5190-0442)、安捷倫基因表達雜交試劑盒(Agilent p/n 5188-5242)購自美國Agilent Technologies公司,Hiscript?ⅢRT SuperMix for qPCR(+gDNA wiper)逆轉錄試劑和ChamQ Universal SYBR?qPCR Master Mix試劑購自南京諾唯贊生物公司,Lipofectamine RNAiMAX購自美國Invitrogen公司,LINC01232 Smarter Silence和陰性對照negative control試劑購自廣州銳博生物公司,TM9SF2兔多克隆抗體(ab121227)和GAPDH兔單克隆抗體(ab9485)購自美國Abcam公司。Transwell小室購自美國Corning公司,SpectraMax i3x多功能酶聯儀購自美國Molecular Devices公司,QuantStudio 6實時熒光定量PCR儀購自美國Applied biosystems公司,NanoDrop 1000超微量分光光度計(美國NanoDrop公司)。
1.3方法
1.3.1基因芯片生物信息學分析 基因芯片分析包含4對大腸癌組織及對應的癌旁組織。采用TRIzol試劑提取組織總RNA,用NanoDrop 1000超微量分光光度計檢測總RNA的濃度和純度,取吸光度(A260/280 nm)值在1.8~2.0之間,A260/230 nm值>2.0的RNA樣本,置于-80 ℃保存。使用Quick Amp標記試劑盒(Agilent p/n 5190-0442)將RNA轉錄成Cy3標記的cDNA,按照安捷倫基因表達雜交試劑盒(Agilent p/n 5188-5242)說明書對cDNA進行雜交,通過安捷倫特征提取軟件(v11.0.1.1)獲取陣列圖像,并經GeneSpring GX v12.1軟件包(Agilent Technologies)分析和標準化,最后通過P<0.05且Fold Change>2篩選差異表達的SE-LncRNA,其中超級增強子相關信息來源dbSUPER數據庫。
1.3.2RT-qPCR檢測 將75 mg大腸癌組織及癌旁組織快速研磨成勻漿,每個樣本加入700 μL TRIzol試劑提取總RNA,按照逆轉錄試劑盒Hiscript?Ⅲ RT SuperMix for qPCR(+gDNA wiper)說明書操作將RNA逆轉錄為cDNA。LINC01232上游引物序列:5′-AAAACCTTGAAATCCCTTAATACCA-3′,下游引物序列:5′-CCTTACCCGTGGAATTCACATATA-3′[7];TM9SF2上游引物序列:5′-CCTCCAAGAAAAGGGATGCTGC-3′,下游引物序列:5′-ACAGGACCACAGCACACGTCAT-3′[8];GAPDH上游引物序列:5′-ATGGGTGTGAACCATGAGAA-3′,下游引物序列:5′-GTGCTAAGCAGTTGGTGGTG-3′[9]。按照ChamQ Universal SYBR?qPCR Master Mix說明書進行RT-qPCR擴增,總反應體系為10 μL,分別為上、下游引物各0.5 μL,SYBR 5 μL,cDNA 4 μL。循環參數:95 ℃ 預變性30 s;95 ℃ 10 s,60 ℃ 15 s,共40個循環。每個樣本設置3個復孔,反應結束后對熔解曲線和擴增曲線進行分析,獲得Ct值,并采用2-ΔΔCt法對LINC01232的表達量進行分析。
1.3.3細胞培養 使用McCoy5A′培養基(含10%胎牛血清,80 U/mL青霉素,0.08 mg/mL鏈霉素),在37 ℃、5% CO2、飽和濕度的條件下培養大腸癌細胞系HCT-1116和HT-29,光學顯微鏡下觀察細胞的生長狀態,取對數生長期細胞進行后續試驗。
1.3.4細胞轉染 將生長狀態良好的大腸癌細胞系HCT-116和HT-29接種于6孔細胞培養板,當細胞密度達70%時,進行細胞轉染。設置NC組(轉染negative control)和si-LINC01232組(轉染LINC01232 Smarter Silence),每組取2個Ep管,每管加入125 μL Opti-MEM培養液,其中1管加入5 μL Lipofectamine RNAiMAX,室溫溫育5 min,另1管加入濃度為20 μmol/L,體積為2.5 μL negative control或LINC01232 Smarter Silence,后將2管液體混合,室溫溫育20 min,于37 ℃、5% CO2條件下繼續培養。轉染12 h后,收集細胞并采用RT-qPCR檢測NC組和si-LINC01232組LINC01232的表達水平,評估其轉染效率。LINC01232 Smarter Silence的靶序列:(1)GCCTGCTCCTACATCCCACA;(2)CTGCAGTAACGCAGCCACTA;(3)TGCGGGCCACCACTTCATTT;(4)CCCACATTTACCACTATCA;(5)CAAGAGTGCTGGATCTAAA;(6)GACACGTCATCTAGAATAA。
1.3.5CCK-8試驗 將轉染24 h后的上述細胞接種于96孔細胞培養板中,每孔約3×103個細胞,每組設置6個復孔,37 ℃、5%CO2條件下繼續培養細胞,在0、24、48、72、96 h時,棄去上清液,每孔加入100 μL培養基和10 μL CCK-8試劑,置于培養箱繼續培養2 h,采用SpectraMax i3x酶聯儀檢測450 nm處的吸光度(A)值,實驗重復3次。
1.3.6細胞克隆形成試驗 細胞轉染24 h后,用2.5 g/L胰蛋白酶消化細胞并制備成單細胞懸液,將1×103個細胞接種到6孔細胞培養板中,置于37 ℃、5% CO2的培養箱繼續培養1周,形成肉眼可見克隆細胞群落后,終止培養,用PBS洗滌細胞2次,4%多聚甲醛室溫下固定30 min,1 g/L結晶紫染液染色30 min,將對照組克隆形成率設置為100%,實驗組克隆形成率=(實驗組克隆數/對照組克隆數)×100%。
1.3.7Transwell試驗 取上述轉染24 h后的細胞,300×g離心5 min,收集細胞。將600 μL含20%胎牛血清的培養基加入24孔細胞培養板中,置于Transwell小室中,將200 μL含有1×105個細胞的無血清培養基加至小室中,在37 ℃、5% CO2條件下繼續培養48 h,經4%多聚甲醛室溫下固定40 min,1 g/L結晶紫染液染色30 min,流水清洗后置于倒置顯微鏡下進行觀察分析,隨機選擇3個視野進行細胞計數。
1.3.8western blot 將上述6孔細胞培養板中的細胞用冰冷的PBS洗滌3次后,300×g離心5 min,收集細胞,每孔加入100 μL RIPA裂解液,置于冰上裂解30 min,4 ℃、12 000×g離心10 min,收集上清液,采用BCA試劑盒測定蛋白質濃度,加入Loading buffer煮沸5 min,取40 μg總蛋白質進行SDS-PAGE電泳(70 V 30 min,110 V 90 min),使用轉膜儀將蛋白質轉移至PVDF膜上,用50 g/L脫脂奶粉室溫封閉2 h,將PVDF膜分別與TM9SF2兔多克隆抗體(1∶1 000稀釋)及GAPDH兔單克隆抗體(1∶2 500稀釋)4 ℃溫育過夜,使用熒光標記的羊抗兔IgG二抗(1∶5 000稀釋)室溫溫育1 h,采用雙色紅外成像系統避光掃描拍照,并記錄蛋白質條帶灰度值,以目標蛋白灰度值/對應內參灰度值作為該組的目標蛋白相對表達量,再將對照組設置為1進行標準化,則實驗組蛋白質表達量=(實驗組蛋白質相對表達量/對照組蛋白質相對表達量)。

2 結果
2.1基因芯片分析結果 通過基因芯片分析,共獲得23個差異表達的SE-LncRNA(Fold Change>2,P<0.05),其中15個上調,8個下調。見表1。LINC01232在癌組織中顯著高表達(Fold Change=2.656 9,P=0.025 8),故而本研究選擇LINC01232進行下一步的實驗驗證,其超級增強子分布為chr13:100136209:100160564。
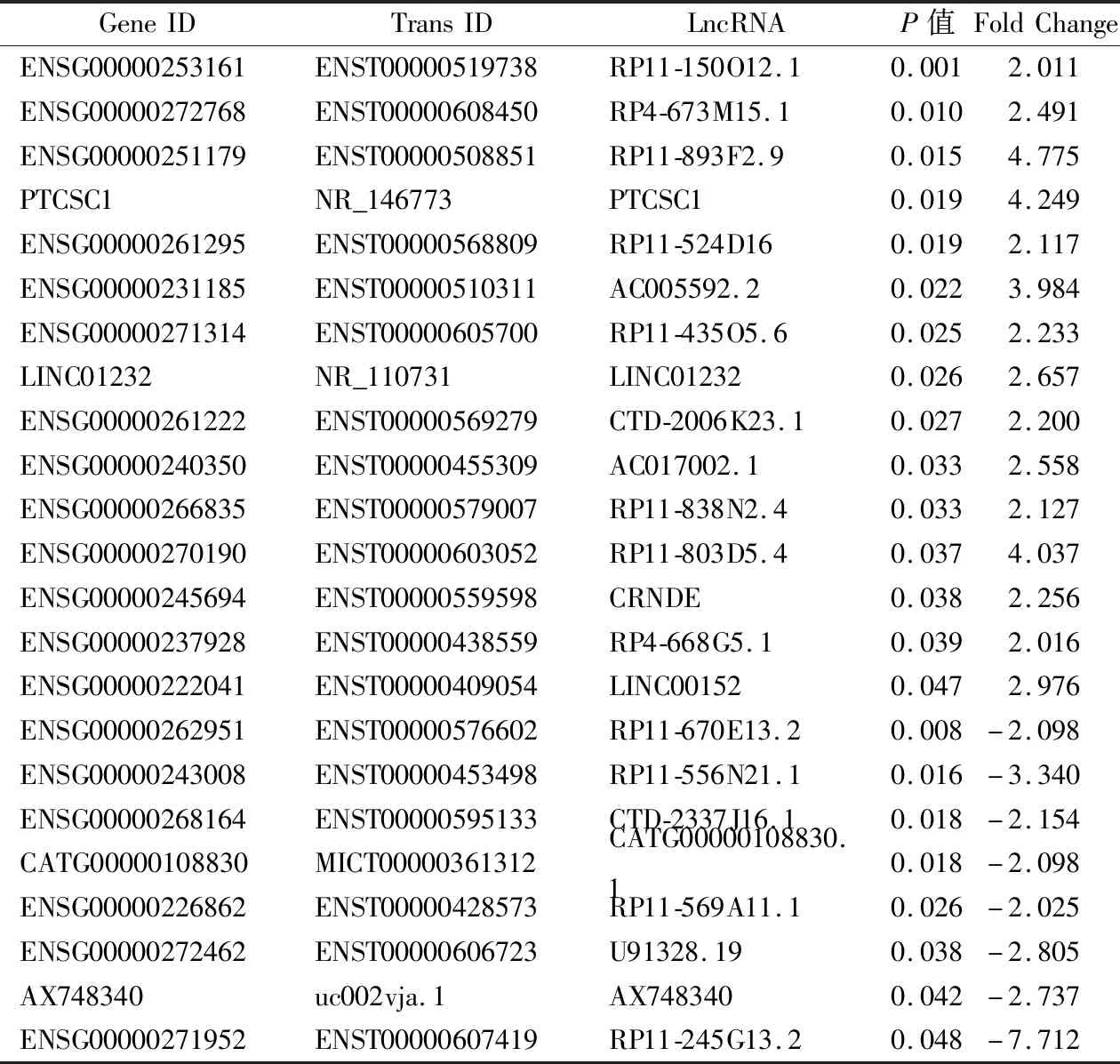
表1 大腸癌中差異表達的SE-LncRNA
2.2LINC01232在大腸癌組織中的表達 RT-qPCR結果顯示,在31對大腸癌組織中LINC01232的表達水平(2.015±2.865)明顯高于癌旁組織(1.000±2.036),差異具有統計學意義(t=2.388,P=0.023)。
2.3LINC01232表達與大腸癌患者臨床病理參數的關系 以LINC01232在31對大腸癌組織表達量的中位數(1.481)為界值,將患者分為“高表達”和“低表達”組,分析其與臨床病理參數的關系,結果顯示,LINC01232與TNM臨床分期(χ2=5.427,P=0.020)和遠處轉移(χ2=4.663,P=0.031)有關,而與年齡、性別、淋巴轉移無明顯相關性(P>0.05)。見表2。

表2 大腸癌組織中LINC01232的表達與患者臨床病理參數的關系
2.4ROC曲線分析 結果顯示,LINC01232篩查大腸癌的ROC曲線下面積(AUCROC)為0.680(95%CI:0.544~0.807,P<0.05),當cut-off值為0.001 4時,敏感性和特異性分別為53.13%、78.13%。見圖1。
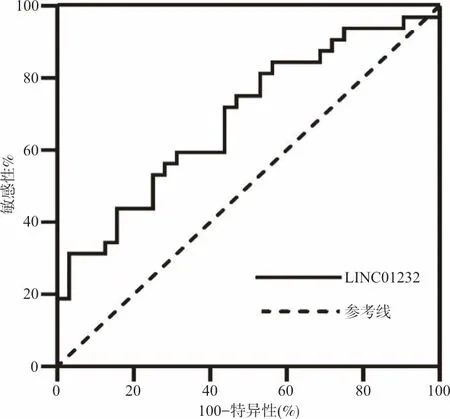
圖1 LINC01232的ROC曲線分析
2.5細胞轉染效率檢測結果 RT-qPCR結果顯示,在HCT-116細胞中,si-LINC01232組的LINC01232的表達水平(0.488±0.034)較NC組(1.000±0.250)明顯降低,差異具有統計學意義(t=3.513,P=0.025);在HT-29細胞中,si-LINC01232組的LINC01232的表達水平(0.510±0.064)較NC組(1.000±0.150)亦明顯降低,差異具有統計學意義(t=3.176,P=0.034)。
2.6下調LINC01232對大腸癌細胞增殖、克隆形成率的影響 CCK-8試驗檢測結果顯示,在HCT-116中,si-LINC01232細胞組在72 h的增殖能力顯著低于NC組,差異具有統計學意義(1.197±0.015 vs 1.407±0.051,t=6.793,P=0.002);在HT-29細胞中,si-LINC01232細胞組在72 h的增殖能力亦顯著低于NC組,差異具有統計學意義(0.891±0.066 vs 1.162±0.051,t=5.671,P=0.005)。見圖2A、2B。細胞克隆結果顯示,在HCT-116細胞中,si-LINC01232組的細胞克隆形成率較NC組顯著降低,差異具有統計學意義[(59.000±3.610)% vs(100.000±5.210)%,t=11.520,P<0.001];在HT-29細胞中,si-LINC01232組的細胞克隆形成率亦較NC組明顯降低,差異具有統計學意義[(52.000±3.210)% vs(100.000±8.801)%,t=9.731,P<0.001]。見圖2C、2D。

注:A、B,CCK-8試驗檢測下調LINC01232對細胞增殖的影響;C、D,細胞克隆試驗檢測下調LINC01232對細胞克隆形成率的影響;*,P<0.05。
2.7下調LINC01232對大腸癌細胞遷移、侵襲的影響 遷移試驗結果顯示,在HCT-116細胞中,與NC組比較,si-LINC01232組遷移的細胞數量顯著降低[(220.000±19.294)個vs(110.000±9.591)個,t=8.521,P<0.001),在HT-29細胞中,si-LINC01232組遷移的細胞數量亦顯著降低[(117.000±9.592)個vs(79.000±3.610)個,t=8.310,P=0.001];侵襲試驗結果顯示, 在HCT-116細胞中,與NC組比較,si-LINC01232組侵襲的細胞數量顯著降低[(283.000±16.166)個vs(173.000±12.858)個,t=7.736,P=0.002],在HT-29細胞中,si-LINC01232組侵襲的細胞數量亦顯著降低[(123.000±6.429)個vs (47.000±3.511)個,t=14.310,P<0.001]。見圖3。
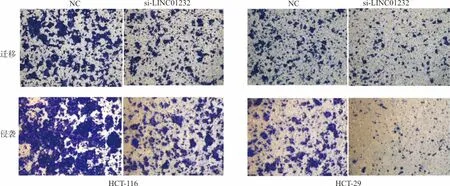
圖3 LINC01232對細胞侵襲和遷移的影響(×100)
2.8LINC01232通過調節TM9SF2的表達水平促進大腸癌的發生 通過對UCSC網站分析,顯示TM9SF2為LINC01232的臨近基因。TCGA數據庫分析表明,在大腸癌組織中,TM9SF2與LINC01232的表達呈正相關(r=0.38,P<0.01)。RT-qPCR結果進一步證實了TM9SF2與LINC01232在31對大腸癌組織的表達量呈正相關(r=0.51,P<0.01)。在大腸癌細胞中,RT-qPCR結果表明,TM9SF2mRNA水平在LINC01232 下調后降低,在HCT-116中結果為(1.000±0.250 vs 0.557±0.090,t=2.889,P=0.044),在HT-29中結果為(1.000±0.170 vs 0.643±0.040,t=3.028,P=0.039)。見圖4A。western blot結果顯示,TM9SF2蛋白水平亦在LINC01232下調后降低,在HCT-116中結果為(1.000±0.050 vs 0.560±0.040,t=11.900,P<0.001),在HT-29中結果為(1.000±0.150 vs 0.433±0.065,t=6.003,P=0.004)。見圖4B。

注:A,RT-qPCR檢測下調LINC01232對TM9SF2 mRNA表達水平的影響;B,western blot檢測下調LINC01232對TM9SF2蛋白表達水平的影響;*,P<0.05。
3 討論
SE-LncRNA由超級增強子區域轉錄而來,且與多種疾病,尤其與癌癥密切相關。許多惡性腫瘤都伴隨著SE-LncRNA表達水平的顯著變化[10-11]。本研究采用基因芯片技術在大腸癌中篩選出了異常高表達的LINC01232。為驗證基因芯片的結果,本研究繼續收集31對大腸癌組織并檢測LINC01232的表達水平,證實了LINC01232在大腸癌組織中的表達量顯著高于癌旁組織。本研究進一步分析了LINC01232表達與大腸癌患者臨床病理參數的相關性,結果發現LINC01232與TNM臨床分期及遠處轉移存在顯著的正相關性,表明LINC01232可作為大腸癌是否發生遠處轉移的潛在標志物。由于本研究收集的是2017年10月至2019年12月期間首次入院患者的組織標本,預后及療效觀察期較短,LINC01232的預后相關性分析有待于進一步驗證。有文獻報道SE-LncRNA可通過調節細胞周期、增殖、侵襲和遷移等生物學行為來影響腫瘤的發生、發展。在本研究中,下調LINC01232抑制大腸癌細胞的增殖、侵襲和遷移,說明LINC01232是通過促進細胞的增殖、侵襲和遷移等生物學行為調節大腸癌的發生和發展。
研究表明,LINC01232可通過競爭性結合microRNA-654-3p,促進食管鱗狀細胞癌的發展[7];在胰腺癌中,LINC01232通過抑制泛素介導的HNRNPA2B1降解,從而激活A-Raf誘導的MAPK/ERK信號通路,促進胰腺癌的轉移[12]。但LINC01232在大腸癌中的作用機制仍沒有被學者研究過。通過順式作用調控臨近基因的表達是SE-LncRNA發揮功能的重要機制之一[13]。UCSC網站分析顯示TM9SF2為LINC01232的臨近基因,且TM9SF2已經被證實可通過調節CCNA2、CCNB2和AURKA等癌基因的表達促進大腸癌的發生、發展,在大腸癌中起促癌作用[14]。為了證實LINC01232是否通過調控臨近基因TM9SF2的表達以促進大腸癌的發展,本研究首先通過TCGA數據庫分析得出TM9SF2與LINC01232在組織中的表達呈正相關,其次,RT-qPCR進一步在31對大腸癌組織中證實了這一結果。同樣地,在大腸癌細胞系HCT-116和HT-29中,TM9SF2mRNA和蛋白質水平在LINC01232下調后降低。以上結果與Li等[8]在胰腺癌研究機制結果一致,表明LINC01232可以通過調節TM9SF2的表達促進大腸癌細胞的增殖和侵襲。
綜上所述,本研究發現LINC01232在大腸癌組織的表達水平顯著高于癌旁組織,且與臨床TNM分期、遠處轉移密切相關。LINC01232對大腸癌診斷的敏感性為53.13%,特異性為78.13%。在HCT-116和HT-29細胞中,下調LINC01232可以抑制細胞的增殖、侵襲和遷移。LINC01232可能通過直接調節臨近癌基因TM9SF2的表達以促進大腸癌的發生和發展。因此,有關LINC01232調節TM9SF2的具體機制、大腸癌患者血清中的表達水平驗證值得進一步深入探討。

