溴代雙Salamo型Zn(II)配合物的合成、結構及熒光性質
劉國華,張 陽,謝克鋒,李亞娟
(蘭州交通大學 化學與生物工程學院,蘭州 730070)
Salen型配體及其衍生物在現代配位化學中發揮著重要的作用[1],Salen型配體與不同的金屬離子相互作用后可形成結構迥異,性質不同的金屬配合物[2].因此,許多科學家對這些Salen型配合物的發光性能、催化性能、磁性質、電化學傳導性和非線性光學材料等方面進行了深入的研究[3-13].但是Salen型化合物的穩定性較差,為了提高Salen型化合物的穩定性,近年來,報道了許多用-CH=N-O-(CH2)n-O-N=CH-單元替代Salen型雙肟配體的-CH=N-(CH2)n-N=CH-單元從而形成Salamo型配體的研究[14-18],配體單元中的N2O2配位環境可與d區和f區金屬原子配位后產生結構新穎、性質多變的配合物.基于此,Nabeshima課題組和我們課題組分別對Salamo型配體及其配合物進行了廣泛的研究[19-21],發現此類配體及其配合物具有良好的發展潛力,有望成為配位化學新的研究熱點之一.
雙Salamo型配體與Zn(II)離子結合過程中常伴隨化學鍵空間位置及熒光性質的變化,研究這一配位反應可為環境中Zn(II)離子的識別與定量檢測提供基礎理論依據.基于此,本文設計并合成了以2,3-二羥基-1,4-萘二醛為母體,3,5-二溴水楊醛修飾末端基的雙Salamo型四肟配體(H4L),并以此配體與Zn(OAc)2·2H2O在乙醇和二氯甲烷的混合溶劑中反應,通過自然揮發法得到該配合物單晶體[Zn3L(AcO)2(EtOH)][Zn3L(AcO)2(H2O)2].通過元素分析、溶解性實驗、紅外光譜分析和X-射線單晶衍射等手段對配合物進行了表征,確定了其空間結構,并通過Hirshfeld表面分析和DFT理論計算對配合物進行了理論計算分析,通過熒光光譜分析了該配體與Zn(II)配合物的熒光性質.以上研究可為雙Salamo型配體與Zn(II)離子配位的理論研究和實際檢測識別提供可靠的實驗依據.
1 實驗部分
1.1 實驗試劑與儀器
實驗所用的化學試劑如表1所列.實驗儀器:Sartorius CP225D 電子秤;恒溫磁力攪拌器;旋轉蒸發儀RE-2000B;SHZ-DIII循環水真空泵;三用紫外分析燈;北京泰克X-4顯微熔點測定儀;德國Bruker VERTEX 70型紅外光譜儀;X-射線單晶衍射儀等.
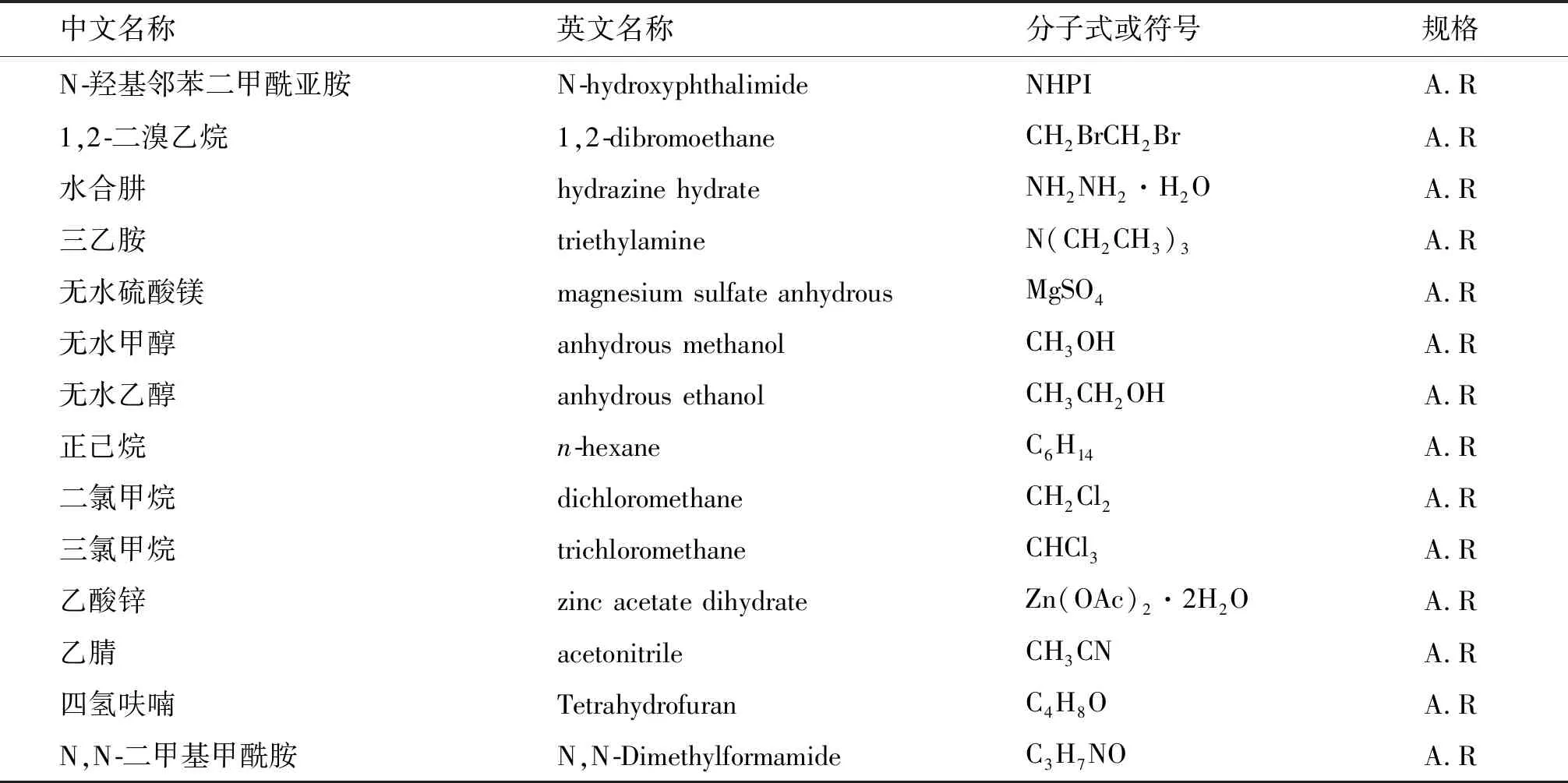
表1 試劑目錄
1.2 配體H4L的合成
1,2-二胺氧乙烷合成方法見文獻報道[22].相應的反應方程式如圖1所示.
稱取1,2-二胺氧乙烷0.184 g (2 mmol)溶于10 mL乙醇得溶液1,另稱取3,5-二溴水楊醛0.56 g (2 mmol)溶于20 mL乙醇得溶液2,將溶液2置于恒壓滴液漏斗中,然后緩慢滴加至溶液1中,反應溫度55 ℃,加熱攪拌6 h,冷卻至室溫后旋干溶劑得白色固體,并通過柱層析分離,得到單縮化合物3.將溶有2,3-二羥基-1,4-萘二醛的無水乙醇溶液置于恒壓滴液漏斗中,然后緩慢滴加至溶有單縮化合物3(0.704 g,2 mmol)的無水乙醇溶液中,混合液在溫度60 ℃下反應24 h,減壓蒸餾至有白色固體析出,過濾,烘干得目標配體H4L.反應方程式如圖2所示.
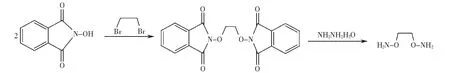
圖1 1,2-二胺氧乙烷的合成Fig.1 Synthesis of 1,2-diaminoxyethane
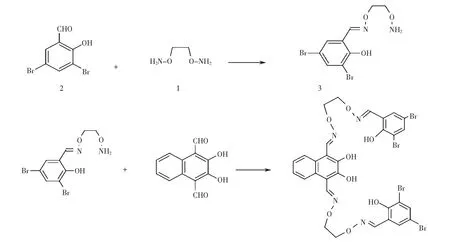
圖2 配體H4L的合成路線Fig.2 Synthetic route to the ligand H4L
1.3 Zn(II)配合物的合成及單晶培養
Zn(II)配合物的單晶體采用溶劑自然揮發法得到.室溫下,將Zn(OAc)2·2H2O (6.60 mg,0.03 mmol)溶于2 mL無水乙醇溶液中,另稱取H4L配體(8.83 mg,0.01 mmol)溶于4 mL二氯甲烷溶液中,將上述兩種溶液混合后顏色立即變成黃色.溶液磁力攪拌1 h,過濾,濾液封口靜置,10天后,溶劑部分揮發后得到了橙黃色透明單晶體,分子式:C70H61Br8N8O27Zn6.
1.4 X-射線單晶衍射數據
Zn(II)配合物晶體結構用SHELXTL程序算得,運用Patterson函數法求得金屬原子坐標,經Fourier合成進行多次迭代得到全部非氫原子坐標,再對所有非氫原子坐標和各向異性參數進行修正,其中氫原子由理論加氫得到.該配合物的單晶近似尺寸為0.23 mm×0.21 mm×0.17 mm,通過Bruker Smart 1000 CCD面探測衍射儀檢測,X-射線衍射數據通過石墨單色Mo-Kα輻射在154.89(10)K溫度下,用ω掃面方式采集.配合物CCDC:2055963,其鍵長、鍵角參數如表2所列.
2 結果與討論
2.1 元素分析
Zn(II)配合物的元素分析數據及組成見表3.由表3可以看出,該配合物的所有元素分析結果與理論值很接近.

表2 Zn(II)配合物的晶體學數據

2.2 溶解性測定
室溫下,測定了Zn(II)配合物在9種有機溶劑中的溶解性情況,結果見表4.由此可得:配體H4L與乙酸鋅(II)形成的Zn(II)配合物在9種有機溶劑中的溶解性差異較大,易溶于DMF和DMSO等強極性溶劑,在非極性溶劑中溶解性較差.
2.3 紅外光譜分析
配體H4L及其Zn(II)配合物的紅外光譜在500~4 000 cm-1區域內顯示出不同的峰,詳見表5.
自由配體H4L中的νC=N鍵的伸縮振動吸收峰出現在1 610 cm-1處,而在Zn(II)配合物中,νC=N鍵的伸縮振動吸收峰向低波數位移,出現在 1 602 cm-1處.相對于自由配體,這一吸收峰向低波數位移了8 cm-1,說明該配體有較強的π-接受能力,也表明配體的C=N基團中的氮原子與Zn(II)離子發生了配位.配體H4L在3 421 cm-1處的吸收峰為酚羥基O-H伸縮振動吸收峰,而在Zn(II)配合物中該位置的吸收峰消失了,說明配體H4L中的酚羥基去質子后與Zn(II)離子配位了.此外,在配合物中觀察到3 357 cm-1和3 409 cm-1處出現的吸收峰可分別歸屬為參與配位的乙醇分子和水分子的O-H伸縮振動譜帶.
在配體H4L中,νAr-O的伸縮振動吸收峰位于1 258 cm-1處,在配合物中此吸收峰出現在1 226 cm-1處.νAr-O的伸縮振動吸收峰向低波數發生了位移,可歸因于Zn(II)離子和酚氧原子之間形成了Zn-O鍵.此外,配合物在530 cm-1處出現了M-O鍵的吸收峰,而在自由配體H4L中未出現,也表明了配體與乙酸鋅發生了配位.
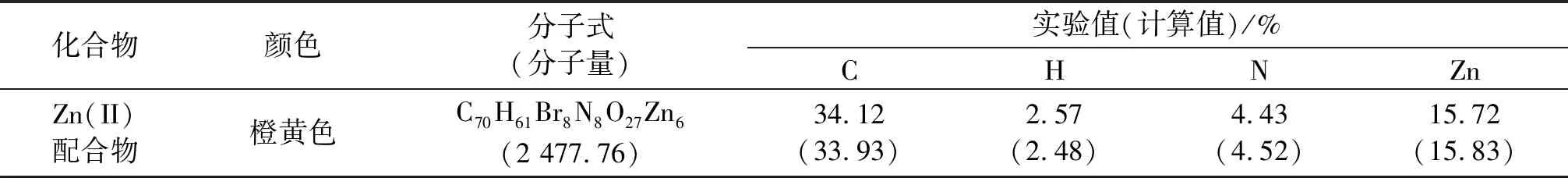
表3 Zn(II)配合物的元素分析數據

表4 Zn(II)配合物在有機溶劑中的溶解性測定
2.4 Zn(II)配合物的晶體結構分析
Zn(II)配合物的晶體結構及金屬原子的配位多面體如圖3所示.X-射線單晶衍射結構數據表明,Zn(II)配合物晶體的空間群為P21/n,屬于單斜晶系.該晶體[Zn3L(AcO)2(EtOH)][Zn3L(AcO)2(H2O)2]由兩個化學不等同,晶體學不等同的獨立三核結構單元(A和B)組成,其中,A部分由一個完全去質子化的配體(L)4-單元、三個Zn(II)原子、兩個橋聯的醋酸根離子,以及參與配位的一個乙醇分子構成;B部分由一個完全去質子化的配體(L)4-單元、三個Zn(II)原子、兩個橋聯的醋酸根離子,以及參與配位的兩個水分子構成.
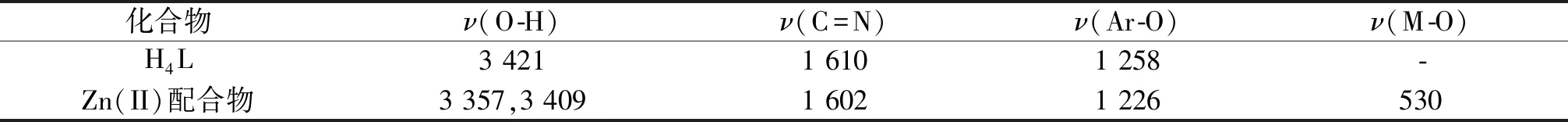
表5 配體H4L和Zn(II)配合物主要的紅外光譜數據
如圖3(a)所示,A部分兩端的兩個Zn(II)原子分別與配體提供的兩個肟氮原子、兩個酚氧原子以及雙齒橋聯醋酸根中的一個氧原子配位,而處于中心的Zn(II)原子分別與配體的兩個酚氧原子、一個乙醇分子的氧原子和雙齒橋聯醋酸根中的兩個氧原子配位.Zn1原子是五配位的,與配體中兩個完全去質子的酚氧原子(O1,O4)和肟氮上的兩個氮原子(N1,N2)以及橋聯醋酸根上的一個氧原子(O12)配位.與之對稱的Zn3原子也是五配位的,配位模式同Zn1一樣.中心Zn2原子與配體中兩個完全去質子的酚氧(O4,O5)、一個乙醇分子的氧原子(O13)和雙齒橋聯醋酸根上的兩個氧原子(O10,O11)配位,形成五配位構型.配合物中配位金屬原子的空間構型可通過計算τ值來確定,公式:τ=(最大鍵角-第二大鍵角)/60,表6給出了Zn(II)配合物的主要鍵長與鍵角.依此計算可知,三個Zn(II)原子的空間構型均為三角雙錐(見圖3(b)).
同樣的,如圖3(a),B部分兩端的兩個Zn(II)原子(Zn4,Zn6)分別被兩個N2O2空腔包圍,均是五配位的三角雙錐空間構型.其中,Zn4原子與配體提供的兩個肟氮原子(N5,N6)、兩個酚氧原子(O14,O17)以及雙齒橋聯醋酸根中的一個氧原子(O23)配位;Zn6原子坐落在另外一個空腔內(N7,N8,O18,O21),同時與雙齒橋聯醋酸根中的一個氧原子(O25)配位.而中心的Zn(II)原子(Zn5)是六配位的,與配體中兩個完全去質子的酚氧原子(O17,O18)、兩個水分子的氧原子(O26,O27)和雙齒橋聯醋酸根上的兩個氧原子(O22,O24)配位,形成扭曲的八面體空間構型(見圖3(b)).
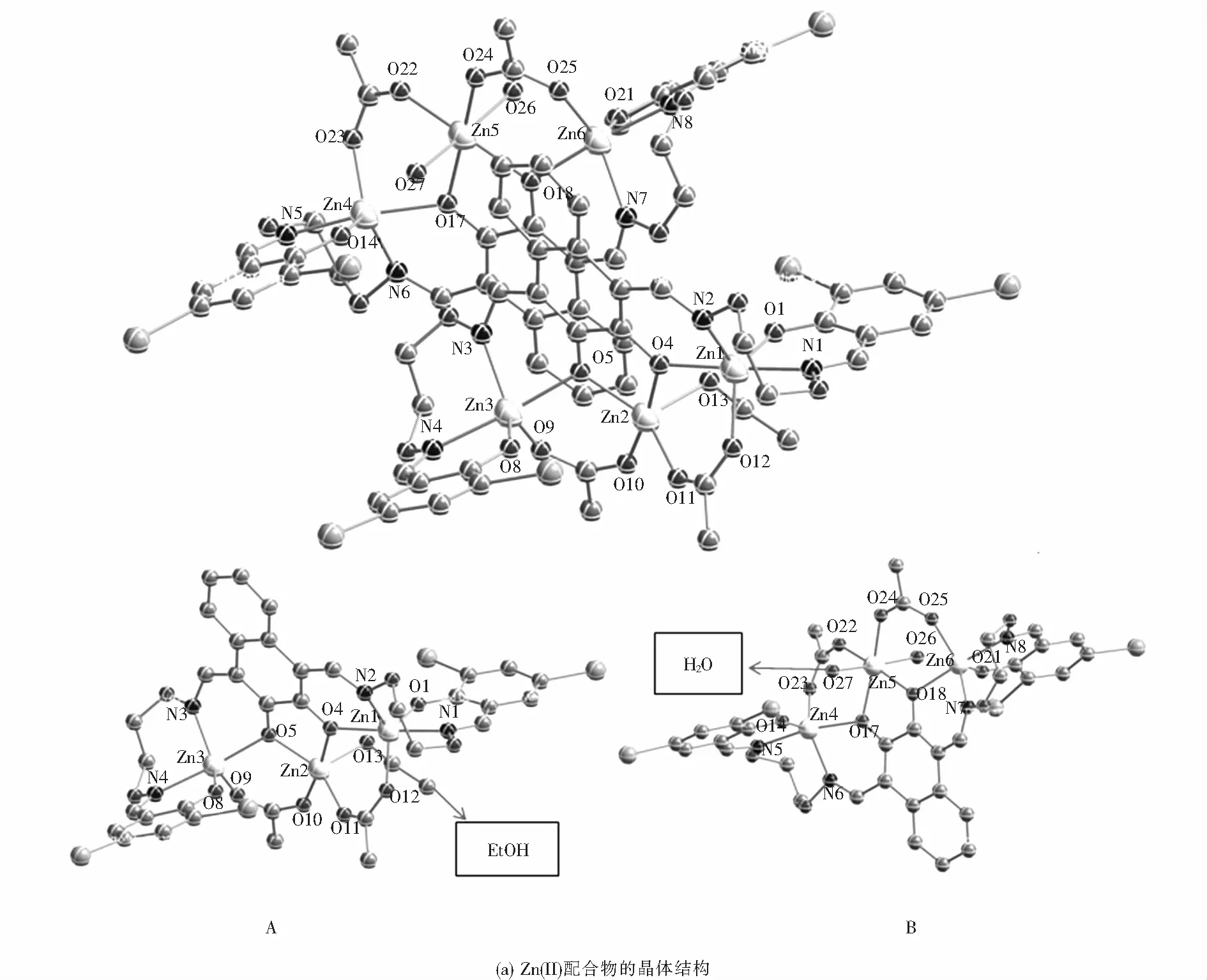
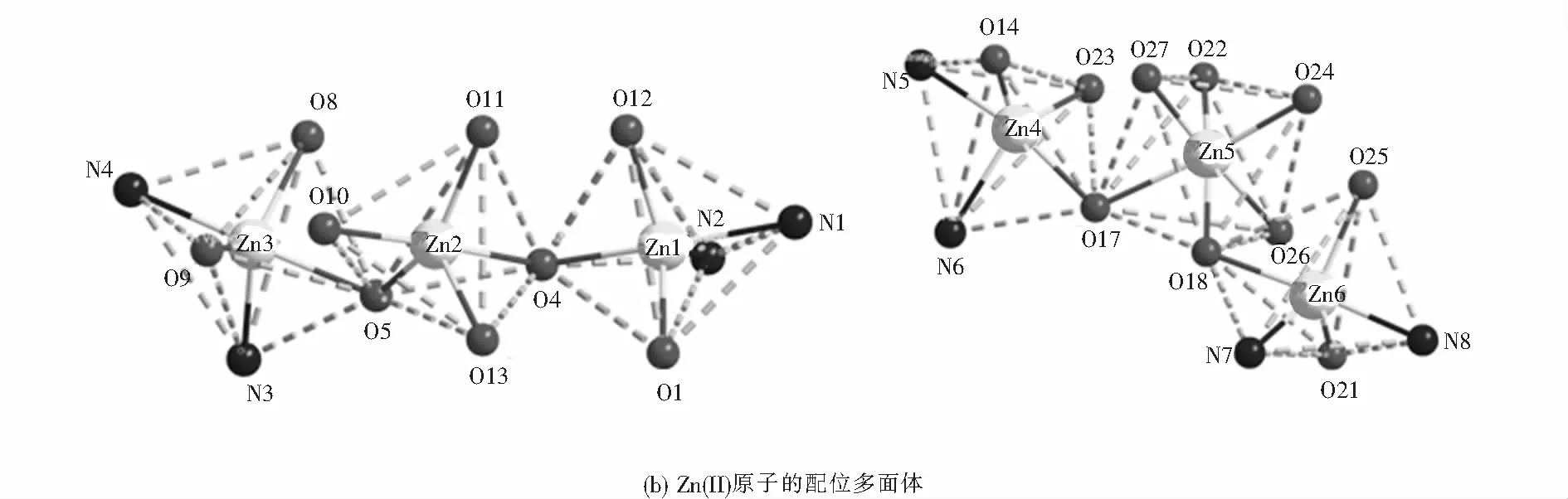
圖3 Zn(II)配合物的晶體結構及Zn(II)原子的配位構型Fig.3 Crystal structure of Zn(II) complex and coordination configuration of Zn(II) atom
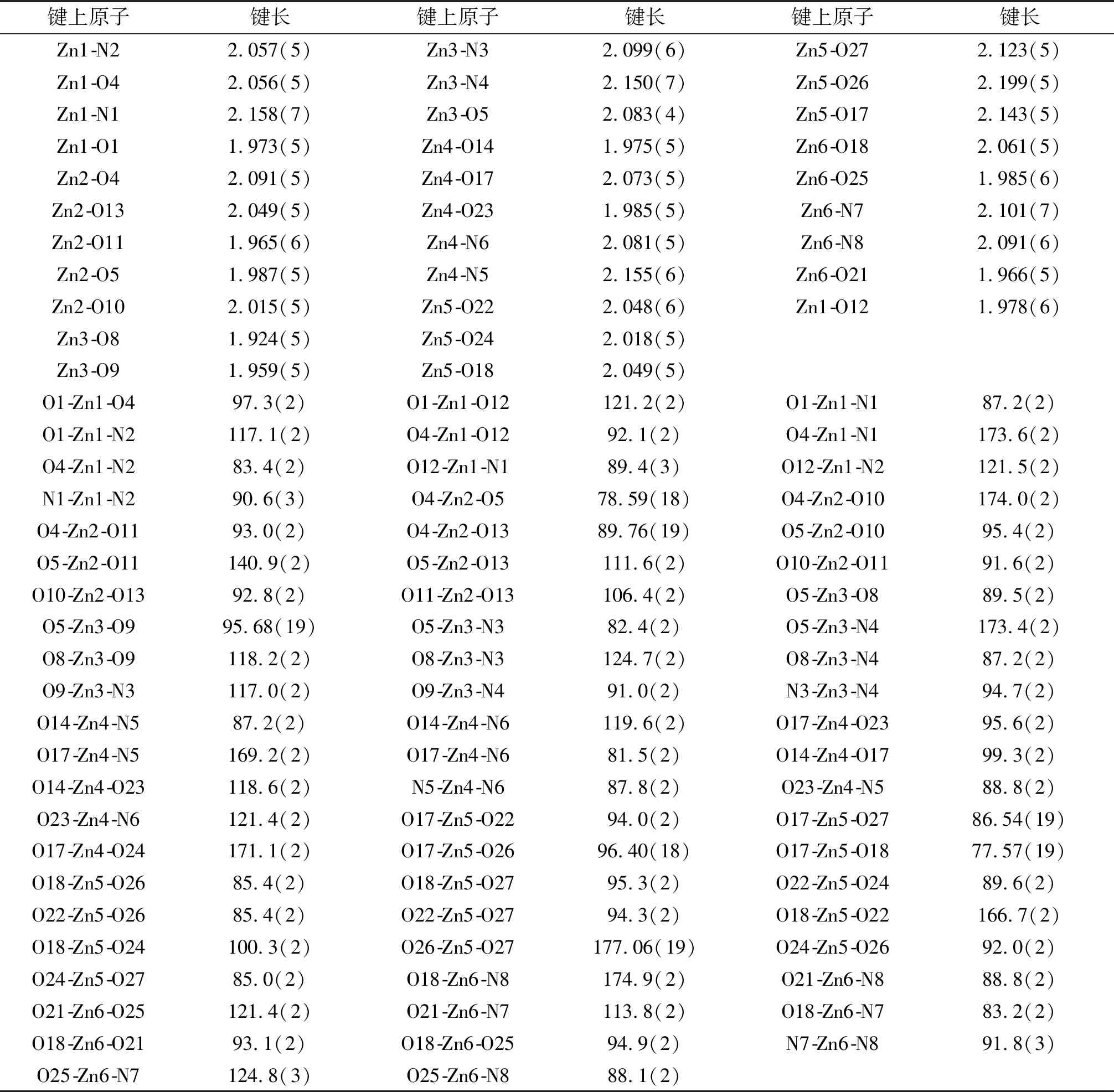
表6 鋅(II)配合物的主要鍵長和鍵角
2.5 Zn(II)配合物的超分子作用分析
如圖4(a),4(b)所示,配合物中有十一對分子內氫鍵相互作用(O13-H13…Br2,O13-H13…O1,O26-H26A…O21,O26-H26B…O22,O27-H27A…O24,O27-H27B…Br5,O27-H27B…O14,C8-H8B…O12,C23-H23B…O9,C44-H44A…O23和C59-H59A…O25),另外配合物還有四對分子間氫鍵相互作用(C9-H9B…O15,C30-H30…O3,C60-H60…O10,C60-H60…O11).通過這些分子間氫鍵沿著確定(bc)方向的相互作用形成結構穩定的二維(2-D)超分子結構.除此之外,如圖4(c)所示,Zn(II)配合物分子通過分子間氫鍵相互作用形成了無限三維(3-D)超分子結構.Zn(II)配合物的氫鍵相互作用列于表7中.
2.6 Zn(II)配合物的Hirshfeld表面分析
通過Crystal Explorer 程序對Zn(II)配合物進行Hirshfeld表面分析,結果如圖5所示,顯示了dnorm、de和di映射上電子云分布情況.圖中箭頭所示不同區域分別表示配合物中O…H相互作用和C…H/H…C,H…H等相互作用.
圖6為Hirshfeld表面分析二維指紋圖,完整指紋的輪廓顯示為灰色,各分圖中的黑色區域代表不同的短程相互作用.通過計算得出配合物中C…H/H…C、O…H/H…O、H…H/H…H和Br…H/H…Br相互作用的占比分別為17.7%、8.1%、38.6%和21.4%,正是由于這些短程相互作用使Zn(II)配合物穩定存在.
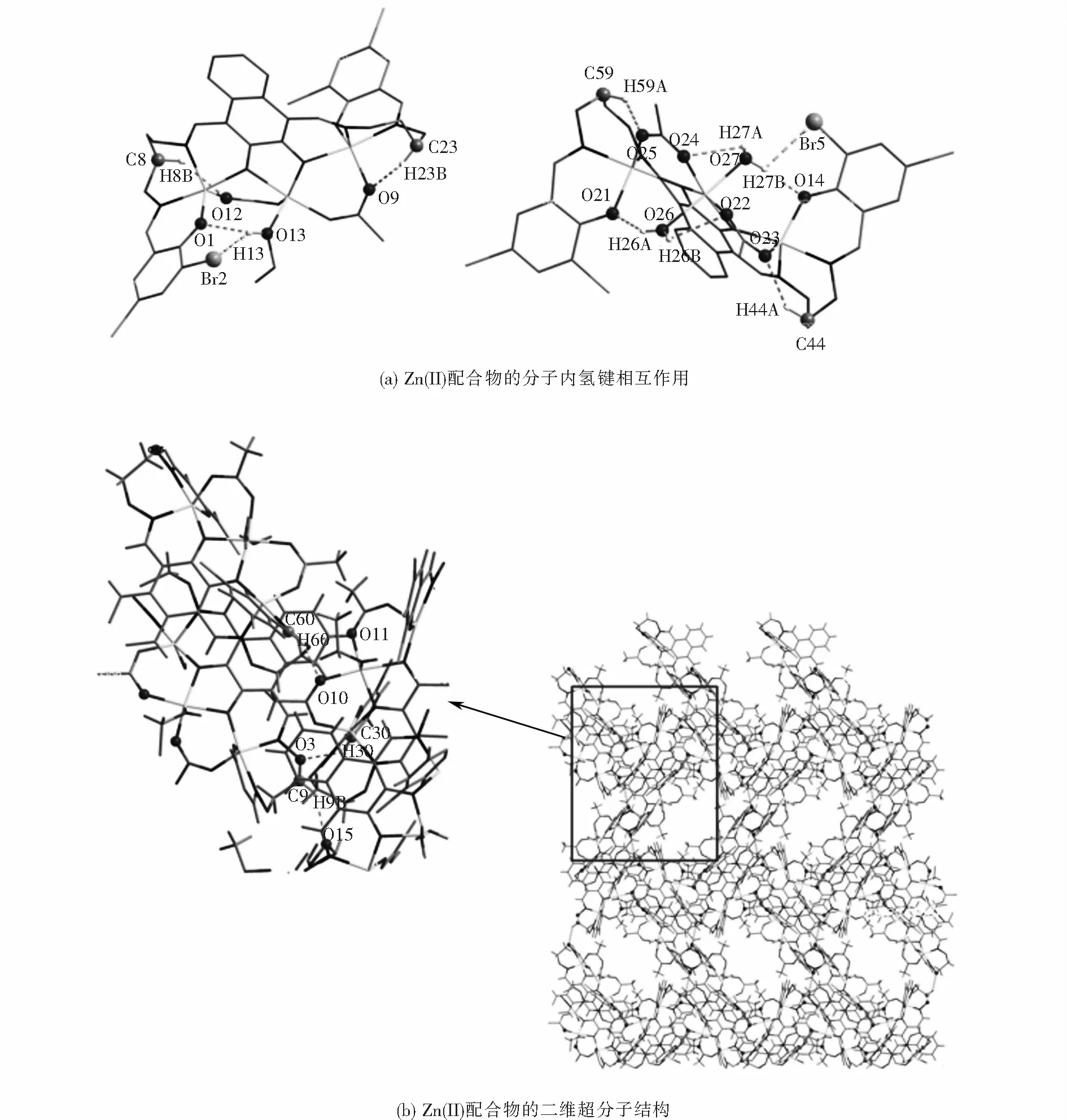
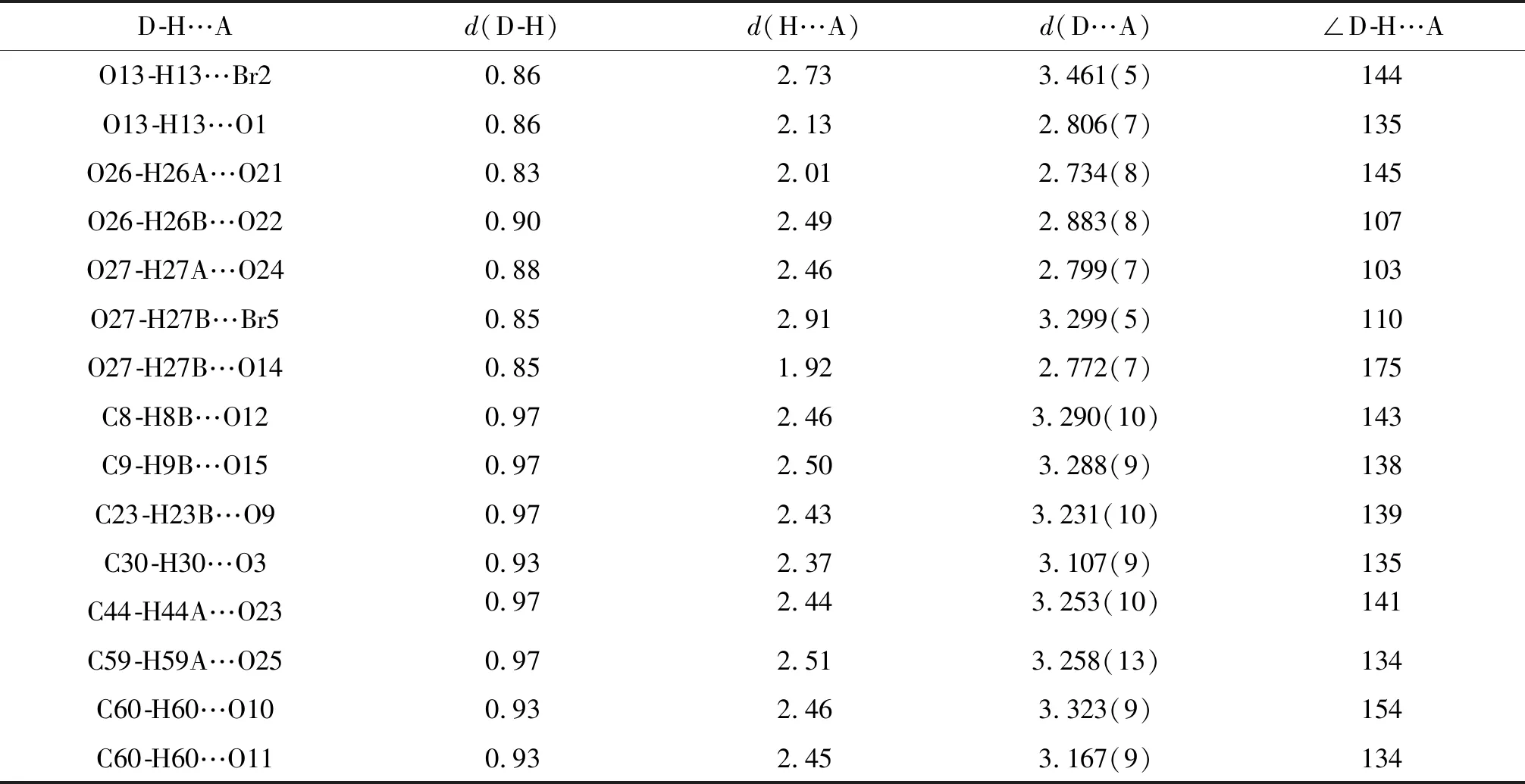
表7 Zn(II)配合物的分子內及分子間氫鍵的鍵長及鍵角
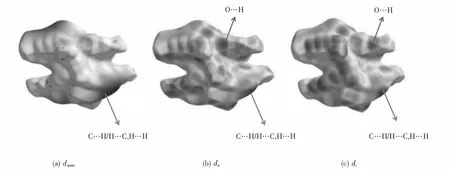
圖5 Hirshfeld表面分析Fig.5 Hirshfeld surface analysis
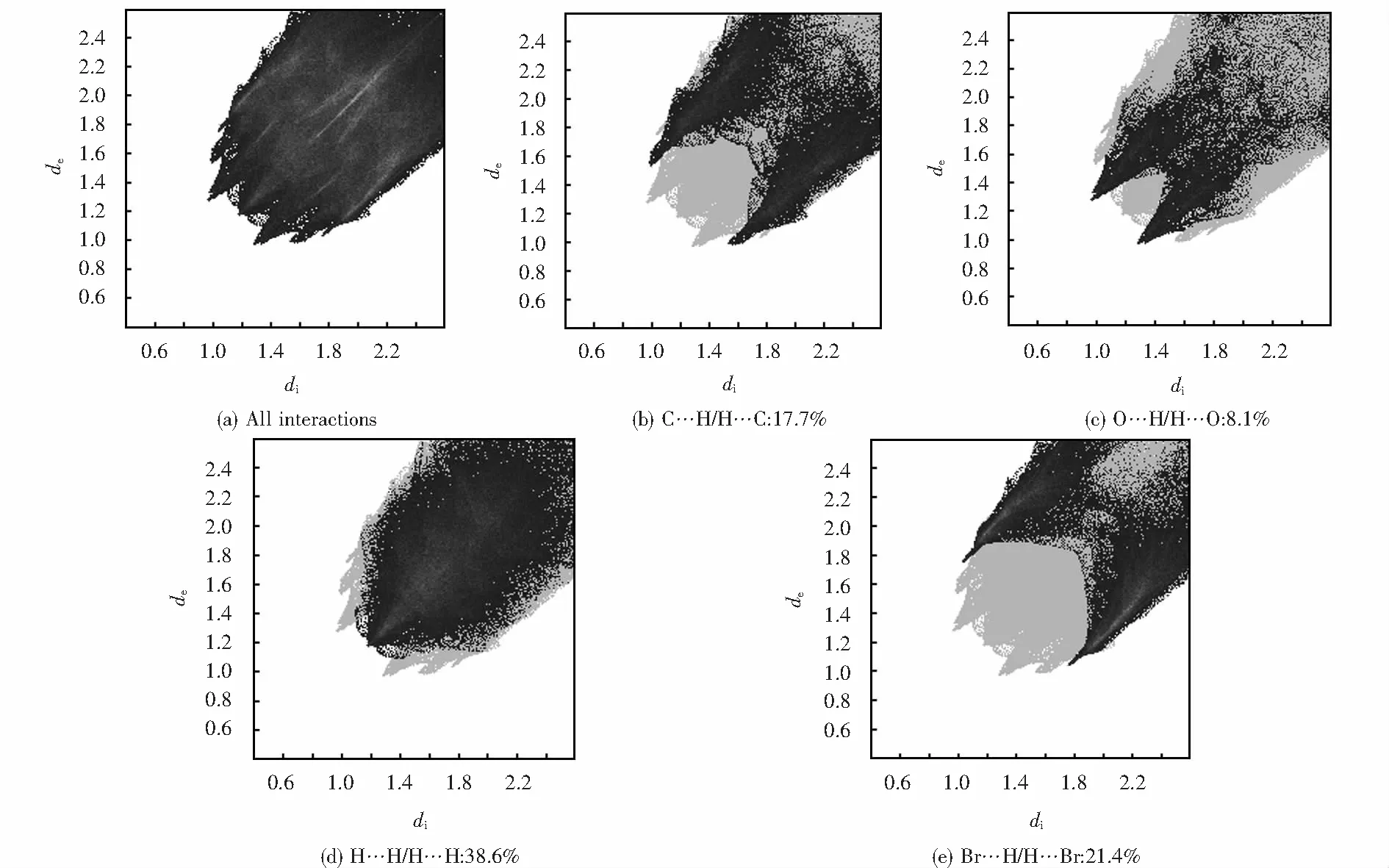
圖6 Zn(II)配合物Hirshfeld表面接觸百分比指紋圖Fig.6 Fingerprint of Hirshfeld surface contact percentage of Zn(II) complex
2.7 Zn(II)配合物的DFT理論計算
為了深入研究Zn(II)配合物的電子結構,使用Gaussian-09軟件對Zn(II)配合物進行DFT計算,通過密度泛函理論計算了分子軌道的能級差.Zn(II)配合物的分子軌道如圖7所示,配合物的分子軌道能級可從A、B兩部分分析,分別對應乙醇參與配位的獨立單元和水分子參與配位的獨立單元.乙醇參與配位的A獨立單元中,HOMO分子軌道電子集中分布在3,5-二溴水楊醛上,LUMO分子軌道集中分布在Zn(II)原子和萘環上.分子中能量EHOMO=-5.655 2 eV,ELUMO=-2.530 1 eV,兩個分子軌道的能極差(ΔE=ELUMO-EHOMO) 是3.125 1 eV.水分子參與配位的B獨立單元中,存在α和β兩個自旋分子軌道,α自旋軌道中EHOMO=-5.427 2 eV,ELUMO=-2.365 2 eV,能極差ΔE=3.062 eV;β自旋軌道中EHOMO=-5.732 5 eV,ELUMO=-2.588 9 eV,能極差ΔE=3.143 6 eV.ΔE值較小,表明配合物穩定性高.結果表明,在Zn(II)配合物的形成過程中,電子發生躍遷,形成了穩定性更高的配合物.
2.8 熒光光譜分析
圖8顯示了在1.0×10-3mol/L的DMF溶液中測定的配體H4L及其相應的Zn(II)配合物的熒光光譜.熒光測定參數值為激發波長412 nm,激發波長和發射波長的狹縫寬度均為10 nm,配體H4L在501 nm處出現一個較弱的發射峰,把它歸屬為苯環中的的π-π*躍遷.而Zn(II)配合物在此波長下激發時,490 nm處產生了一個強烈的發射峰,相對配體藍移了11 nm,這可歸因為配體到金屬離子的電荷轉移(LMCT)[23],說明Zn(II)離子與配體H4L配位形成了配合物.其熒光增強機理是由于具有d10電子構型的Zn(II)離子與配體H4L中的N2O2基團配位形成螯合環,增大了分子共軛程度,降低分子振動,從而導致配合物剛性增強,產生螯合熒光增強效應(CHEF)[18].
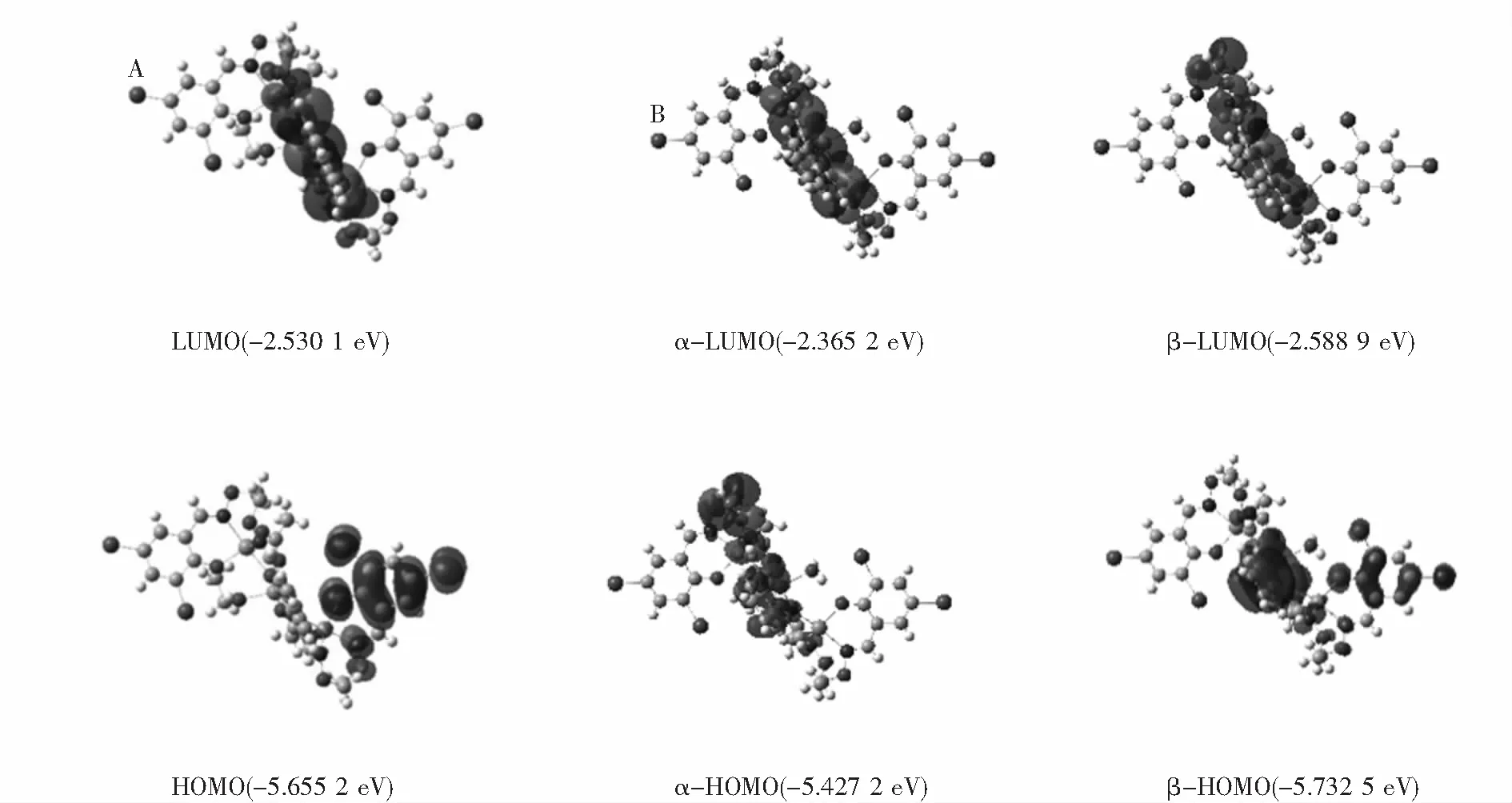
圖7 Zn(II)配合物的分子軌道圖Fig.7 Molecular orbital diagram of Zn(II) complex
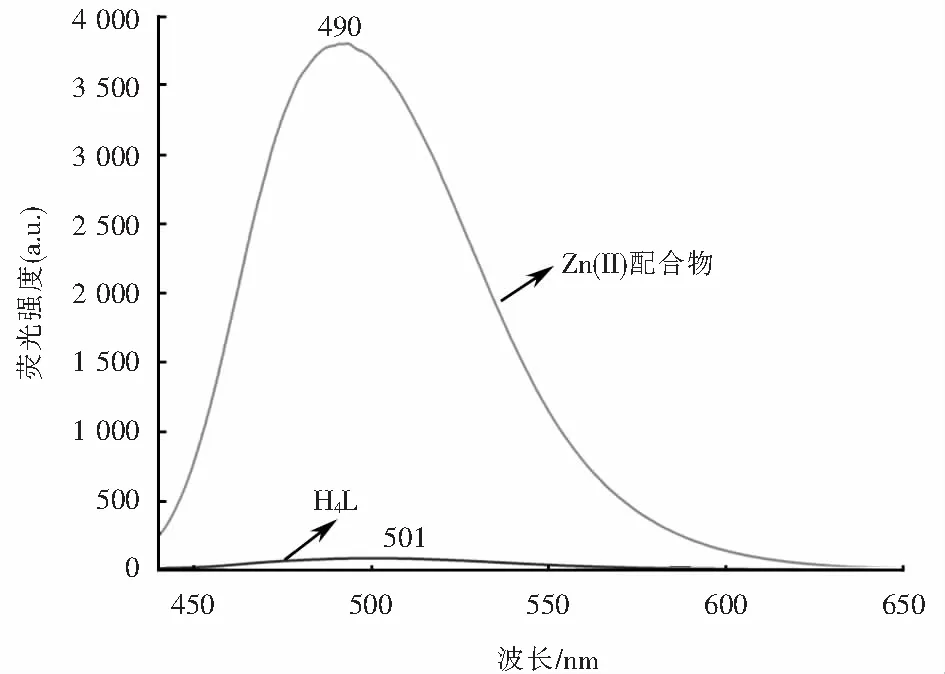
圖8 配體H4L和Zn(II)配合物的熒光光譜Fig.8 Fluorescence spectra of ligand H4L and Zn(II) complex
3 結論
本文合成出了一種新的四溴代雙Salamo型配體H4L,通過溶劑自然揮發法得到該配體與Zn(OAc)2·2H2O反應后的六核Zn(II)配合物單晶:[Zn3L(AcO)2(EtOH)][Zn3L(AcO)2(H2O)2],利用多種測試方法對配體H4L及其Zn(II)配合物進行了結構分析和性質表征.結果發現,該配合物在不同溶劑中溶解性差異大;紅外光譜分析表明配體 H4L的N2O2配位環境有利于Zn(II)原子與之配位;晶體結構分析發現該配合物含有兩個不同的配位單元,兩個配位單元的相同之處是均含有三個Zn(II)原子、一個去質子化的(L)4-單元、兩個橋聯的醋酸根離子,不同之處在于中心Zn(II)原子配位的溶劑分子,一個是乙醇分子,另外一個是水分子參與配位;Hirshfeld表面分析表明配合物分子間存在氫鍵作用以及不同原子間的短程相互作用;通過DFT理論計算研究進一步證實了配合物的結構穩定性;熒光光譜結果表明,在同一激發波長下,當配體形成Zn(II)配合物后,熒光發射峰明顯增強,其機理為螯合熒光增強效應(CHEF).以上工作都為環境中Zn(II)離子的識別與定量檢測提供基礎理論依據,對雙Salamo型配合物的進一步研究具有指導意義.

