磁化有機改性膨潤土吸附水中全氟化合物的實驗
洪 雷,丁倩云,孫建強,常 青
(蘭州交通大學 環境與市政工程學院,蘭州 730070)
全氟辛烷磺酸(PFOS)和全氟辛酸(PFOA)作為全氟化合物的兩種典型代表,廣泛分布于全球水環境及生物體內,常被發現存在于人體血漿中,已經嚴重危害到人類健康[1-2].PFOS 和PFOA是疏水疏油性物質(碳氟鏈呈疏水性,末段基團呈疏油性),在水中常以陰離子的形式存在,有較大的溶解度(PFOS為570 mg·L-1,PFOA為9.5 g·L-1)及很高的穩定性,使得傳統技術很難去除水中的全氟化合物[3-4].膨潤土作為天然吸附劑,具有環保、儲量豐富等優勢,在水處理領域中具有較大的潛力.然而天然膨潤土不能有效地吸附有機污染物,難以實現固液的快速分離,限制了實際應用[5-6].近年來,有研究者利用陰陽離子表面活性劑改性制得有機膨潤土以高效去除有機污染物[7];同時,將納米Fe3O4負載到膨潤土中能有效改善其固液分離效果[8].基于此,將納米Fe3O4及十六烷基三甲基溴化銨(CTAB)同時負載到膨潤土中,制得磁化有機改性膨潤土(四氧化三鐵-十六烷基三甲基溴化銨-膨潤土,Fe3O4-CTAB-BENT復合材料,通過靜態吸附實驗研究不同濃度的PFOS及PFOA在吸附劑Fe3O4-CTAB-BENT上的吸附性能,并分別考察pH值、腐殖酸(HA)和無機共存離子在不同濃度范圍對吸附效果產生的影響.
1 材料與方法
1.1 試劑及儀器
主要試劑:膨潤土(鈉基,來自內蒙);PFOA/PFOS(純度≥96%,Sigma-Aldrich公司);FeS04·7H20(AR,天津大茂化學試劑廠);FeCl3·6H20(AR,天津大茂化學試劑廠);十六烷基三甲基溴化銨(AR,天津大茂化學試劑廠);甲醇(色譜純,山東禹王化工公司);實驗水樣由去離子水配制而成.
主要儀器:SHA-82A恒溫振蕩器(金壇市天竟實驗儀器廠);Waters Alliance型高效液相色譜質譜聯用儀(美國安捷倫公司);PHS-3C型pH計(上海儀電科學儀器股份公司).
1.2 Fe3O4-CTAB-BENT的制備
將0.1 mol·L-1的FeCl3·6H20溶液與0.05 mol·L-1的FeS04·7H20溶液各250 mL混合于加有5 g膨潤土的燒杯中,置于恒溫水浴振蕩器室溫下振蕩1 h.升溫至80 ℃時,用NaOH溶液將混合液pH調節至13后繼續振蕩1 h,取出燒杯并固液分離,用去離子水反復洗滌固體材料3次左右,后置于烘箱內以105 ℃的溫度進行烘干,研磨后制得100目的磁性膨潤土(Fe3O4-BENT).
配制濃度為25 mmol·L-1的CTAB溶液250 mL,將其與3.5 g Fe3O4-BENT混合于80 ℃充分攪拌3 h,固液分離,將所得固體以去離子水洗滌若干次以排除Br-,將固體材料置于60 ℃烘箱內烘干,研磨100目后制得磁化有機改性膨潤土(Fe3O4-CTAB-BENT).
1.3 吸附實驗
選用聚丙烯錐形瓶,加入30 mg的Fe3O4-CTAB-BENT和200 mL濃度為50 mg·L-1的PFOS或PFOA的模擬水樣進行吸附實驗.振蕩頻率為150 rpm,實驗溫度為25 ℃.實驗使用0.1 mol·L-1HCl和0.1 mol·L-1NaOH調節溶液pH值.反應后利用磁鐵裝置外加磁場進行磁分離30 s,倒去水樣,加入NaOH并浸泡Fe3O4-CTAB-BENT材料2 h以上實現脫附再生,后用去離子水反復洗滌干燥.所有實驗都重復三次,取其平均值進行分析.
1.4 PFOA/PFOS測試方法
利用高效液相色譜-質譜聯用儀測定水樣中PFOA、PFOS的含量.主要測試條件:色譜柱流動相甲醇與水體積比70∶30,進樣量為10 μL,柱溫40 ℃.質譜電離采用電噴霧離子化源,以負離子模式的掃描方式選擇性監測離子質核比499的分子離子峰.毛細管溫度275 ℃,電壓5 000 V.鞘氣和輔助氣分別為氮氣和氦氣,其流量分別為10.5 L/min和3 L/min.
2 結果與討論
2.1 吸附動力學
PFOA及PFOS在Fe3O4-CTAB-BENT上的吸附動力學曲線,如圖1所示.
由圖1看出,Fe3O4-CTAB-BENT對PFOA和PFOS初期吸附速率較大,2 h后基本趨于平衡.這是由于吸附初期, PFOA和PFOS主要吸附在吸附劑外表面上,吸附速率較快;隨著吸附的進行,溶液中PFOA和PFOS濃度逐漸降低,導致溶液與吸附劑表面濃度梯度減小而使擴散現象減弱,同時Fe3O4-CTAB-BENT對兩種全氟化合物的表層吸附也幾乎接近飽和,PFOA和PFOS開始向吸附劑內部微孔結構進行擴散,擴散能力相對減弱,吸附速率逐漸趨緩;吸附后期,主要為膨潤土內表面吸附,濃度驅動力越來越小,吸附過程達到平衡.
分別用偽一階、偽二階動力學方程擬合實驗所得數據.偽一階動力學方程和偽二階動力學方程表述如下[9]:
偽一階動力學方程:
ln(qe-qt)=lnqe-k1t;
(1)
偽二階動力學方程:
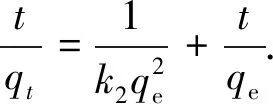
(2)
式中:k1、k2分別為偽一階反應速率常數,min-1和偽二階反應速率常數,g·mg-1·min-1;qe為平衡吸附量,mg·g-1,qt為t時刻的吸附量,mg·g-1.
動力學擬合參數見表1,Fe3O4-CTAB-BENT吸附兩種碳鏈長度為8的全氟化合物經過偽二階動力學模型擬合效果更佳,是由于偽二階動力學模型更貼近于實際,包括了吸附過程中的液膜擴散現象、吸附和顆粒內部擴散過程[10],更能全面真實地反映PFOA和PFOS在Fe3O4-CTAB-BENT上的吸附行為.
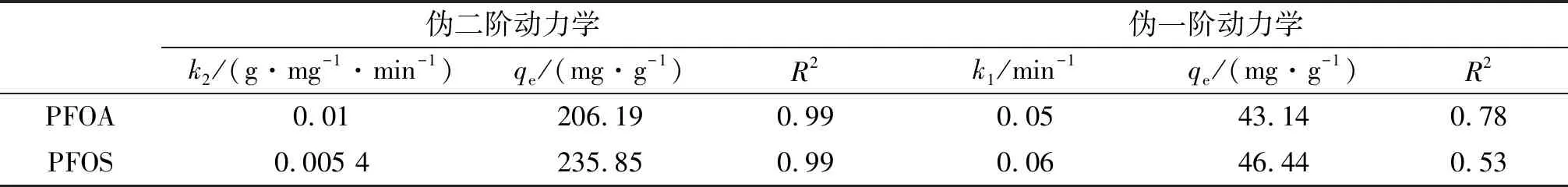
表1 PFOA及PFOS吸附動力學擬合
2.2 吸附等溫線
PFOA及PFOS在吸附劑Fe3O4-CTAB-BENT上的吸附等溫線如圖2所示.
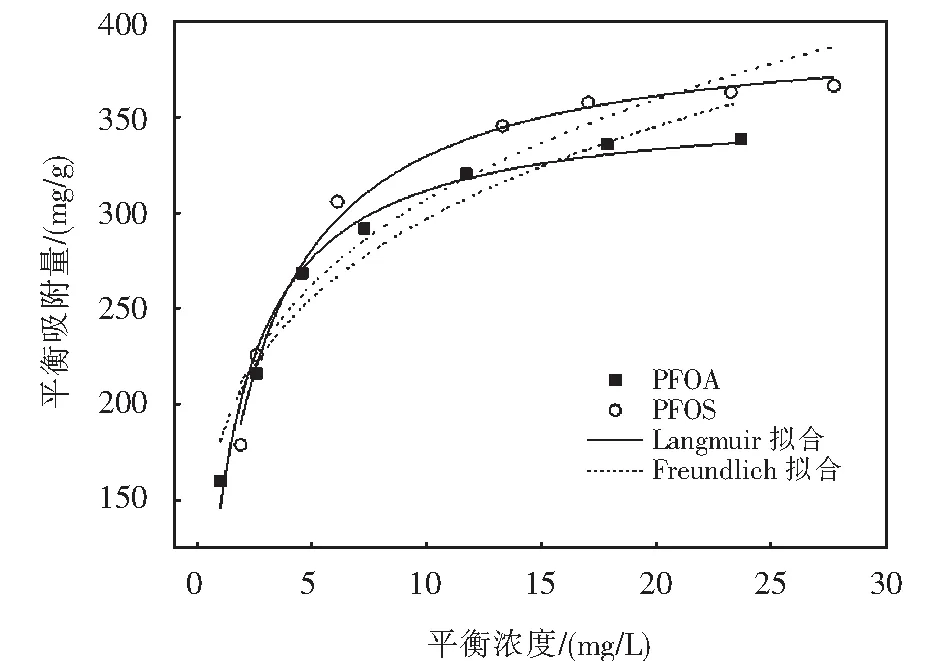
圖2 PFOA及PFOS吸附等溫線Fig.2 Adsorption isotherm of PFOA and PFOS
用Langmuir、Freundlich、Dubinin-Radushkevich(D-R)、Redlich-Peterson(R-P)、Tempkin吸附等溫模型對圖2的數據進行擬合,擬合所得的參數如表2所列.Langmuir、Freundlich、D-R、Tempkin、R-P模型表達式如(3)~(7)所示[11-14].
Langmuir(L)模型:
(3)
式中:qe為吸附平衡時的平衡吸附量,mg·g-1;Ce則為全氟化合物的平衡濃度,mg·L-1;qm指最大吸附量,mg·g-1;kL為L型等溫線的吸附常數,L·mg-1.
Freundlich(F)模型:
(4)
式中:kF為Freundlich模型常數,表示吸附劑吸附能力的強弱;1/n可代表Freundlich模型的吸附強度,n可以判斷吸附的優惠性,當1 Dubinin-Radushkevich(D-R)模型: lnqe=lnq0-γε2. (5) Tempkin模型: qe=Blnkt+BlnCe. (6) 式中:kt為Tempkin等溫線常數,L·mol-1;B為受熱力學溫度影響的系數,kJ·mol-1. Redlich-Peterson(R-P)模型: (7) 式中:kR,αR和α均為Redlich-Peterson模型的經驗常數. 根據Langmuir模型的擬合結果可知,Langmuir模型可以很好地用于描述Fe3O4-CTAB-BENT對PFOA和PFOS的吸附,且說明Fe3O4-CTAB-BENT對PFOA和PFOS的吸附屬于單層吸附,最大吸附容量分別為362.9 mg·g-1、391.8 mg·g-1.從表2還可見,D-R模型和R-P模型亦可用于描述Fe3O4-CTAB-BENT對PFOS吸附數據,已知D-R模型中E<8 kJ·mol-1時反應為物理吸附,當8 kJ·mol-1 表2 吸附等溫線擬合 已有研究者證實溶液pH值變化,可導致吸附劑的表面化學性質及PFOA、PFOS在水溶液中的存在形式和溶解度發生變化,從而影響吸附過程[16-17].25 ℃時不同溶液pH對吸附效果的影響如圖3所示. 由圖3可知,當實驗pH值范圍控制在2.0~10.0內,隨溶液pH值的升高,Fe3O4-CTAB-BENT對PFOA和PFOS的吸附有明顯的減弱,原因是pH低導致溶液中含有更多的H+,可使Fe3O4-CTAB-BENT與液體界面結合更多H+而表現為正電,與以陰離子形式存在的PFOA及PFOS間形成較強的靜電引力作用,從而增強吸附效果.相反,當溶液pH較高時Fe3O4-CTAB-BENT表面的固液界面存在更多的OH-,靜電排斥作用使得吸附效果減弱[17],此時, Fe3O4-CTAB-BENT仍可吸附一定量的PFOA、PFOS則說明該吸附過程還存在其他吸附機理如前文所述離子交換作用及疏水作用. 圖3 pH對PFOA及PFOS吸附效果的影響Fig.3 Effect of pH on the adsorption of PFOA and PFOS 當pH一定的情況下,Fe3O4-CTAB-BENT對碳鏈長度相同但官能團不同的PFOA、PFOS吸附能力不同,PFOA的吸附量均低于PFOS的吸附量,這與Punyapalakul等[18]研究沸石吸附PFOA及PFOS結果類似.雖然PFOA與PFOS在溶液中均多以陰離子形式存在,但PFOS所具有的磺酸基團的電性及活性比PFOA所具有的羧酸基團強,因此顯示了更強的吸附能力. 目前多數研究顯示水中若有天然有機物(NOM)的存在,會減弱目標污染物的吸附,而HA是NOM的主要成分,約占水中總有機物的50%~90%,是飲用水消毒副產物的重要前驅物[19-20].為探究HA對Fe3O4-CTAB-BENT吸附目標污染物的影響程度,配制濃度為5~50 mg·L-1的HA溶液,分別投加PFOA、PFOS于HA溶液中,在pH為3時HA與PFOA、PFOS的競爭吸附如圖4所示. 圖4中,HA濃度介于5~15 mg·L-1時,HA的存在幾乎不會影響Fe3O4-CTAB-BENT對PFOA及PFOS的吸附;當HA濃度由15 mg·L-1增至50 mg·L-1時溶液中HA的存在對PFOA及PFOS的吸附影響變得明顯,而且在與HA競爭時PFOA比PFOS吸附能力更弱.因為HA吸附在鋁硅材料上主要依靠疏水作用,其存在會占據Fe3O4-CTAB-BENT表面上的有效吸附位點導致PFOA及PFOS吸附能力減弱. 圖4 HA對PFOA及PFOS吸附效果的影響Fig.4 Effect of HA on the adsorption of PFOA and PFOS 圖5 共存離子對PFOS(a)及PFOA(b)吸附效果的影響Fig.5 Effect of coexisting ions on the adsorption of PFOS(a) and PFOA(b) 圖6是吸附劑的磁滯回線.其飽和磁化強度為7.3 emu·g-1,這意味著磁性復合材料具有較強磁性;磁滯回線過原點且以原點為中心,粒子的矯頑力為0,表明具有良好的順磁性[22]. 為進一步表明Fe3O4-CTAB-BENT的回收及再生能力,圖7(a)、7(b)、7(c)分別為未經回收、自然沉降20 min、使用磁鐵外加磁場30 s后Fe3O4-CTAB-BENT在水樣中的分布效果圖.圖7(b)可知磁化有機改性膨潤土具有一定的自然沉降能力,圖7(c)可知利用磁性裝置可迅速實現固液分離,倒出溶液即可得到Fe3O4-CTAB-BENT,相對于常見的離心分離,此回收方式更加便捷經濟. 圖6 Fe3O4-CTAB-BENT磁滯回曲線Fig.6 Magnetization and magnetic separation of Fe3O4-CTAB-BENT 圖8則表示Fe3O4-CTAB-BENT經四次再生后吸附能力的變化,第1次脫附再生后吸附劑對PFOA與PFOS吸附容量分別為190.5 mg·g-1、227.5 mg·g-1,第4次再生后吸附劑對PFOA及PFOS的吸附容量仍可保持在120 mg·g-1以上,顯示出了Fe3O4-CTAB-BENT較好的可循環利用能力. 圖7 Fe3O4-CTAB-BENT的回收Fig.7 Recycling of Fe3O4-CTAB-BENT 圖8 Fe3O4-CTAB-BENT的再生Fig.8 Regeneration of Fe3O4-CTAB-BENT 1) Fe3O4-CTAB-BENT對水中的PFOA、PFOS具備良好的吸附能力,吸附量分別達到206.19 mg·g-1和235.85 mg·g-1,吸附過程符合偽二階動力學和Langmuir模型. 2) pH值為2~10時,酸性條件更有利于吸附反應的進行.同pH條件下PFOS在Fe3O4-CTAB-BENT上的吸附能力優于PFOA. 3) 低濃度HA的存在幾乎不會影響吸附,當HA濃度高于15 mg·L-1時,Fe3O4-CTAB-BENT對水中PFOS和PFOA的吸附量會因競爭吸附而有所下降.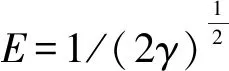
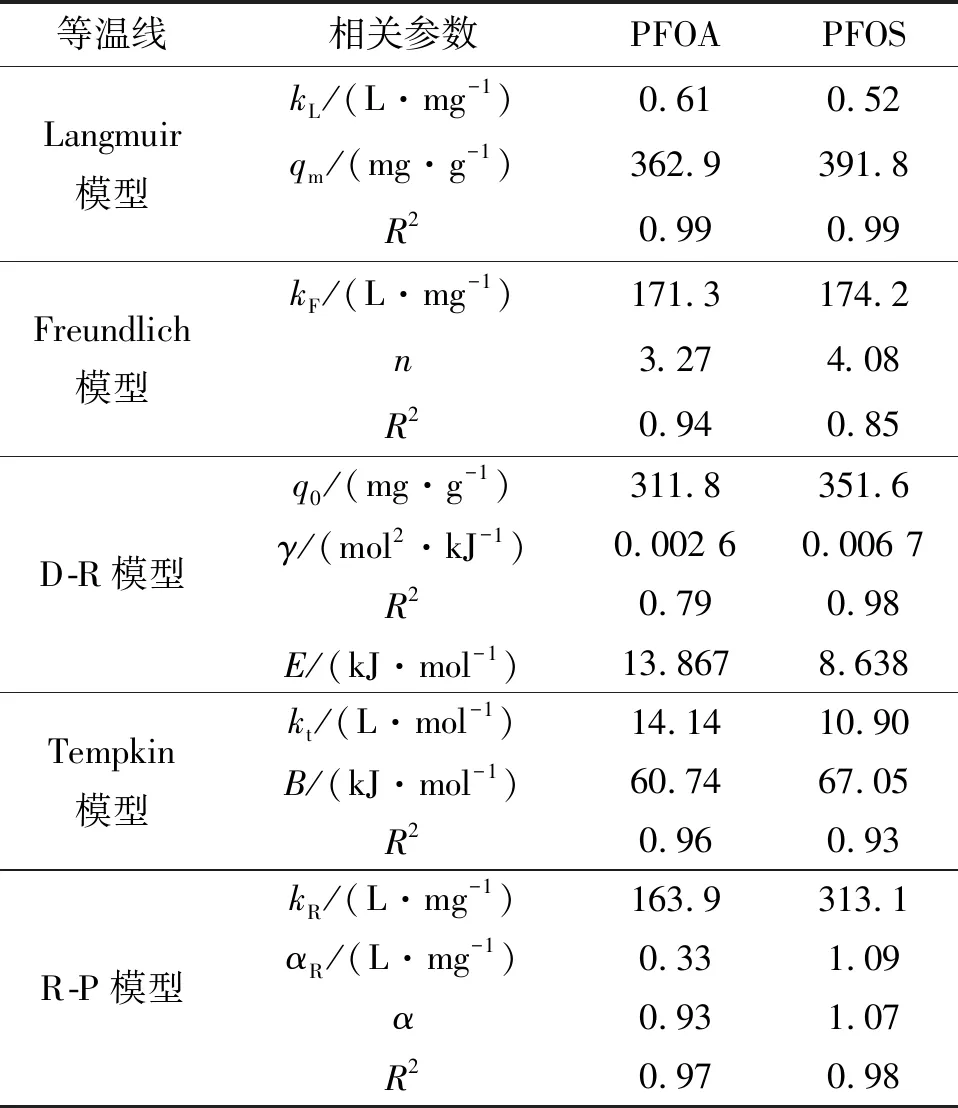
2.3 pH值影響
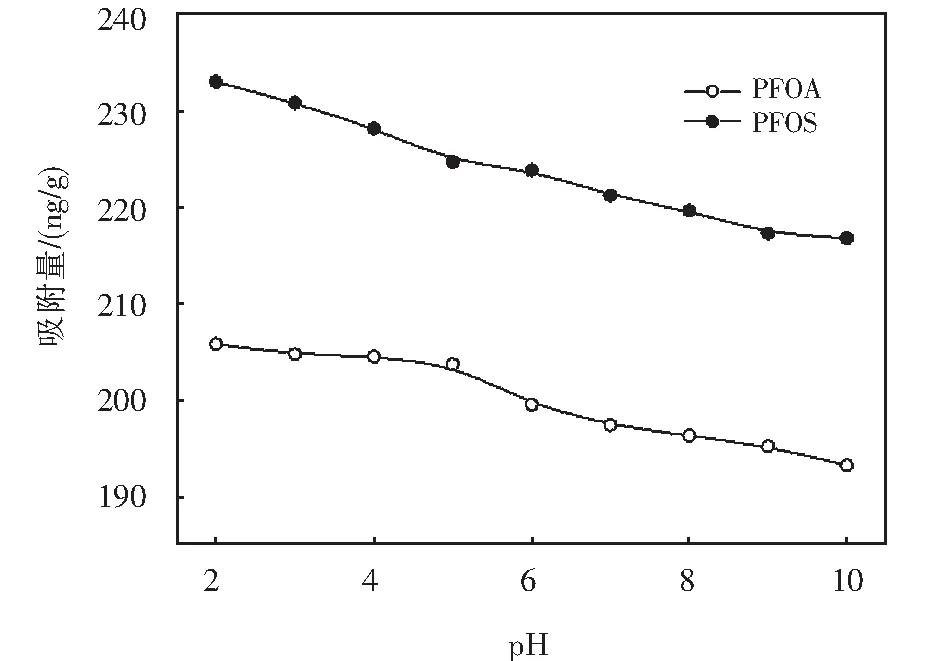
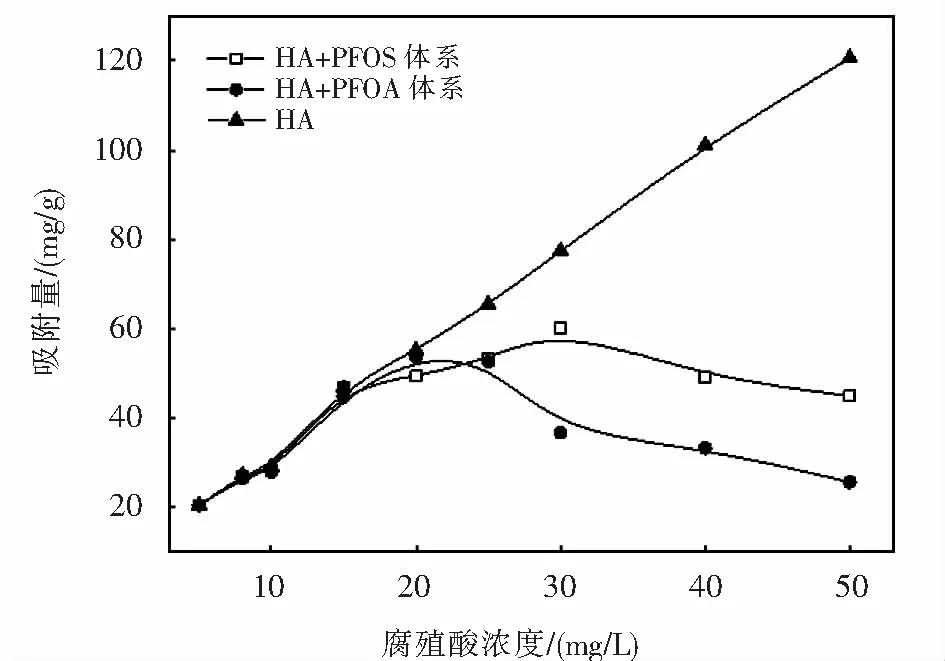
2.4 腐殖酸(HA)的影響
2.5 共存陰陽離子的影響
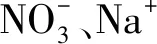
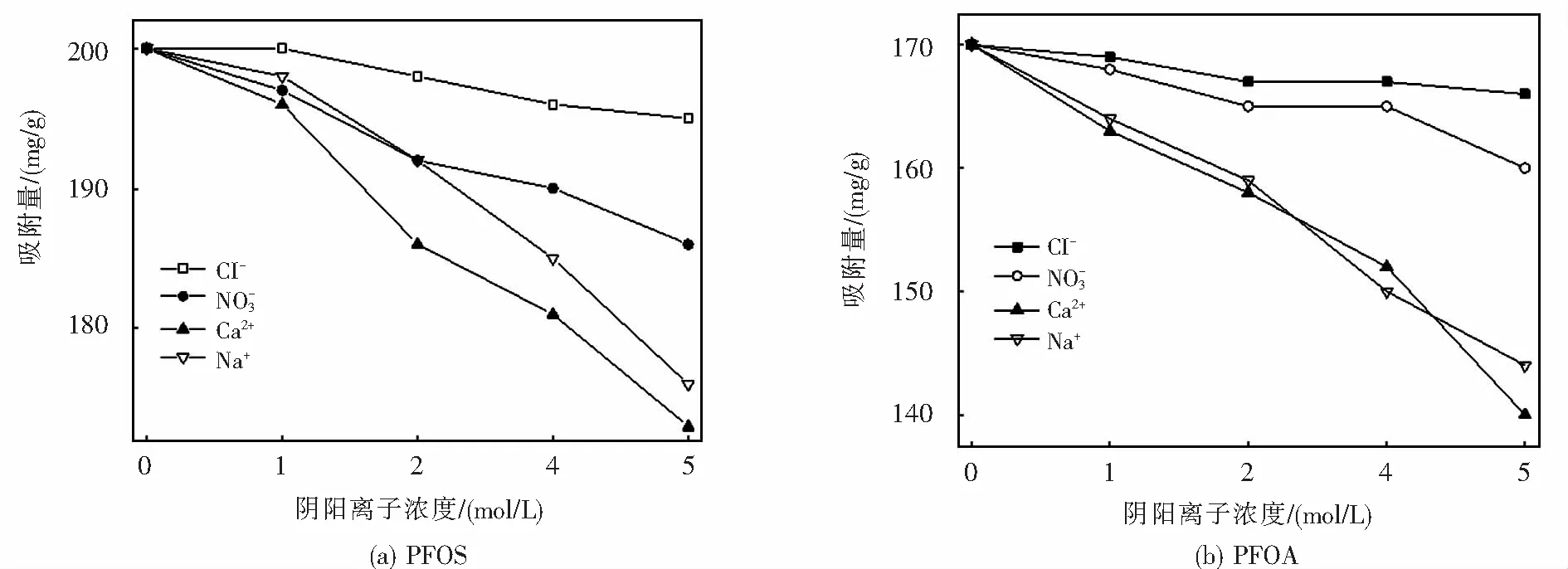
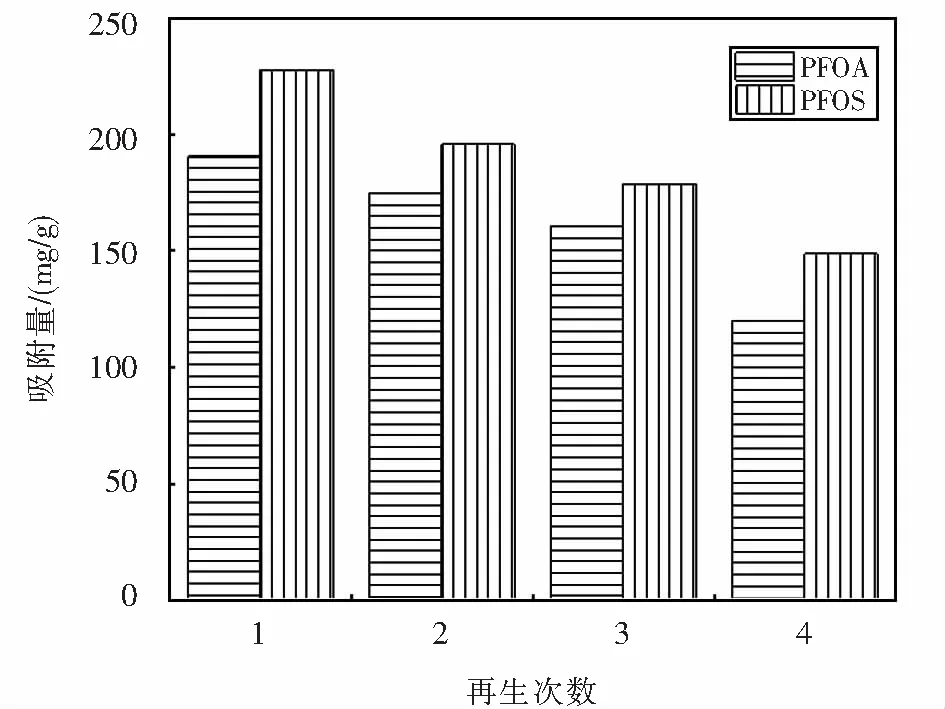
2.6 磁化有機改性膨潤土的回收

3 結論