人乳頭狀瘤病毒分型聯合液基薄層細胞學檢查、陰道鏡Reid評分對宮頸上皮內瘤變分級診斷效能分析
宮頸癌為常見婦科惡性腫瘤,發病率較高,全球每年新增病例達56.5萬例,我國每年確診宮頸癌超過18.15萬例,且近年來發病人群呈現年輕化趨勢[1],嚴重危害女性健康。高危型人乳頭狀瘤病毒(HPV)感染與宮頸癌發生、進展存在明確因果關系,但從感染初期至演變為宮頸癌需8~10年,至浸潤癌則需要再發展2~5年[2],但早期缺乏典型癥狀,因此及早通過篩查診斷并針對不同階段的宮頸上皮內瘤變(CIN)采取相應干預措施,是控制宮頸癌患病率、改善患者預后的必要手段。目前宮頸癌篩查多被規范為“三階梯”診斷程序[3],第一階梯包括HPV分型檢測與液基薄層細胞學檢查(TCT),目前已有較多研究對其進行報道,盡管在基層醫院展現出良好應用前景,也具有較好的診斷學效能[4~6],但往往僅能篩選出高危人群,對于評估病變部位、受累范圍及生物學行為,仍需借助第二階梯的電子陰道鏡檢查及第三階梯的宮頸組織病理學活檢。然而活檢術作為侵入性有創操作,存在一定并發癥隱患且患者接受度并不高,推廣電子陰道鏡檢查具有必要性。本研究分析HPV分型檢測、TCT 與電子陰道鏡Reid評分(RCI)聯合應用于CIN分級診斷效能,現報道如下。
1 材料與方法
1.1 一般資料對2016年7月~2019年6月在我院接受治療的194例CIN患者臨床資料進行回顧性分析。納入標準:電子陰道鏡下宮頸存在可疑病變,或存在白帶異常、接觸性出血、陰道排液等典型癥狀;年齡≥18歲;有性生活史;2 周內完善各項檢查。排除標準:健康宮頸;有CIN 病史;有宮頸外科手術、物理治療、放化療史;其他部位已確診感染高危型HPV;合并妊娠或陰道炎。
1.2 檢測方法
1.2.1 標本采集方法 囑患者接受標本采集前禁性生活、陰道沖洗或用藥2d,確保月經干凈≥3d,取截石位并以鴨嘴型窺器充分顯露宮頸,將多余分泌物拭去,以一次性宮頸細胞刷置入宮頸管內適當深度,令刷毛覆蓋病灶或轉化區,以宮頸外口中央為中心,以適當壓力沿固定方向刷取,根據患者病變情況采集5~10周,分為2份標本封存于專用保存液。
1.2.2 HPV分型檢測方法 將上述宮頸脫落細胞標本之一經細胞裂解液、解鏈酶處理后,采用杭州德同生物技術有限公司提供的HPV 核酸檢測試劑盒(雜交捕獲-化學發光法,DH3),分別將包括14種高危HPV 亞型DNA 單鏈進行全長互補雜交,并依次加入單抗修飾的磁珠、堿性磷酸酶、顯色底物,測定對應底物發光強度。
1.2.3 TCT 方法 將上述另一份宮頸脫落細胞標本送入長沙湘智離心機儀器有限公司提供的湘智XJ-12 液基薄層細胞制片機,通過過濾、富集、純化、轉移等自動化操作,以及乙醇固定、核染色、堿化、胞質染色、樹膠固封等人工操作,制作液基薄層涂片,于高倍鏡下觀察細胞形態與染色情況。
1.2.4 電子陰道鏡檢查方法 于標本采集相同體位下,以生理鹽水棉球拭去陰道壁過多分泌物或滲血,采用深圳金科威實業有限公司提供的DVIS-C陰道鏡數字成像系統,觀察宮頸表面轉化區病變情況,調節濾光器仔細觀察其表面血管形態;棉球蘸取新制5%醋酸后均勻涂抹于宮頸表面,計時1min后觀察宮頸上皮;棉球蘸取盧戈氏復方碘溶液,均勻涂抹于宮頸表面與陰道壁,即時觀察涂抹區域著色情況。
1.3 評估標準HPV分型化學發光檢測中,以相對發光強度RLU/CO=1.00 為檢測閾值,14種高危HPV 亞型DNA 中,出現任一亞型≥1.00,可評估為高危HPV 陽性。TCT 涂片鏡下觀察時,嚴格按照Bethesda 系統診斷標準(TBS)[7]。電子陰道鏡檢查過程中,記錄關鍵性征象并保存典型圖像。
1.4 統計學方法數據均錄入SPSS 20.0 統計學軟件進行分析,計量資料以均數±標準差(±s)表示,計數資料以例數、百分率(%)表示;采用二元Logistic回歸模型,將宮頸組織病理學活檢結果作為因變量(即“金標準”及分組條件,其二分類賦值:0=CINⅠ,1=CINⅡ/Ⅲ),以HPV分型檢測(二分類賦值:0=高危HPV 陰性,1=高危HPV 陽性)、TCT(等級賦值:0=NILM,1=ASC-US,2=LSIL,3=HSIL,4=SCC)、RCI評估(等級賦值:直接以評分賦值)結果為協變量,以Enter 為方法進行回歸分析,擬合出概率函數Logit(P)=4.732×HPV分型檢測+0.670×TCT+0.874×RCI評估-6.246,返回保存預測概率作為聯合診斷結果進行診斷效能分析;將各診斷方法結果繪制受試者工作特征(ROC)曲線,獲取曲線下面積(AUC)、置信區間(95%CI)、靈敏度、特異度、截斷(cut-off)值等參數信息,單純診斷與聯合診斷間AUC 比較采用DeLong 檢驗;以P<0.05 為差異有統計學意義。
2 結果
2.1 宮頸組織病理學活檢結果194例CIN患者中,確診CINⅠ 109例(56.18%),CINⅡ 47例(24.23%),CINⅢ 38例(19.59%)。
2.2 HPV分型檢測結果CINⅠ患者高危型HPV陽性率明顯低于CINⅡ/Ⅲ患者,差異有統計學意義(P<0.05),見表1。
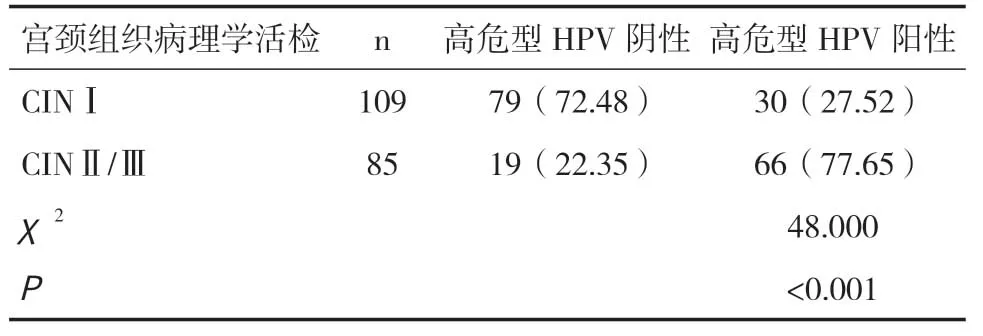
表1 HPV分型檢測診斷結果[n(%)]
2.3 TCT結果CINⅠ患者TCT 惡性程度明顯低于CINⅡ/Ⅲ患者,差異有統計學意義(P<0.05),見表2。

表2 TCT 診斷結果[n(%)]
2.4 RCI評估結果CINⅠ患者RCI 明顯低于CINⅡ/Ⅲ患者,差異有統計學意義(Z=7.011,P<0.05),見表3。
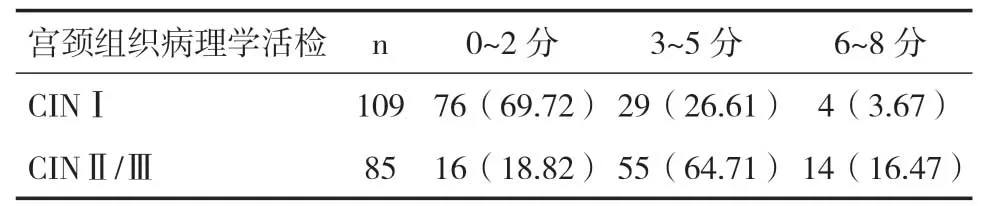
表3 RCI評估結果[n(%)]
2.5 診斷效能分析HPV分型檢測、TCT、RCI評估單獨診斷CIN的ROC曲線AUC 均明顯小于聯合診斷,差異均有統計學意義(P<0.05),聯合診斷CIN的靈敏度與特異度分別為74.12%、97.25%,TCT、RCI評估診斷CIN的截斷值分別為≥ASC-US、≥3分,見圖1、表4。
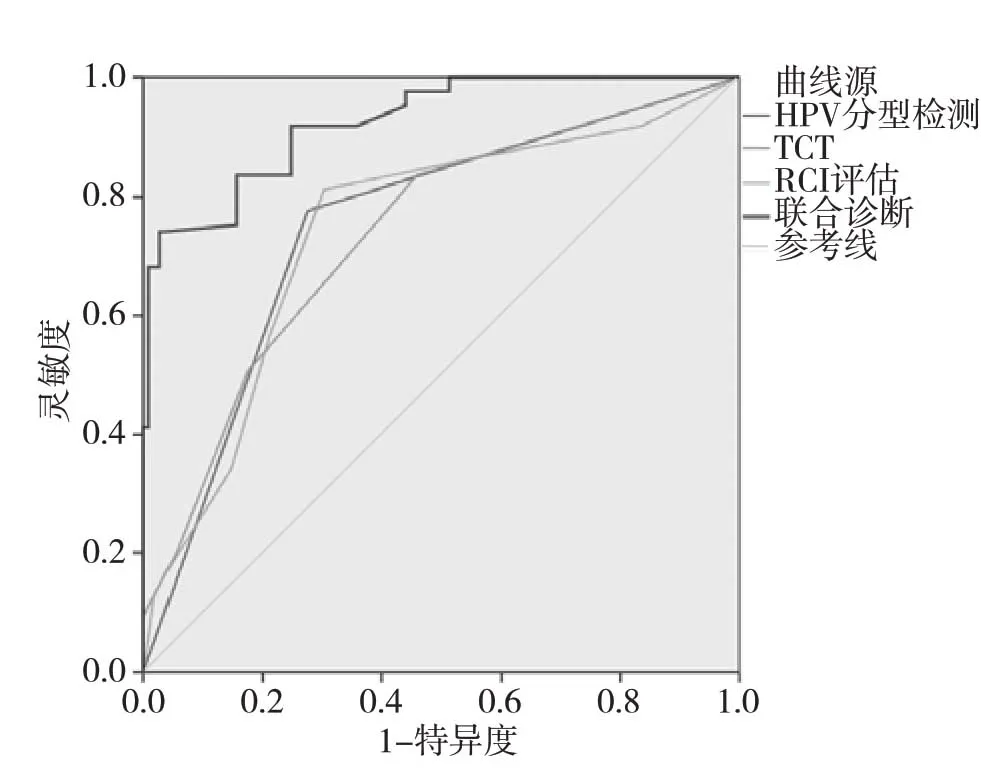
圖1 各診斷方案ROC曲線
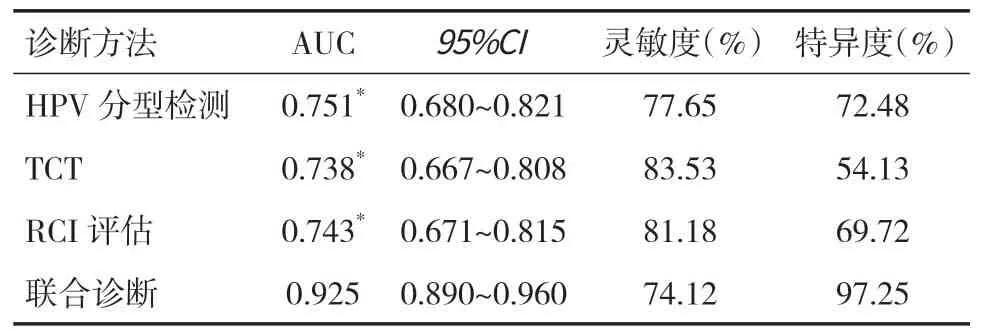
表4 ROC曲線參數
3 討論
目前臨床推薦的治療策略中,CINⅠ多以隨訪觀察、物理治療等保守措施為主,病情具有可逆性,而CINⅡ/Ⅲ病情則不可逆轉,需采取手術治療[8],故需以宮頸組織學活檢下CINⅠ、CINⅡ為分組界限,以分析各檢查方法的診斷價值。
HPV 屬于小型DNA 病毒,涵蓋40 多種亞型,通常在生殖區域及肛門發生感染,臨床將參與宮頸癌發生、進展的亞型歸為高危型[9,10]。宮頸癌是當前發現的唯一具有確切病因的惡性腫瘤,病理學研究顯示,HPV DNA 進入宮頸上皮細胞后可誘導編碼表達E6、E7 等多種致病蛋白,使細胞周期發生紊亂,組織增生失控,并抑制免疫應答,最終觸發癌變[11]。本研究顯示,CINⅠ患者高危型HPV 陽性率明顯高于CINⅡ/Ⅲ患者,其診斷靈敏度為77.65%,特異度為72.48%,表明HPV分型檢測對宮頸癌具有一定的診斷效能,靈敏度較特異度高提示高危型HPV 宮頸上皮感染可能存在一過性與自限性,僅當患者機體免疫系統存在持續性缺陷時,高危型HPV才致病。有學者提出,雜交捕獲-化學發光法相較于全自動DNA 提取-熒光定量PCR 法所需檢測材料更廉價,適用于經濟與醫療水平欠發達的地區開展宮頸癌初篩,但缺乏靶點優選、選擇性擴增及實時檢測等高精度質量控制環節,其檢測精度較低,仍需結合其他檢查協助診斷[12]。
早期臨床觀察宮頸細胞學形態多采用宮頸刮片,然而該采樣方法難以將病變細胞完全轉移至載玻片,且人工制片可能因操作不當而使細胞發生變形,加之血細胞、炎癥細胞與黏稠分泌物還可干擾鏡下觀察,漏診率相對較高[13]。相關研究表明,TCT 采用特制的一次性細胞刷,刷取宮頸細胞已有較成熟的操作標準,且通過自動化制片技術,可提高涂片制作質量,光鏡下也能取得良好視野,相較于宮頸刮片可減少50%以上假陰性率[14]。本研究中,CINⅠ患者TCT 惡性程度顯著低于CINⅡ/Ⅲ患者,其診斷靈敏度為83.53%,特異度為54.13%,說明由TCT 觀察到的宮頸脫落細胞細胞學形態與宮頸組織病理學活檢結果具有一定相關性,但考慮到形態學評估存在主觀性,特異度仍不足。有報道指出,刷取宮頸細胞后向細胞保存液中洗脫操作動作過大,可導致細胞過于分散或破損,在鏡下表現為異常凝聚征象[15],將影響觀察及最終診斷結果,還有待進一步改良。
電子陰道鏡屬于雙目光學窺鏡,由冷光源、光學攝像機、監視屏、支架及其他輔助元件構成,具有高效的立體放大功能,在冷光源照射宮頸及下生殖道時,可將局部表皮放大10~40倍[16],清晰成像于監視屏上,對觀察其上皮結構、血管走行/形態及腺體開口等生理、病理特征具有積極意義。醋酸白試驗與碘試驗是電子陰道鏡診斷宮頸癌的常規步驟,前者主要運用醋酸在不同類型細胞中角蛋白脫色性與不同類型組織的穿透性,在涂抹后特定時間對其延遲脫色情況進行觀察可達到鑒別的目的[17];而后者則借助分化成熟的鱗狀上皮細胞含有的糖原可絡合碘三陰離子被染上深棕褐色,但柱狀上皮、未成熟化生鱗狀上皮糖原含量極少而不能被著色或著色較淺[18],從而將不同細胞區分開來;兩者均可進一步提高電子陰道鏡圖像對比度,更有助于醫師直觀作出評估與診斷。然而電子陰道鏡仍屬于依靠圖像外觀的形態學技術,異常圖像異質性較大,需要通過客觀的評分體系加以改善其特異性。RCI 自20 世紀80年代提出以來沿用至今,仍是目前應用最多的電子陰道鏡觀察參考標準,將其0分、1~2分、3~4分、5~6分、7~8分分別與宮頸組織病理學活檢慢性宮頸炎、CINⅠ、CINⅡ、CINⅢ、宮頸癌相對應,可取得高達96.95%的符合率[19]。本研究顯示,CINⅠ患者RCI 顯著低于CINⅡ/Ⅲ患者,且聯合HPV分型檢測、TCT 可獲得較單獨檢查更高的診斷效能,提示三者聯合診斷能從病毒感染、細胞學形態及上皮病變外觀3個方面對宮頸癌及癌前病變進展情況作出全面判斷,以完善臨床醫師對患者病情的認知,利于指導制定治療與隨訪策略。Cholkeri-Singh 等[20]認為,病灶暴露深度仍是電子陰道鏡檢查未能克服的困難,尤其絕經后婦女雌激素分泌減少,宮頸出現明顯萎縮,轉化區可因此回縮至宮頸管內,建議無雌激素應用禁忌證的絕經后婦女,在檢查前可進行持續1~2 周的雌激素局部給藥干預,以降低漏診率。
綜上所述,HPV分型檢測、TCT 聯合RCI評估對CIN 具有較高的診斷效能,不僅對早期評估病情并采取適宜的干預措施具有指導意義,還可減少不必要的宮頸組織病理學活檢,改善患者診療體驗及預后,具有較高的臨床應用價值。

