多通道柱狀施源器端到端測試
北京協和醫(yī)院 放療科,北京 100730
引言
近距離治療在婦科腫瘤治療中應用廣泛,作用不可替代[1-2]。施源器作為近距離治療過程中的劑量實施載體,其本身的材質、結構參數將影響最終的劑量分布[3],因此施源器投入臨床使用前需進行物理參數確認及端到端測試,確保臨床治療的正確實施,這部分工作也是近距離治療質量保證和質量控制的關鍵內容[4]。Vargo等[5]的研究表明,在陰道癌治療中,與單通道施源器相比多通道施源器在實現同等靶區(qū)覆蓋時能夠顯著降低膀胱、直腸的受量,所以多通道施源器有更廣闊的應用前景。但多通道施源器結構復雜,投入使用前需要明確重建參數及劑量分布,避免發(fā)生系統性錯誤。Gaudreault等[6]研究金屬及塑料材質的施源器對劑量的擾動,結果表明雖然蒙卡模擬過程中,金屬材質管道對劑量的衰減高達4%,但臨床實例中由于管道材質導致劑量的差異在1%左右,原因在于通道數量增多后空腔體積和管道材質間的補償效應。Kim等[7]從圖像引導近距離治療流程質控角度分析了可能引入的誤差來源,其中施源器的特性參數、重建精度以及施源器與導源管的連接總長度等都將影響最終的劑量分布。因此,本研究通過實際測量明確多通道施源器參數以及基于模板重建施源器可能存在的問題,通過ETE測試進一步明確基于模板重建施源器的劑量分布驗證,為后續(xù)治療的精準實施提供保障的同時也為質量保證和質量控制工作提供方法和依據。
1 材料與方法
1.1 多通道柱狀施源器
醫(yī)科達公司生產的多通道柱狀施源器(Nucletron part#110.750)由中間管道和環(huán)周多通道構成,施源器有直徑25、30和35 mm三款。以直徑25 mm施源器為例,如圖1所示,環(huán)周六根管道均勻分布,距施源器外表面5 mm。因頂端為球面形設計,中間管道可向前多駐留5~8 mm,管道平行于外壁并截止于球面內緣。該施源器廣泛用于宮頸癌、子宮內膜癌術后殘端預防性照射以及陰道病變的治療,聯合宮腔管可完成宮體照射。采用源模擬尺及放射源拍片的方法對中間管道及周圍通道內軟管進行長度和最遠駐留點位置的確認[8]。

圖1 直徑為25 mm的多通道施源器外觀圖
1.2 3D打印測量模體
為確保施源器置入的重復性,提高電離室和膠片相對于施源器的位置精度,本研究采用的柱形模體是通過3D打印技術實現的。該模體由直徑200 mm、長300 mm的柱形主體和膠片夾持體構成,外壁材料為尼龍,厚度為3 mm,設有閥門,內部充滿去離子水。主體及夾持體設有中心間距30 mm、直徑25 mm的電離室插棒和施源器插槽,可同時完成點劑量和膠片劑的測量,是較為理想的端到端(End to End,ETE)測試用均質模體(圖2)。

圖2 圓柱形模體、施源器、膠片和電離室構成的ETE模體
1.3 膠片及電離室的刻度
采用井型電離室HDR-1000(standard imaging,美國)完成放射源活度的校準。劑量的確定需借助具有均整結構的鐘形施源器(Valentia,醫(yī)科達公司),其處方深度位于施源器表面下3 mm,該處劑量值為放射源活度與空氣比釋動率和駐留時間的乘積,施源器的衰減因子為0.1659。CC13電離室(IBA,德國)和EBT3免洗膠片(GafChromic,美國)置于Valentia施源器下方處方劑量點處進行刻度,電離室有效測量點位于幾何中心。電離室的刻度在點劑量測量開始前進行,僅獲得電荷-劑量的對應關系,不考慮環(huán)境條件的影響。膠片進行剪裁后按照劑量范圍從0~1000 cGy,間隔100 cGy分別進行照射,曝光24 h后進行讀取,建立劑量-光密度曲線,具體可參考作者前期工作[9]。
1.4 CT掃描和輪廓勾畫
掃描時將特定位置夾持廢舊膠片并做好標記點,用于在CT圖像中識別膠片并確認與模體的相對位置。重建層厚為1 mm。治療計劃系統(Treatment Planning System,TPS)內勾畫靠近電離室的靶區(qū)1和膠片所在位置的靶區(qū)2,并勾畫膀胱、直腸作為危及器官用于劑量優(yōu)化,見圖3。

圖3 CT圖像掃描及輪廓勾畫
1.5 施源器重建及計劃設計
采用商用TPS(Oncentra V4.1,醫(yī)科達公司)中施源器庫進行施源器添加并完成重建。采用模擬退火算法分別針對靶區(qū)1和2進行優(yōu)化,兩個靶區(qū)各設計3例計劃,單次劑量分別為5、6和7 Gy[10],放射源的步進長度為2.5 mm,劑量計算網格為1 mm3。優(yōu)化完成后記錄每個計劃內電離室氣腔體積劑量平均值并導出針對靶區(qū)2計劃的RT dose文件。
1.6 點、面劑量的獲取和分析
按照CT掃描時刻的模體構成夾入膠片并插入電離室,膠片批次與刻度膠片相同,標記參考點后完成通道連接及計劃執(zhí)行。采用Max4000靜電計(Standard Imaging,美國)連接CC13電離室進行測量,按照刻度時刻電荷劑量的對應關系將執(zhí)行計劃過程中靜電計收集的總電荷量轉換成劑量,與對應TPS結果進行比較;膠片通過維達掃描儀[DosimetryPRO Advantage (Red)TM,美國]于曝光24 h后進行掃描,使用OmniPro I’mRT 1.7軟件(IBA,美國)完成膠片劑量的轉換與TPS輸出的dose Cube中對應層面間的γ分析,以2 mm/2%、10%的劑量閾值、全局歸一下,γ值小于1的點的占比大于95%作為符合度通過的評價標準。
2 結果
2.1 施源器參數的確認
各參數實測值與施源器說明書中的標稱值具有良好的一致性,通過施源器模板庫調取該施源器時,相應參數與前兩者略有差異(表1)。采用該模板進行施源器重建,將三維顯示的重建起始點到管道外邊界的距離及出源長度按照實測值進行修改,管道的重建方向采用“tip end”,“offset”設為0。

表1 多通道施源器參數表(mm)
2.2 點劑量測量結果
針對靶區(qū)1和靶區(qū)2,給予不同處方劑量照射,電離室測量結果如表2所示。因電離室靠近靶區(qū)1,所以測量劑量值較高,結果偏差較小,但隨著處方劑量的增加,偏差有增加的趨勢;相反,靶區(qū)2計劃與電離室測量點位置較遠,測量劑量值較小,結果偏差較大,但測量結果相對穩(wěn)定。所有點劑量測量偏差為0.97±0.32%。

表2 電離室測量結果
2.3 面劑量測量結果
對PTV2進行照射的3例計劃進行了水平面及矢狀面的膠片測量,矢狀面測量結果與計劃系統面劑量分布符合良好,γ通過率分別為97.4%、98.2%和98.8%。水平面由于膠片中間開孔處無劑量以及剪裁邊緣破損,影響通過率。若將此區(qū)域濾過,則通過率分別為99.3%、98.4%和98.7%。其中5 Gy處方計劃的膠片分析結果如圖4所示。

圖4 膠片與TPS的面劑量分布γ分析結果
由于施源器需穿過膠片,所以剪裁后膠片中間長度25 mm區(qū)域無劑量。矢狀位因測量位置接近模體邊緣,測量區(qū)域相對較小如圖5所示。
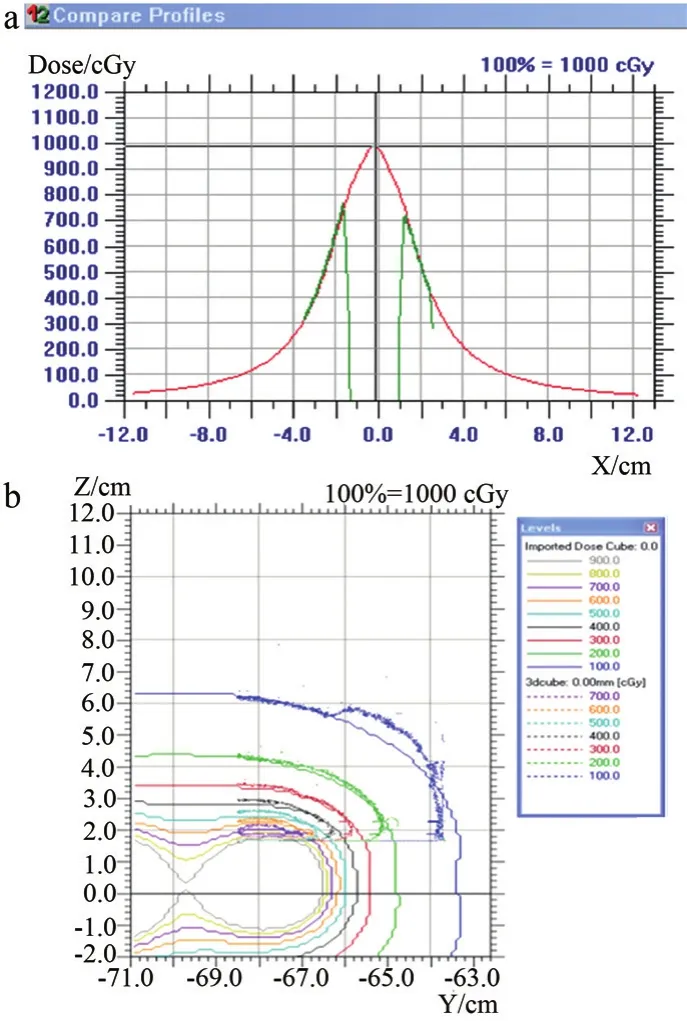
圖5 面劑量分布比較
3 討論
目前,多數近距離治療TPS采用AAPM TG43號報告[11]所述的放射源劑量學參數模擬在水中進行劑量分布計算,并未考慮物質密度對劑量分布的影響。因此,本研究所設計的柱形模體為中空設計,需灌水使用,3D打印技術生成3 mm厚的外壁,材料采用高強度的尼龍近似水等效,避免因為模體本身密度問題導致測量結果與TPS計算之間偏差較大,但由于加工限制,電離室插棒及膠片夾持裝置位置和大小有待完善。
施源器作為劑量實施載體,其本身的結構、物理參數、劑量特性及連接方式等在投入使用前需要確認。其中重建起始點到第一駐留點的距離為offset長度,若設置錯誤會帶來系統性劑量誤差[12]。施源器的重建方式有手動描跡和基于模板庫的重建以及最新開展的基于人工智能的自動重建[13]。對于宮頸癌常用的Fletcher三管道施源器,因幾何關系不固定且管道數量較少,首選手動描跡并指定相應的offset值。而環(huán)形施源器由于結構原因手動描跡重建可能導致誤差較大。Hellebust等[14]針對施源器重建精度對劑量分布影響的研究表明,近源處每毫米的重建誤差將導致劑量變化8%~12%。對于多通道柱狀施源器,通道數量通常為7~10根,手動描跡比較耗時,而且周圍管道前端在CT/MR圖像上難以分辯,所以采用模板庫重建優(yōu)勢明顯。而此時重建起始點及offset值取決于模板及施源器的符合度,所以應用模板重建施源器的實際劑量分布有待于進一步驗證。
192Ir放射源最高能量為602 KeV,平均能量為370 KeV,近源處劑量極高。隨著距離的增加,劑量的跌落與距離的平方近似成反比。因此,采用電離室進行劑量測量時能量響應和體積平均效應問題尤為凸顯。通常指形電離室用于192Ir放射源輻射場的測量,刻度因子由250 KeV和60Co內插獲得。Bondel等[15]的研究表明,內插處理可將刻度因子的不確定度降低至1%以內。本研究采用CC13小體積電離室降低了體積平均效應的影響,而且通過井型電離室確定源活度后利用Valentia施源器得到平坦野輸出,完成電離室及膠片的刻度,達到了同源刻度與測量,提高了刻度的準確性。經過均整后的射束線質略有硬化,對CC13電離室及膠片的影響較小。對于靶區(qū)1的三個計劃,電離室所處位置劑量高、劑量梯度較大,測量結果雖然偏差相對較小但差異較大。而靶區(qū)2遠離電離室,對電離室的劑量貢獻相對較低,而且梯度不明顯,所以測量偏差稍大,趨勢較為一致。
EBT3免洗膠片具有能響寬泛、劑量測量范圍廣及分辨率高等優(yōu)點,已廣泛應用于放射治療設備質控和面劑量測量工作中。Oare等[16]通過3D打印自制模體并通過膠片驗證3D打印材料相對于水的劑量沉積特性,他們的結果表明在192Ir輻射場下進行EBT3膠片的刻度,經修正后測量與計算間的平均劑量偏差在1%以內,且掃描儀不同顏色光源之間無顯著差異。本研究所采用的維達掃描儀光源為單一紅光,故未做修正。大多數劑量分布測量研究采用施源器與膠片平行放置測量冠狀面劑量分布[17-18],本研究通過膠片開孔測量與施源器長軸方向垂直的層面劑量分布,但由于剪裁等原因導致靠近施源器邊緣的膠片測量單元破壞嚴重,該處劑量無法準確測量。對于近距離劑量分布分析中γ通過率標準目前尚無統一定論,AAPM TG-218報告[19]推薦了調強放射治療通過率限值,以3%/2 mm為標準、10%的劑量閾值時通過率不低于90%,對于立體定向放射外科和立體定向體放射治療的計劃要求更加嚴格。本研究采用2%/2 mm為標準,通過率要求大于95%,較為折中。
ETE測量是整個技術應用過程中量化系統誤差的有效手段。對于新施源器投入臨床使用前,需要對很多參數及綜合劑量誤差進行驗證,包括源活度、放射源到位精度、計時器精度、管道連接長度、TPS算法、參數設置以及施源器重建精度等。Bassi等[20]通過3D打印模體完成多中心近距離治療的ETE驗證,電離室和熱釋光劑量儀的誤差分別為0.5%和2.5%,EBT3膠片平均通過率大于95%,與本研究結果一致。對于多通道施源器,ETE測試主要驗證模板重建施源器的可靠性,本研究結果也充分說明了這一點,結論有一定的推廣價值。
綜上所述,本文報道了通過自制模體進行多通道施源器投入臨床使用前的端到端測試方法,實測結果與計劃內劑量一致,充分說明了通過模板重建施源器過程中所配置的施源器各項參數準確,劑量實施精準,為該施源器投入臨床使用提供了數據支持,希望本研究的方法及結果能夠對同行們的工作有所幫助。

