化學中和法處理含錳酸性礦山廢水的工藝優化*
楊 程,王廣成,王紹平,賈亞文,潘 鑫,王麗行,邵 銳, 3
(1 合肥工業大學資源與環境工程學院,安徽 合肥 230009;2 安徽馬鋼礦業資源集團南山礦業有限公司,安徽 馬鞍山 243000;3 中鋼集團馬鞍山礦山研究總院股份有限公司,安徽 馬鞍山 243000)

但關于錳離子的去除機制研究還不夠充分,同時,錳作為水質污染物的主要重金屬監測指標之一,不僅去除更加困難,而且過量的錳會毒害人體和動物,損害人體和動物的腦部和神經中樞系統[5]。本論文通過中和法實驗和理論相結合,探究酸性含錳廢水中錳離子去除機制,為有效處理酸性礦山廢水提供理論支持。
1 實 驗
1.1 試劑和儀器
1.1.1 試 劑
為探究酸性礦山廢水(AMD)中錳離子去除機制,并分析鎂離子、鋁離子、亞鐵離子等共存離子的影響。本實驗配制600 mg/L硫酸錳溶液模擬酸性含錳廢水AMWW(Acid Manganese Waste Water),配制1 mol/L氫氧化鈉溶液中和處理AWMM,實驗所用試劑:硫酸錳(分析純,MnSO4·H2O含量不少于99.0%);氫氧化鈉(NaOH含量不少于96%);硫酸鎂(分析純,MgSO4·7H2OH含量不少于99%);硫酸鋁(分析純,Al2(SO4)3·18H2O含量不少于99.0%);硫酸亞鐵(分析純,FeSO4·7H2O含量不少于99.0%)。
1.1.2 儀 器
溶解氧儀,pH計,電動攪拌機,曝氣泵,蠕動泵,火焰原子吸收光譜儀等。
1.2 實驗方法
1.2.1 處理流程
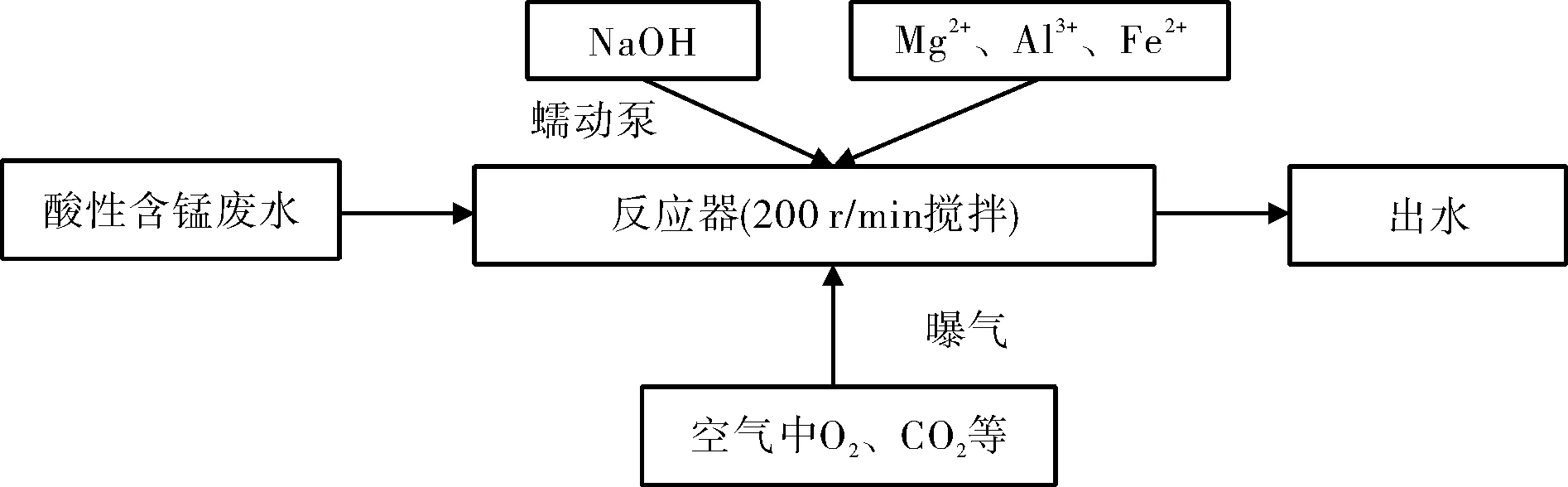
圖1 處理流程圖
取酸性含錳廢水(3 L)在室溫條件下于曝氣攪拌器中曝氣攪拌,曝氣量為23.3 L/min(每升溶液每分鐘曝氣量為23.3 L),空氣中的O2和CO2與溶液充分接觸反應,其中氧氣可以為中和處理過程提供充沛的溶解氧濃度,有利于反應速率的提高,二氧化碳與錳離子生成碳酸錳沉淀,也提高了錳離子去除效率。
利用蠕動泵勻速添加氫氧化鈉堿液調節pH至9.5,記錄各階段堿液消耗量并測定錳離子變化情況。同時,在酸性含錳廢水中添加1000 mg/L的不同共存離子,以探究對錳去除的影響。
本實驗同時設置攪拌組(無曝氣)作為對照實驗,分析不同處理工藝的差異。
1.2.2 加堿速率實驗
為獲得處理效率最高,經濟快速的加堿速率,本實驗設計2.22 g NaOH/h、4.44 g NaOH/h、8.88 g NaOH/h三組不同加堿速率實驗。
1.2.3 共存離子影響實驗
在酸性含錳廢水中添加1000 mg/L的Mg2+、Al3+和Fe2+,綜合加堿速率實驗的結果,選定合適加堿速率,在室溫條件下勻速添加氫氧化鈉溶液,調節pH至9.5,記錄各階段堿液消耗量,測定錳等離子的變化情況。
實驗設計如表1所示。

表1 實驗設計
2 結果與討論
2.1 曝氣攪拌和機械攪拌的對比
圖2是不同攪拌條件下pH和溶解氧隨時間變化的曲線,圖2(a)表示曝氣攪拌條件,圖2(b)表示機械攪拌條件。比較圖2(a)、(b)可以得出,曝氣攪拌下,溶解氧維持在8.5 mg/L左右,提供相對穩定的氧化條件。而機械攪拌條件下,由于沒有充沛的空氣補給,隨著反應的進行,溶解氧呈下降趨勢,直至完全消耗。由圖2(a)可以看出,當pH上升至8后出現增長“平臺期”,即一段時間內pH上升趨勢緩慢[6]。“平臺期”的出現是由于這段時間內,AMWW中的Mn2+形成氫氧化物沉淀和氧化沉淀消耗大量的OH-。同理,機械攪拌條件下也出現平臺期(如圖2b所示)。但值得注意的是,由于機械攪拌實驗缺少空氣注入,溶解氧消耗明顯,隨著pH增加至8.7后,降低為0 mg/L,無法形成氧化沉淀。所以,機械攪拌對錳的去除效率低于曝氣攪拌,且當pH大于8.5時,去除效率的差異更為顯著,如圖3所示。

圖2 不同攪拌條件下pH和溶解氧隨時間變化

圖3 不同攪拌條件下錳離子濃度隨pH的變化
2.2 不同加堿速率的對比
圖4是曝氣攪拌條件下不同加堿流速下pH和溶解氧隨時間變化的曲線。圖4(a)表示加堿速率為2.22 g/h,圖4(b)表示加堿速率為4.44 g/h,圖4(c)表示加堿速率為8.88 g/h。比較圖4(a)~圖4(c)可以得出,每組實驗溶解氧都維持在8.7 mg/L左右,可見加堿速率對水樣中溶解氧含量影響較小。另外,隨著加堿速率的提高,水樣pH調節至9所需的時間越短,且每組實驗均出現了“平臺期”。在平臺期內,加堿速率越低,pH變化幅度越小,說明此時的加堿速率更接近反應真實的耗堿速率。
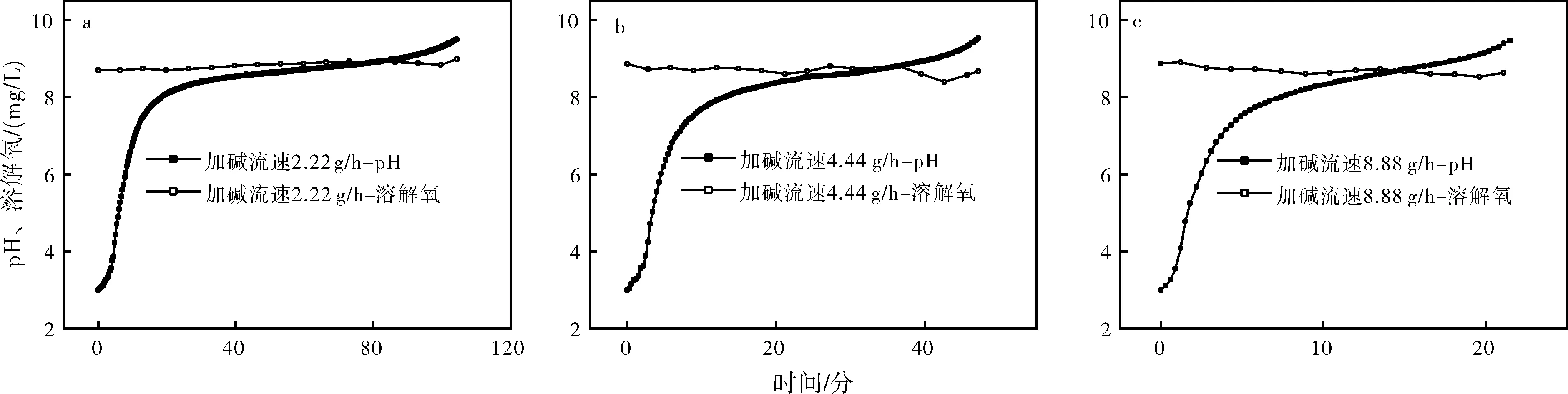
圖4 不同加堿流速下pH和溶解氧隨時間的變化

圖5 不同加堿流速下累積耗堿量隨pH的變化
圖5表示不同加堿流速下累積耗堿量隨pH的變化關系。圖5a表示累積耗堿量的變化,圖5b表示不同pH區間的加堿量。由圖5a可以看出,曝氣攪拌實驗和機械攪拌實驗均在pH在8.5~9區間的累積耗堿量最多,說明Mn2+的去除主要發生在此pH區間。同時,當pH位于9~9.5間時,加堿流速為8.88 g/h的總累積耗堿量最低,如圖5b所示。

圖6 不同加堿流速下錳離子濃度隨pH的變化
由圖6可以得出,在pH=7之前,每組實驗均對錳離子的去除效果不顯著,且各組的去除效果接近,此階段的錳的去除可能是由于Mn2+產生少量的氧化沉淀和碳酸鹽沉淀。pH上升至8之后,各組實驗對錳離子的去除效果較為顯著,根據溶度積公式,Mn2+開始沉淀的pH在7.8~8.8范圍內,且pH越高,Mn2+越容易形成氫氧化物沉淀和氧化沉淀[7],當pH在8.5~9區間內去除速率最高。且不同加堿速率實驗的剩余錳離子濃度差距并不明顯。
綜上分析,8.88 g/L加堿流速下,達到Mn2+去除最佳pH區間所需時間最短,且累積加堿量最少,從經濟成本考慮,后續實驗選取加堿流速為8.88 g/h。
2.3 共存離子影響的對比
圖7是各共存離子存在條件下錳離子濃度變化曲線。圖7a表示曝氣攪拌實驗,圖7b表示機械攪拌實驗。對比圖7a、b可以得出,兩種攪拌條件下,當pH小于6時,錳離子濃度變化較為緩慢,當pH大于6時,AMWW-Al3+體系對錳離子的去除速率明顯提高,當pH大于8時,AMWW-Mg2+和AMWW-Fe2+體系錳離子濃度開始迅速下降。其中鋁離子對錳的去除率最佳,且主要發生在pH為6-8.5階段,這是由于此階段鋁離子已經以Al(OH)3的形式完全沉淀,而Al(OH)3具有較大的表面積以及高孔隙度,對廢水中錳離子有吸附結晶等作用[8]。

圖7 不同共存離子存在下錳離子濃度隨pH的變化
由圖7a可以看出,曝氣攪拌條件下AMWW-Mg2+和AMWW-Fe2+體系在pH=9之前與純錳體系去除效率無明顯差距,但在pH=9.5時,處理效果更好,可能是由于此pH下有較多的Mg(OH)2產生,當溶液中Mg(OH)2濃度較高時,具有一定的絮凝作用,能與Mn(OH)2產生共沉淀現象,促進錳的去除。而Fe2+在充分曝氣攪拌的條件下幾乎完全轉化為Fe3+并產生Fe(OH)3沉淀,對錳離子有吸附去除效果[9]。
對比圖7b可得,機械攪拌實驗中,當達到pH=9.5的出水條件時,AMWW-Al3+體系對錳離子去除效果與曝氣攪拌實驗無顯著差異,而AMWW-Mg2+和AMWW-Fe2+體系對錳離子的去除率明顯低于曝氣攪拌實驗,說明水樣中無論是否存在共存離子,曝氣條件下對錳離子的去除效果都要好于機械攪拌條件。
另外,當pH低于6時,AMWW-Al3+和AMWW-Fe2+體系對錳離子去除效果與曝氣實驗相似,但純錳體系和AMWW-Mg2+體系對錳離子去除效果較差,因為此時尚未達到Mg2+產生沉淀的pH閾值,錳離子的主要去除過程為氧化過程和與空氣中CO2產生的碳酸鹽沉淀,而機械攪拌實驗水中溶解氧和CO2濃度較低,故去除效果比曝氣攪拌實驗差。
此外,AMWW-Fe2+體系在曝氣攪拌和機械攪拌實驗中的表現有所差別,機械攪拌實驗中,當pH=8.5時,AMWW-Fe2+體系中錳離子濃度低于其他共存離子體系,此時由于充氧量不足,導致Fe3+與亞Fe2+大量共存,而pH達到8.5時亞鐵離子幾乎完全沉淀,生成磁性的Fe3O4等鐵氧體以及Fe(OH)2[10],可以吸附大量錳離子從而使水體中錳離子濃度快速下降。而曝氣攪拌實驗中,Fe2+幾乎完全轉化為Fe3+,無法產生Fe(OH)2沉淀,故三種共存離子體系在pH達到8.5時并無明顯差別。
3 結 論
本實驗中,我們通過比較不同處理工藝和不同加堿速率條件下,對酸性含錳廢水中錳離子去除效果,并考慮共存離子的去除效果的影響。結論如下所述:
無論是否考慮共存離子的影響,曝氣攪拌條件下,由于更高溶解氧和CO2濃度,有利于產生碳酸鹽沉淀和氧化沉淀,故錳離子去除效果更為顯著。
不同加堿速率下,調節至出水pH條件所需的時間不同,通過對比試驗可得,8.88 g/h加堿速率下,達到錳離子去除最佳pH條件所需時間最短,且在三種速率設置中累積耗堿量最少,綜合考慮,8.88 g/h為最佳加堿速率。
共存離子的存在對酸性含錳廢水中錳離子的去除有促進效果,主要去除機制為吸附共沉淀和絮凝作用。其中AMWW-Al3+體系去除效果最佳,AMWW-Fe2+體系在曝氣攪拌和機械攪拌條件下表現有所差異。
綜上,本文分析了不同處理工藝和加堿速率與去除率之間的關系,得到了最佳處理工藝和最為經濟高效的加堿速率,探究了共存離子對酸性含錳廢水中錳離子去除的機制,為AMD中錳離子的去除提供了理論和技術支持。

