基于GEO數據庫的IgA腎病基因的篩選和生物信息學分析
劉音 趙彬 謝裕賽 楊濤
1北京市海淀醫院腎內科 100080;2中國醫科大學基礎醫學院病理教研室,沈陽 110122
IgA腎病(immunoglobulin A nephropathy,IgAN)是全亞洲乃至全世界最常見的腎小球疾病[1]。在我國,IgAN占原發性腎小球腎炎病例的58.2%[2]。有15%~40%的IgAN患者在確診后20年內逐漸發展為終末期腎病(end-stage renal disease,ESRD)。因此,IgAN已成為目前重要的醫療健康問題。IgAN的病理過程包括IgA免疫復合物的沉積,腎小球系膜細胞增殖,細胞外基質成分的積累以及腎組織炎性細胞的浸潤[3]。盡管已經對IgAN的病理過程進行了數十年的研究,但其參與的分子機制仍不清楚,并且尚無有效的IgAN早期診斷和治療方法。
生物信息學分析是一種強大的研究方法,可用于預測分子機制和基因之間的關聯。該方法已廣泛被用于預測與腫瘤相關的新基因和新途徑,例如肝癌[4]、非小細胞肺癌[5]等。生物信息學分析可以加深我們對腎臟疾病分子機制的認識[6],最近有研究通過生物信息學分析了巨噬細胞的基因表達譜,發現狼瘡性腎炎患者巨噬細胞中CCL2和CD38的參與誘導[7]。迄今為止,在IgAN上僅進行有限的生物信息學分析。在本研究中,我們對基因表達綜合數據庫(Gene Expression Omnibus,GEO)公共數據庫中3組IgAN患者及正常對照者腎小球組織的芯片檢測結果進行一系列生物信息學分析,篩選出IgAN患者和正常對照者之間差異表達基因(differentially expressed gene,DEGs),并對共有的DEG進行了富集分析并構建了蛋白質-蛋白質相互作用(protein-protein interactions,PPI)網絡。本研究發現IgAN潛在的分子標志物,希望為IgAN的診斷和治療提出新的線索。
資料和方法
一、數據來源
使用“IgAN”作為搜索詞,從GEO數據庫(http://www.ncbi.nlm.nih.gov/geo/)下載了IgA腎病的3個腎小球數據集GSE104948[8]、GSE93798[9]和GSE37460[10]。GSE104948基于GPL24120平臺芯片,包括30個樣品(27個IgA腎病患者和3個健康對照的腎小球組織基因表達信息)。GSE93798基于GPL22945平臺芯片,包括42個樣本(20個IgA腎病患者和22個健康對照的腎小球組織基因表達信息)。GSE37460基于GPL14663芯片,包括36個樣品(27個IgA腎病患者和9個健康對照的腎小球組織基因表達信息)。下載完整系列矩陣文件及其平臺探針注釋信息文件,進行下一步的生物信息學分析。
二、共同DEGs的篩選
采用R語言中limma R包校正數據并分析出IgA腎病患者和健康對照者之間的DEGs[11]。DEGs的篩選條件為|logFC|> 1和校正后P值<0.05。使用在線Venn軟件(http://www.molbiotools.com/)篩選出共同DEGs。
三、DEGs的富集分析
使用DAVID(http://david.abcc.ncifcrf.gov/)數據庫進行共同DEGs的功能和途徑富集分析[12]。分別在上調和下調的共同DEGs中在DAVID數據庫進行基因本體論(gene ontology,GO)京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析。P<0.1和基因計數>2作為篩選GO分析和KEGG通路分析方面具有顯著富集的閾值。
四、PPI網絡構建與分析
使用STRING(http://string-db.org/)數據庫構建DEG的PPI網絡[13],綜合得分>0.4作為統計學上節點蛋白間存在顯著相互作用的閾值。運用Cytoscape(http://cytoscape.org/)軟件用于進一步分析交互式網絡及可視化[14],其中CytoHubba是一種從復雜的交互組中篩選樞紐基因的插件[15]。通過Cytoscape 軟件中CytoHubba插件的“Degree”算法發現顯著性節點蛋白,并以Degree≥5為閾值從共同DEGs中篩選樞紐基因(hub genes)。
結 果
一、IgA腎病中DEGs的鑒定
在將3個數據集的原始數據及平臺探針注釋信息文件運用limma R包進行數據校正和差異化分析。分別從GSE104948、GSE93798和GSE37460數據集的IgA腎病和健康對照的腎小球組織表達基因之間差異分析出199、347和181個基因。通過在線Venn圖軟件篩選出16個上調的共同DEGs和14個下調的共同DEGs。(圖1)
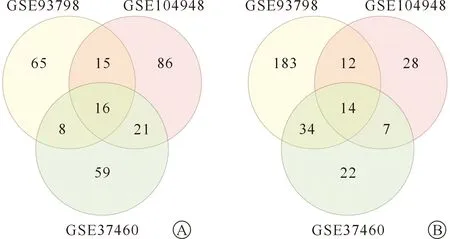
圖1 3個IgA腎病數據集GSE104948、GSE93798和GSE37460中的共同差異表達基因 A.上調組;B.下調組
二、共同DEGs的功能和通路富集分析
將共同DEGs進行GO分析基因注釋,分為3類,包括生物過程(BP),細胞成分(CC)和分子功能(MF)(圖2)。生物過程分析表明,上調DEGs主要與細胞外基質組織、細胞黏附、先天免疫反應和細胞增殖的正向調控有關;下調的DEGs主要參與細胞氧化解毒、氧化還原反應、血小板脫粒和葡萄糖穩態。在細胞成分分析中,DEGs上調主要分布細胞外基質、膠原蛋白三聚體和細胞外區域;下調的DEG主要分布外泌體及內質網。此外分子功能分析提示,DEGs的上調主要參與蛋白結合,膠原蛋白的結合和整合素的結合;下調的DEG主要參與脂肪酸結合、磷脂結合和抗氧化活性。
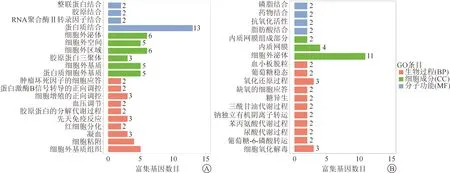
圖2 共同差異表達基因的GO分析 A.上調組;B.下調組
接下來,我們對共同DEGs進行KEGG通路富集分析(圖3)。上調的DEGs在5條通路中顯著富集:如LPAR6、COL6A3、COL1A2、FN1參與PI3K-Akt信號傳導通路;COL6A3、COL1A2、FN1參與ECM-受體互作通路及黏著斑形成;LPAR6、MECOM、FN1參與癌癥形成等。下調DEGs在6條通路中顯著富集:如G6PC、CYP27B1、PAH、HPD、PCK1基因參與代謝通路;FABP1、SLC27A2、PCK1基因參與PPAR信號傳導通路;G6PC、SLC27A2、PCK1參與胰島素抵抗通路等。
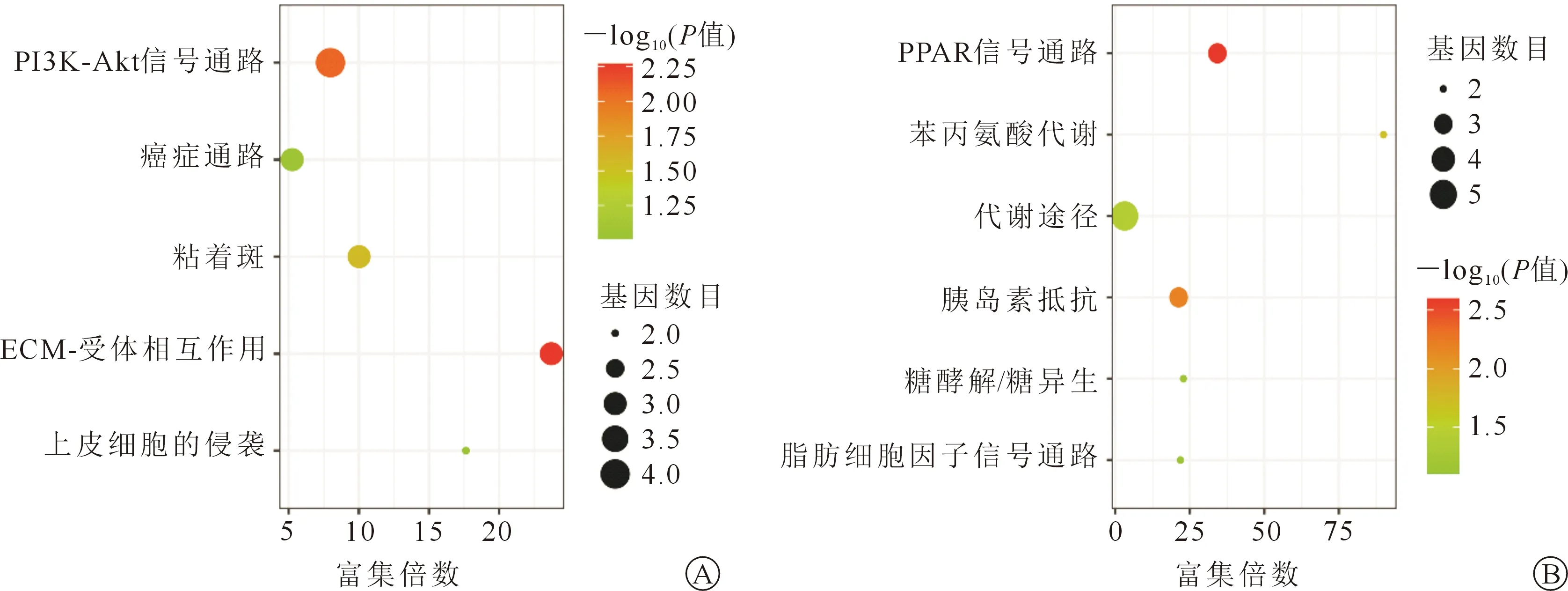
圖3 共同差異表達基因的KEGG通路富集分析 A.上調組;B.下調組
三、共同DEGs的PPI網絡
構建共同DEGs的PPI網絡包含23個蛋白節點和37條蛋白互作關系(圖4)。此外,通過Cytoscape 中CytoHubba插件的Degree算法,以Degree≥5為篩選標準將共同DEGs中FN1、COL1A2、ALB和FABP1確定為樞紐基因。
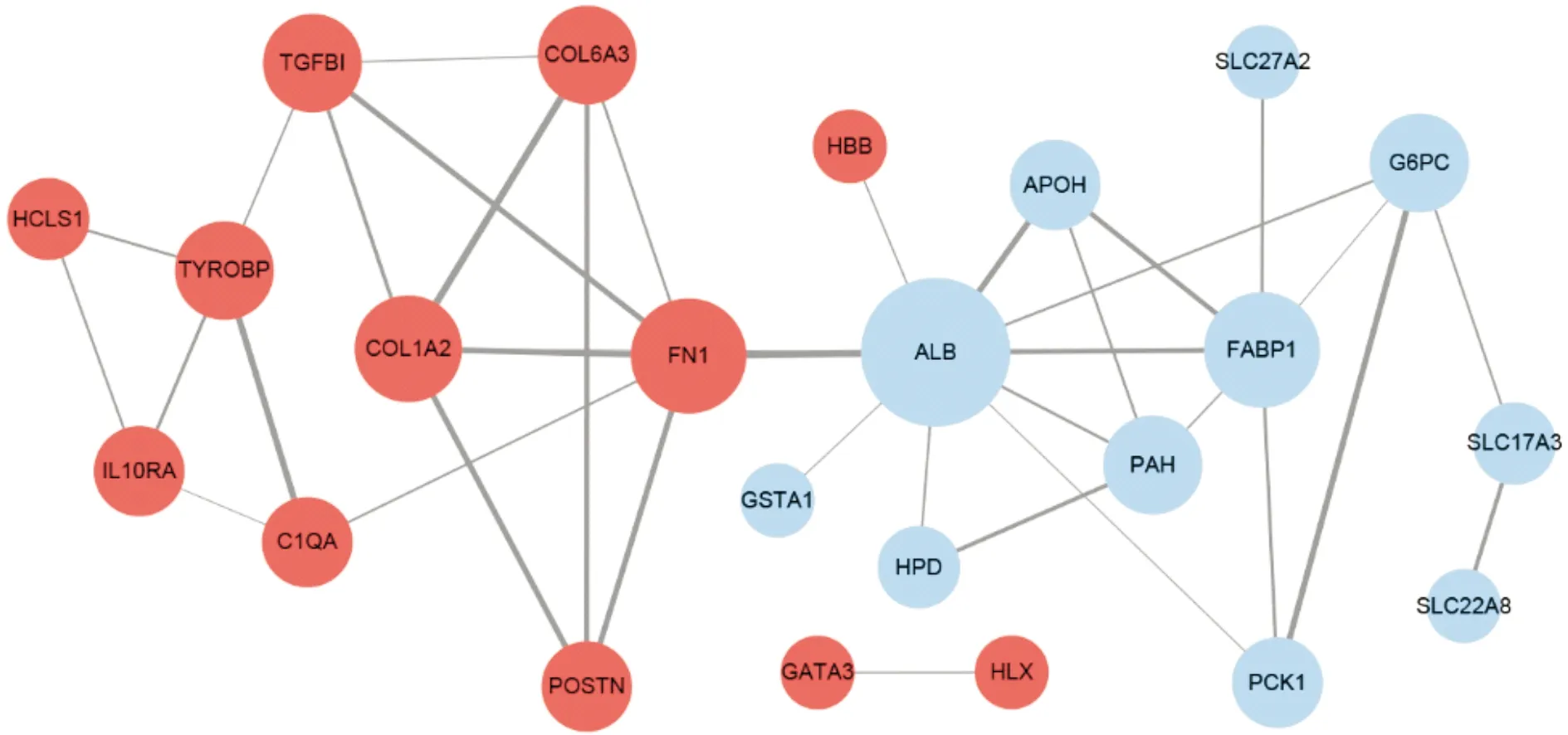
注:紅色代表上調基因,藍色代表下調基因圖4 共同差異表達基因的蛋白互作網絡
討 論
IgAN占原發性腎小球疾病的20%~47%,主要特征是血尿、蛋白尿、高血壓和腎功能不全[3],其發病率每年都在增加,在10年內有30%~40%的患者發展為終末期腎病。盡管IgAN的最常見臨床表現是血尿,但不同病例之間存在相當大的異質性,這使得早期診斷陷入困境。
在本研究中,我們通過分析GEO數據庫的3個IgA腎病數據集,篩選出IgAN中的DEGs,并確定潛在的生物靶標。GO分析和KEGG通路分析顯示,上調DEGs在細胞外基質組織細胞黏附、細胞增殖、PI3K-Akt信號傳導通路和ECM-受體相互作用途徑及黏著斑形成顯著富集。細胞增殖是IgAN發病機制中的重要因素。有研究發現,循環半乳糖缺陷型IgA形成沉積在腎小球系膜的免疫復合物,最終導致IgAN局部增殖[16]。
從PPI網絡中鑒定出4個樞紐基因,該結果與之前的腎臟疾病研究一致,包括FN1[17]、COL1A2[18]、ALB[19]、FABP1[20]。我們的生物信息學分析表明纖連蛋白(FN1)在IgAN腎小球中過表達。纖連蛋白是細胞外基質的必需成分。在病理情況下,纖連蛋白可以充當細胞外基質蛋白在體細胞周圍沉積的誘發因素,導致組織的硬化或纖維化[17]。在腫瘤發生、發展中,FN1通過PI3K/AKT信號通路促進膠質瘤細胞增殖[21]。此外,動物實驗也表明纖連蛋白與腎臟疾病的進展有關[22]。在腎小球腎炎患者的血漿和尿液中纖連蛋白水平升高[23]。之前的研究還表明,IgAN患者含有大量循環復合物,其中含有Ag抗體和纖連蛋白[24],是原發性IgAN的首要免疫復合物機制。因此,FN1基因的表達也可能影響IgAN的進展,通過調節FN1表達可以有效地預防IgA腎病。膠原蛋白Ⅰ型α2鏈(COL1A2),富集在細胞外基質及參與黏著斑通路。有研究發現,膠原結合黏附因子通過結合膠原蛋白Ⅰ型加速IgAN進展[18]。
白蛋白(albumin,Alb)和脂肪酸結合蛋白1(fatty acid binding protein 1,FABP1)在PPI網絡中具有顯著的相關性。Alb和FABP1均顯著下調且富集于氧化還原過程及抗氧化活性。現已證實,氧化應激和炎癥反應在IgA腎病疾病進展中發揮重要作用[24]。ALB編碼的白蛋白主要存在于尿蛋白中。臨床上發現該檢測結果是由于腎小球疾病患者的腎小管上皮細胞在病理上產生大量尿蛋白而引起的[25]。實驗證據表明,尿蛋白(包括白蛋白)參與了腎小管間質纖維化過程[26]。此外,有研究報道在IgAN的早期階段,FABP1能通過抑制氧化應激和炎癥介質的產生而減少腎小球損傷。
盡管生物信息技術是篩選鑒定疾病的候選基因的強大方法,但這項研究仍然存在局限性。從GEO數據庫下載的數據集數量和樣本量較小。此外,由于尚無患者的臨床資料,不能對年齡、性別、腎功能等因素加以控制。盡管有這些局限性,我們的發現仍然對IgAN的分子機制具有重要的意義。因此,接下來需要進一步的臨床研究來驗證我們的研究結果。
綜上所述,本研究應用生物信息學綜合分析方法研究參與IgAN的樞紐基因和發病機制。FN1、COL1A2、ALB和FABP基因可能在IgAN的發展中起重要作用,并可能作為診斷和治療IgAN的潛在候選分子靶標。
利益沖突所有作者均聲明不存在利益沖突

