老年膿毒癥合并免疫抑制患者免疫調理治療策略
何峻 伍松柏 呂愛蓮 戴瑤 黃康 方向 呂建磊 劉敏 張權 彭靜
長沙市第一醫院重癥醫學科(長沙410005)
膿毒癥是嚴重危害人類健康的主要疾病之一,膿毒癥3.0 定義為機體對感染的異常反應引起危及生命的器官功能障礙,而免疫失調被認為是膿毒癥主要的病理生理機制之一[1]。膿毒癥免疫功能紊亂不僅表現為高炎癥反應狀態所導致的多系統多臟器功能損害,更可發展為由失控的免疫激活所導致的嚴重免疫抑制,而嚴重的免疫抑制與院內感染發生率、病死率和長期并發癥增加有關[2-3]。有研究顯示老年膿毒癥患者的病死率高于青年患者,相對危險度是青年患者的13.1 倍,免疫衰老是老年人正常的生理現象,主要表現為細胞免疫及體液免疫功能的下降,而免疫衰老是老年人易受病原菌侵襲、罹患膿毒癥的重要原因,也是影響老年膿毒癥患者預后的關鍵因素[4-5]。因此,免疫調節治療將是重建老年膿毒癥患者免疫平衡、改善免疫抑制狀態及預后的關鍵措施[6]。目前針對合并免疫抑制的老年膿毒癥患者進行免疫調節治療的研究較少,具體的有效治療方案尚不明確。本研究通過比較不同免疫調節治療方案對老年膿毒癥合并免疫抑制患者免疫功能及預后的影響,旨在探索老年膿毒癥免疫抑制患者的優化免疫調理治療策略。
1 資料與方法
1.1 一般資料選擇2018年10月至2020年1月我院重癥醫學科老年膿毒癥患者,所有患者均在入院48 h 內通過熒光抗體標記外周血單核細胞人類白細胞抗原-DR(HLA-DR),流式細胞儀檢測HLA-DR 表達,根據既往研究結果,以外周血單核細胞HLA-DR 表達率<40%為免疫功能低下患者[7]。將老年膿毒癥合并免疫抑制患者隨機分為對照組(A 組)、胸腺法新組(B 組)、胸腺法新聯合血必凈組(C 組)。A 組入選30 例(男14 例,女16 例),年齡(75.57 ± 6.17)歲;B 組入選30 例(男12 例,女18 例),年齡(78.07 ± 6.15)歲;C 組入選31 例(男15 例,女16 例),年齡(77.00±6.57)歲。
入選標準:(1)年齡≥65 歲;(2)符合“2016 拯救膿毒運動:膿毒癥和膿毒性休克的管理國際指南”診斷標準[8];(3)存在免疫功能低下(單核細胞HLA-DR 表達率<40%);(4)本院住院時間>7 d。
排除標準:(1)HIV、血液系統疾病、晚期腫瘤患者、長期使用激素及免疫抑制劑患者;(2)已知對血必凈注射液、注射用胸腺法新及其輔料過敏和使用禁忌的患者;(3)存在需外科干預的感染灶未進行感染灶清除及充分引流;(4)ICU 內住院時間<3 d,本院住院時間<7 d;(5)患者存在研究者認為不適合參加研究的因素。
本研究符合醫學倫理學要求,經醫院倫理委員會批準,對于所有治療及處理患者或家屬知情同意并簽署知情同意書。
1.2 方法
1.2.1 收集資料所有入選患者記錄性別、年齡等一般資料,入組時進行序貫臟器衰竭估計評分(SOFA 評分)及急性生理與慢性健康評分(APACHEⅡ評分),記錄相關臨床生化指標、輔助檢查結果等。
1.2.2 一般治療所有患者一般治療均按照“2016拯救膿毒運動:膿毒癥和膿毒性休克的管理國際指南”進行規范的早期目標導向性治療及相應的系統性治療,其中抗感染方案由具有豐富臨床經驗的一名重癥醫學專業高級職稱醫師及具有高級職稱的臨床藥師共同制定,其他臟器功能支持、營養支持、穩定內環境及所存在的合并癥等均依據相關指南共識進行治療。所有的治療過程由一名重癥醫學專業高級職稱臨床醫師負責質控。
1.2.3 免疫調節治療(1)A 組:為對照組,不使用免疫調節治療藥物;(2)B 組:胸腺法新(規格:1.6 mg∕支;國藥準字H20020545;成都地奧九泓制藥廠)1.6 mg 皮下注射qd,連用7 d;(3)C 組:胸腺法新1.6 mg 皮下注射qd 聯合血必凈注射液(規格:10 mL∕支;國藥準字Z20040033;天津紅日藥業)100 mL 靜滴q8h,連用7 d。
1.2.4 主要檢測指標(1)治療前后抽取所有入選患者清晨空腹外周靜脈血5 mL,采用流式細胞儀檢測CD3+T 細胞、CD4+T 細胞、CD8+T 細胞水平并計算CD4+∕CD8+值;(2)熒光抗體標記外周血單核細胞HLA-DR,按照試劑說明書通過流式細胞儀檢測HLA-DR 表達。所有實驗室檢測均在本院檢驗科實驗室完成。
1.2.5 觀察指標觀察3 組患者CD3+T 細胞計數、CD4+T 細胞計數、CD4+∕CD8+T 細胞比值及人白細胞DR 抗原(HLA-DR)等免疫指標和ICU 住院時間、總住院時間、90 d 病死率等。
1.3 統計學方法創建SPSS數據庫,采用SPSS 22.0統計軟件進行統計學分析,3 組服從或近似正態分布的計量資料以均數±標準差表示,采用單因素方差分析,如果檢驗結果為差異有統計學意義,兩兩之間比較采用LSD-t檢驗。計數資料以例表示,采用四格表χ2檢驗,以P<0.05 為差異有統計學意義。
2 結果
2.1 三組間入組時一般臨床資料比較由表1可見,三組在性別、年齡、入組時SOFA 評分、APACHEⅡ評分比較差異無統計學意義(P>0.05)。
表1 三組間一般臨床資料的比較Tab.1 Comparison of general clinical data among the three groups ±s
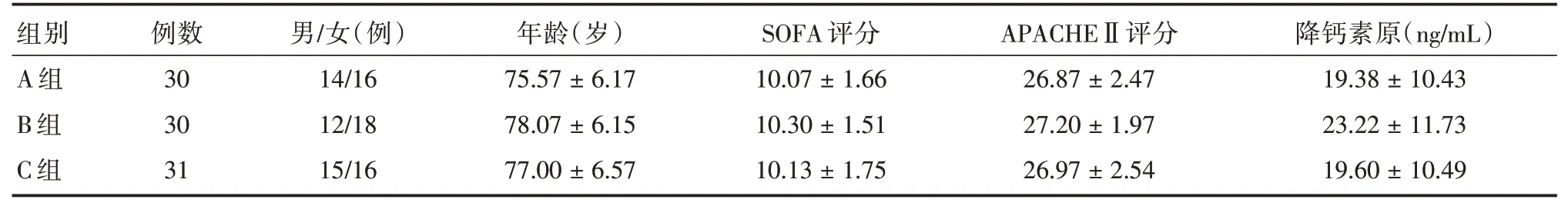
表1 三組間一般臨床資料的比較Tab.1 Comparison of general clinical data among the three groups ±s
∕女(例) 年齡(歲)SOFA 評分APACHEⅡ評分 降鈣素原(ng∕mL)組別A 組B 組C 組例數30 30 31男14∕16 12∕18 15∕16 75.57±6.17 78.07±6.15 77.00±6.57 10.07±1.66 10.30±1.51 10.13±1.75 26.87±2.47 27.20±1.97 26.97±2.54 19.38±10.43 23.22±11.73 19.60±10.49
2.2 三組間治療前后免疫功能的比較由表2 所見,三組治療前CD3+T 細胞計數、CD4+T 細胞計數、CD4+∕CD8+T 細胞比值、HLA-DR 表達率上比較差異無統計學意義(P>0.05)。與A 組比較,B 組、C 組治療后CD3+T 細胞計數、CD4+T 細胞計數、CD4+∕CD8+T細胞比值、HLA-DR表達率均顯著上升,差異有統計學意義(P<0.05);與B 組比較,C 組治療后CD3+T 細胞計數、CD4+T 細胞計數及HLA-DR表達率較治療前均顯著上升,差異有統計學意義(P<0.05)。
表2 三組間免疫功能的比較Tab.2 Comparison of mmunologic function among the three groups ±s
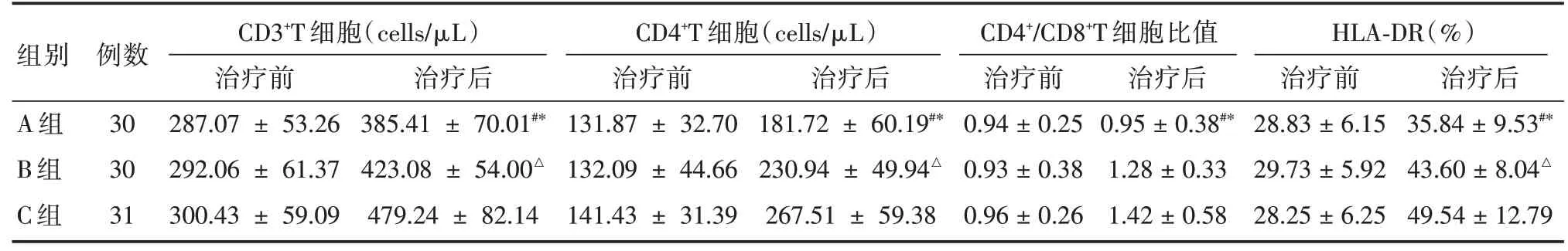
表2 三組間免疫功能的比較Tab.2 Comparison of mmunologic function among the three groups ±s
注:B 組與A 組比較,#P <0.05;C 組與A 組比較,*P <0.05;C 組與B 組比較,△P <0.05,表3 同
胞(cells∕μL)CD4+T 細胞(cells∕μL)CD4+∕CD8+T 細胞比值HLA-DR(%)治療后 治療前 治療后 治療前 治療后 治療前 治療后#*#*#*#*組別A 組B 組C 組例數30 30 31 CD3+T 細治療前287.07 ± 53.26 292.06 ± 61.37 300.43 ± 59.09 385.41 ± 70.01 423.08 ± 54.00△479.24 ± 82.14 131.87 ± 32.70 132.09 ± 44.66 141.43 ± 31.39 181.72 ± 60.19 230.94 ± 49.94△267.51 ± 59.38 0.94±0.25 0.93±0.38 0.96±0.26 0.95±0.38 1.28±0.33 1.42±0.58 28.83±6.15 29.73±5.92 28.25±6.25 35.84±9.53 43.60±8.04△49.54±12.79
2.3 三組之間ICU 住院時間、總住院時間、90 d病死率的比較與A 組比較,B 組在總住院時間、90 d 病死率顯著下降,差異有統計學意義(P<0.05),但在ICU 住院時間上差異無統計學意義(P>0.05),C 組ICU 住院時間、總住院時間、90 d病死率均顯著下降,差異具有統計學意義(P<0.05);與B 組比較,C 組ICU 住院時間、總住院時間均顯著減少,差異有統計學意義(P<0.05),但90 d 病死率差異無統計學意義(P>0.05),見表3。
2.4 治療后的免疫功能指標與90 d病死率的spearman 相關分析由表4 所見,治療后的CD4+T 細胞計數、CD4+∕CD8+T 細胞比值及HLA-DR(%)與90 d病死率存在顯著負相關(P<0.05),但CD3+T 細胞計數與90 d 病死率相關無相關性(P<0.05)。
表3 三組間ICU 住院時間、總住院時間、90 d 病死率的比較Tab.3 Comparison of ICU length of hospital stay,hospital stay and 90 day mortality among the three groups±s
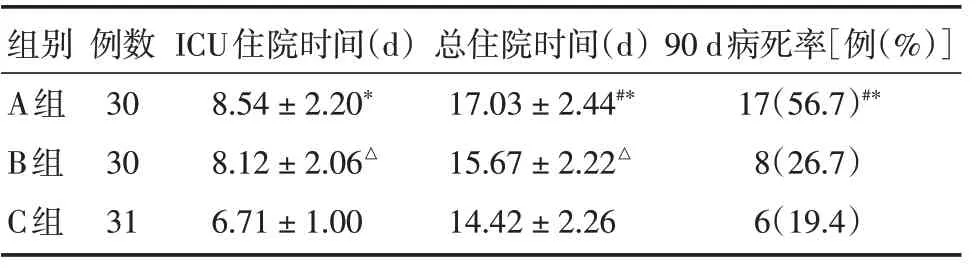
表3 三組間ICU 住院時間、總住院時間、90 d 病死率的比較Tab.3 Comparison of ICU length of hospital stay,hospital stay and 90 day mortality among the three groups±s
組別 例數ICU住院時間(d)總住院時間(d)90 d病死率[例(%)]A組308.54±2.20*17.03±2.44#*17(56.7)#*B組308.12±2.06△15.67±2.22△8(26.7)C組31 6.71±1.00 14.42±2.26 6(19.4)
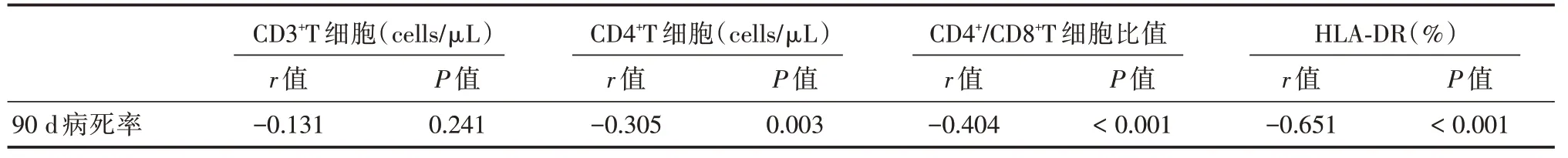
表4 治療后的免疫功能與90 d 病死率的spearman 相關分析Tab.4 Spearman correlation analysis of mmunologic function and 90 day mortality after treatment
3 討論
既往國內外針對膿毒癥患者免疫功能的評價進行了大量的研究,單核細胞HLA-DR 作為先天免疫應答的標志,是目前廣泛認可的免疫功能監測指標,多數研究結果顯示單核細胞HLA-DR 表達率可以預測膿毒癥患者的病死率[9-10]。XUE等[11]發現在老年患者中,對比非膿毒癥患者,膿毒癥患者CD3+T 細胞、CD4+T 細胞及CD8+T 細胞顯著減少(P<0.05),且二者與病情嚴重程度和預后密切相關。膿毒癥時T 細胞計數下降及CD4+∕CD8+T 細胞比值的失調與細胞凋亡的增加以及細胞增殖的障礙相關,大多數T 細胞還可能表現為長期的功能損傷造成慢性免疫麻痹[12]。本研究發現在HLA-DR表達率<40%的老年膿毒癥患者中普遍存在不同程度的T 淋巴細胞減少,提示合并細胞免疫功能受損。
免疫調節治療是膿毒癥的研究熱點之一,其重點在于識別不同的免疫功能狀態并給予個體化的治療[13]。胸腺素α1 是從胸腺組織分離的一種肽,具有多效性作用機制,影響涉及免疫抑制的多個免疫細胞亞群,具有免疫調節功能,作為常用的免疫調節藥物已廣泛應用于臨床[14]。中醫藥作為我國的傳統醫學在膿毒癥患者免疫調節治療上已凸顯其獨特的應用前景,其中血必凈注射液是常用的中成藥,具有活血化瘀、疏通經絡、潰散毒邪的作用,廣泛應用于膿毒癥危急重癥,可以拮抗內毒素,并抑制內源性炎性介質的失控釋放,大量臨床研究表明血必凈注射液能夠降低膿毒癥患者病死率。目前針對膿毒癥患者合并免疫抑制狀態的免疫調節治療方案上仍缺乏一致的意見,中西醫結合治療可能是更優的策略[15]。本研究結果顯示,與對照組比較,胸腺法新單用或聯合血必凈注射液均能夠顯著增加膿毒癥免疫抑制患者CD3+T 細胞、CD4+T 細胞計數、改善CD4+∕CD8+T細胞比值以及提高HLA-DR 的表達水平,同時能夠顯著降低膿毒癥免疫抑制患者的總住院時間及90 d 病死率(P<0.05)。在以往的研究中,胸腺肽α1 單獨或聯合治療可以有效降低膿毒癥的病死率,改善單核細胞HLA-DR 的表達,降低繼發感染發生率[16]。胸腺肽α1 干預治療也可以改善膿毒癥后的持續性炎癥-免疫抑制-分解代謝綜合征老年患者免疫功能,顯著升高單核細胞、CD4∕CD8比值和HLA-DR 的表達[17]。國內的一項多中心研究血必凈可以降低重癥肺炎患者20 d 病死率及ICU 總住院時間。本研究胸腺法新單獨應用或聯合血必凈注射液在改善免疫功能及降低病死率方面與既往研究基本一致。通過對免疫功能指標與90 d 病死率相關性分析發現,治療后的CD4+T 細胞計數、CD4+∕CD8+T 細胞比值及HLA-DR 表達率與90 d 病死率存在顯著負相關,提示兩種免疫調節治療方案改善預后的機制與免疫功能改善有關。
本研究進行胸腺法新聯合血必凈注射液方案的研究發現,與單獨應用胸腺法新比較,聯合方案可以顯著增加老年膿毒癥合并免疫抑制患者CD3+T 細胞、CD4+T 細胞以及HLA-DR 的表達水平,同時顯著降低了ICU 住院時間、總住院時間(P<0.05)。本研究結果與相關研究結果基本一致,但本研究的研究對象為存在免疫抑制的老年膿毒癥患者,其免疫指標的變化更能體現免疫調節治療的效果。以上結果提示胸腺法新聯合血必凈注射液在膿毒癥免疫抑制患者中應用具有協同作用,與中藥血必凈一方面通過降低膿毒癥患者血清IL-6、TNF-α等促炎因子減輕炎癥反應;另一方面通過改善CD4+∕CD8+T細胞的比例以改善免疫功能相關[18]。
綜上所述,老年膿毒癥合并免疫抑制患者應用胸腺法新或聯合血必凈注射液可以改善的免疫功能及預后,聯合應用具有協同作用,優于單獨使用胸腺法新。本研究具有一定的局限性,一方面本研究為小樣本隨機對照研究,另一方面未能進行不同免疫狀態老年膿毒癥患者胸腺法新及血必凈注射液單藥與聯合方案之間的對比研究,也未能針對兩種藥物免疫調節作用具體分子生物學機制進行研究,有待大樣本的基礎與臨床研究進一步探索。

