木薯MeGalt1基因克隆、在采后生理腐爛過程中表達分析及載體構建
安飛飛, 崔夢佳, 楊 龍, 陳松筆
(1.中國熱帶農業科學院熱帶作物品種資源研究所/農業部木薯種質資源保護與利用重點實驗室,海南 海口 571101;2.南京農業大學農學院,江蘇 南京 210000;3.貴州省亞熱帶作物研究所,貴州 興義 562400)
木薯(ManihotesculentaCrantz)是世界亞熱帶和熱帶地區近10億人的主要糧食作物,在世界糧食安全、生物質能源和食品加工等領域扮演著不可替代的角色[1,2].然而木薯塊根采后24~72 h內周邊部位出現褐色或藍黑色斑點,失去其加工價值,這種現象稱之為“采后生理性腐爛”(post-harvest physiological deterioration, PPD)[3-5].PPD現象極大影響了木薯的開發利用,成為制約木薯產業發展的重大瓶頸.研究表明木薯塊根活性氧積累和快速迸發是產生PPD的主要原因[6-8],影響PPD產生的代謝通路涉及氧化脅迫[9-11]、鈣信號轉導和細胞凋亡[12]、乙烯和苯丙酸通路[13]、MAPK(胞外信號調節激酶)cascades[14]、蛋白質N-糖基化修飾通路[15].但至今尚未有一種行之有效的方法可用于抑制木薯塊根PPD[16].因此,解析木薯PPD產生的分子機制,選育耐PPD的木薯品種,是今后木薯塊根綜合利用的研究熱點,也是全球木薯育種家面臨的挑戰.
蛋白質N-糖基化修飾是真核生物蛋白質翻譯后修飾的一種重要手段,參與細胞識別、分化、發育、信號轉導和免疫應答等多個重要的生命過程[1]〗.β-1,3-半乳糖基轉移酶(Galt)是參與蛋白質N-糖基化修飾過程的關鍵酶,Galt1是形成糖蛋白中Lewis a結構的關鍵酶,在植物應對環境脅迫中起著重要作用[18],但其在木薯塊根PPD中的功能尚未清晰.我們前期研究發現,隨著木薯塊根腐爛加重,Galt活性也隨之增高.為進一步研究MeGalt1在木薯PPD過程中的作用機制,本研究在克隆木薯MeGalt1基因的基礎上,分析MeGalt1基因在不同采后生理腐爛程度塊根中的表達變化,并構建相關的植物表達載體,為進一步解析MeGalt1在木薯塊根采后生理腐爛中的分子作用機制提供依據.
1 材料與方法
1.1 材料
本研究選用的材料TMS 60444、華南9號(SC9)來自中國熱帶農業科學院熱帶作物品種資源研究所國家木薯種質資源圃,于植后9個月收獲木薯塊根進行試驗.
1.2 方法
1.2.1 試驗處理 植后9個月收獲SC9塊根,置于26 ℃、相對溫度為55%~60%的恒溫培養箱中,于3、6、9 d對塊根PPD程度進行觀察并取樣,每次取3個重復,經液氮速凍后,保存于-80 ℃備用.
1.2.2 RNA提取與cDNA合成 參照RNA提取試劑盒(DP441)提取木薯塊根總RNA,利用北京全式金公司生產的第一鏈cDNA合成試劑盒(AT311-02)將RNA反轉錄成cDNA,-20 ℃儲存備用.
1.2.3 引物設計與實時熒光定量聚合酶鏈式反應(RT-PCR) 用Primer 5.0設計MeGalt1全長擴增及定量PCR引物,由廣州艾基生物技術有限公司進行合成.引物序列如下表1所示.MeGalt1基因全長擴增正向、反向引物分別帶有KpnⅠ和SpeⅠ酶切位點及保護堿基,可用于植物表達載體的構建.RT-PCR采用TaKaRa公司生產的SYBR試劑盒(RR820A),按說明在Thermo Fisher Scientific公司生產的 Real-time Thermal Cycler上操作,反應程序為:95 ℃預變性30 s,95 ℃ 10 s,55 ℃ 10 s,72 ℃ 20 s,40個循環.每個樣品重復3次,相對表達量按ΔΔCT法進行計算.

表1 木薯MeGalt1的全長擴增及實時熒光定量PCR引物Table 1 Primers of the MeGalt1 gene for PCR and RT-PCR
1.2.4 N-糖基化修飾的Western Blot檢測 參照Carvalho et al[19]方法利用專一性識別糖蛋白中Lewis a結構的JIM84抗體[18]對PPD過程中的N-糖基化修飾水平進行驗證.取1.5 g木薯塊根,經丙酮沉淀后進行Western blot驗證.
1.2.5 生物信息學分析 采用Clustal X軟件進行序列比對;采用ExPASy ProtParam軟件分析蛋白質的分子量和等電點;采用Mega 4.0軟件構建系統發育樹.
1.2.6 植物表達載體構建 用限制性內切酶KpnⅠ和SpeⅠ分別對含有目的基因MeGalt1-1和MeGalt1-3的重組質粒和植物表達載體pCAMBIA1300r進行雙酶切.酶切體系20.0 μL:dd H2O 14.0 μL,質粒3.0 μL,10×Fast Digest Buffer 2.0 μL,KpnⅠ和SpeⅠ各0.5 μL,37 ℃反應3 h,65 ℃ 10 min.反應產物用1%瓊脂糖凝膠進行電泳,分別回收MeGalt1-1和MeGalt1-3目的片段和pCAMBIA1300r載體片段,用T4連接酶將目的基因片段和植物表達載體片段進行連接,16 ℃過夜反應;將連接產物轉化大腸桿菌TOP10,篩選陽性克隆;進行PCR及雙酶切驗證,測序,構建植物表達載體pCAMBIA1300r-MeGalt1-1和pCAMBIA1300r-MeGalt1-3.
2 結果與分析
2.1 木薯塊根采后不同時間點PPD觀察
SC9木薯塊根置于26 ℃恒溫箱,分別在第0、3、6、9 d取樣觀察,其表型如圖1所示,采后第0天,木薯塊根水分含量充足有光澤,沒有PPD現象;采后第3天,塊根出現輕微變質,橫切面上外圍出現了黑色斑塊;采后第6天,塊根出現了較大面積變質,面積約占橫切面的1/3;采后第9天,塊根整個橫切大部分均出現PPD變質現象,且塊根出現了裂縫.

A:0 d;B:3 d;C:6 d;D:9 d.圖1 SC9采后常溫不同時間點PPD情況Fig.1 PPD of cassava SC9 at different time periods
2.2 木薯MeGalt1基因的克隆
以擬南芥AtGalt1序列(At1g26810)為基礎,在木薯數據庫中尋找與其同源的序列(Manes.01G091600, Manes.01G036300, Manes.05G102300),分別命名為MeGalt1-1、MeGalt1-2、MeGalt1-3.設計特異性引物,以木薯TMS 60444塊根cDNA為模板,進行PCR擴增,經1%瓊脂糖凝膠電泳檢測,獲得1條約2 000 bp的單一條帶(圖2).回收PCR產物連接Blunt Zero載體,測序比對后發現MeGalt1-1與Phytozome數據庫木薯基因組(栽培品種:AM560)公布的Manes.01G091600序列一致,MeGalt1-2與Manes.01G036300有6個堿基的差異,同源性高達 99.7%,MeGalt1-3與Manes.05G102300只有1個堿基的差異,同源性高達99.9%.其編碼的氨基酸、預測的蛋白質分子質量及理論等電點如表2所示.UniProt數據庫顯示MeGalt1-1、MeGalt1-2和MeGalt1-3編碼的蛋白均含有半乳糖基轉移酶的保守結構域(PF01762),這進一步表明克隆到的基因為MeGalt1基因.

M:DL2000 marker;1:MeGalt1-1基因;2:MeGalt1-2基因;3:MeGalt1-3基因.圖2 MeGalt1基因PCR電泳結果Fig.2 Electrophoresis of PCR products of the MeGalt1 gene

表2 木薯MeGalt1的基本信息Table 2 Basic information of the MeGalt1 gene
2.3 基因MeGalt進化分析
以擬南芥中6個編碼Galt的蛋白序列為參考,在Phytozome木薯數據庫中進行比對,得到9個MeGalt基因,將其氨基酸序列與擬南芥編碼Galt的序列進行比對并進行進化分析(圖3).圖中可以看出在木薯中編碼MeGalt1的有3個基因(MeGalt1-1、MeGalt1-2、MeGalt1-3),根據擬南芥中AtGalt1的功能,可推測木薯中這3個基因與蛋白質N-糖基化修飾中Lewis a結構形成密切相關.
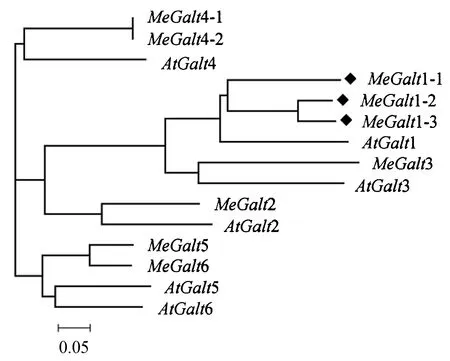
◆木薯中編碼MeGalt1的3個基因.圖3 MeGalt1基因系統進化分析Fig.3 Phylogenetic tree of the MeGalt1 gene
2.4 MeGalt1在木薯PPD過程中的表達分析
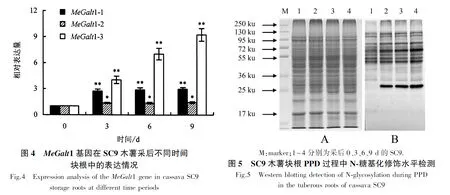
利用RT-PCR技術對MeGalt1基因在木薯塊根PPD過程中的表達情況進行分析(圖4).隨著時間的推移,MeGalt1-2基因無顯著變化,MeGalt1-1及MeGalt1-3基因表達顯著增強,且MeGalt1-3基因表達變化最顯著.基于上述結果,推測參與木薯塊根PPD調控過程的基因為MeGalt1-1和MeGalt1-3.
2.5 木薯塊根PPD過程中蛋白質的N-糖基化修飾水平檢測
為進一步檢測木薯塊根PPD過程中蛋白質是否存在N-糖基化修飾水平的變化,利用專一性識別糖基化蛋白的抗體JIM84檢測SC9木薯采后不同時間(0、3、6、9 d)塊根中N-糖基化修飾水平情況(圖5).在采后3~9 d,約25和35 ku的蛋白質發生明顯的N-糖基化修飾,證明木薯塊根PPD過程受到蛋白質N-糖基化修飾的調控.本研究結果可為開展后續研究提供依據.
2.6 木薯MeGalt1表達載體的構建
用限制性內切酶KpnⅠ、SpeⅠ分別對含有目的基因MeGalt1-1和MeGalt1-3的重組質粒和植物表達載體pCAMBIA1300r質粒進行雙酶切反應,連接后轉化大腸桿菌TOP10感受態細胞,提取質粒經PCR檢測,電泳獲得約2 000 bp的條帶.同時,提取質粒并進行雙酶切反應,分別獲得約10 000 bp的載體和約2 000 bp的條帶(圖6),2種驗證方法都獲得與目的基因片段長度一致的條帶.經進一步測序驗證,明確為MeGalt1-1和MeGalt1-3基因,表明已成功構建pCAMBIA1300r-MeGalt1-1和pCAMBIA1300r-MeGalt1-3植物過表達載體.
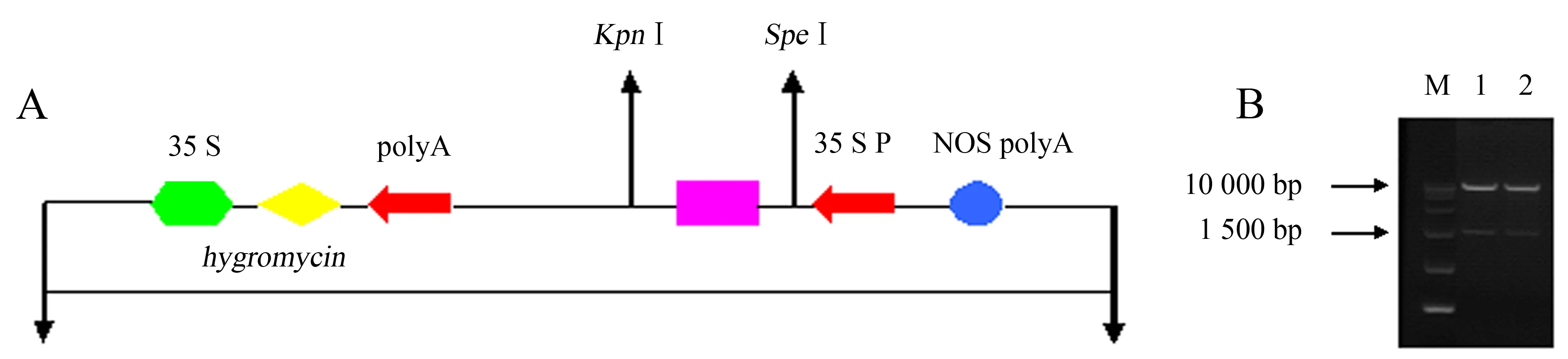
M:DL15000 marker;1:pCAMBIA1300r-MeGalt1-1雙酶切;2:pCAMBIA1300r-MeGalt1-3雙酶切.圖6 植物表達載體pCAMBIA1300r-MeGalt1-1和pCAMBIA1300r-MeGalt1-3示意圖(A)及雙酶切驗證(B)Fig.6 Schematic diagram of pCAMBIA1300r-MeGalt1-1 and pCAMBIA1300r-MeGalt1-3 (A) and verification by restriction enzyme digestion (B)
3 討論
β-1,3-半乳糖基轉移酶(Galt)是參與N-聚糖加工及蛋白質糖基化修飾的關鍵酶.目前已經從多個物種中克隆了Galt基因[20,21],然而在熱帶作物木薯中還沒有關于Galt基因克隆的報道.本研究從木薯TMS 60444中克隆了3個Galt1基因MeGalt1-1,MeGalt1-2和MeGalt1-3,分別具有1 890、1 893和1 902 bp的開放閱讀框,編碼629、629和633個氨基酸,與其他物種中的Galt1大小基本一致.
構建植物表達載體是基因功能驗證的主要手段之一.通過構建N-糖基化修飾過程中不同基因的植物表達載體,可驗證這些基因的生物學功能.Strasser et al[18]通過構建AtGalt1過表達載體,驗證AtGalt1與N-糖中Lewis a結構形成密切相關.Ghosh et al[22]與Meli et al[23]通過構建RNAi干擾載體,驗證抑制N-糖加工酶活性可延緩果實成熟.Liebminger et al[24]研究表明,N-聚糖加工酶MNS在擬南芥根系形成發育過程中起到重要作用[24].
木薯PPD現象是一種生理性病害,其產生是一個復雜的生物學過程,涉及到多個代謝通路[10].利用轉基因技術過量表達活性氧清除基因MeCu/ZnSOD和MeCAT1,轉基因植株塊根的丙二醛、葉綠素降解、脂質過氧化和H2O2積累水平與對照相比顯著降低,達到延緩PPD超過10 d的效果[25].Zidenga et al[26]采用轉基因方法過量表達AOX1A基因,顯示轉基因植株活性氧積累水平比對照降低10倍,從而使采后塊根的PPD發生延緩了14~21 d.Vanderschuren et al[13]通過轉基因方法過量表達胞質谷胱甘肽過氧化物酶基因,發現轉基因植株塊根能延緩PPD產生,減少脂質過氧化和H2O2積累.Beyene et al[27]通過DXS和crtB共表達提高β-胡蘿卜素在木薯塊根的積累,與非轉基因植株對照相比,置于常溫10 d沒有PPD現象,而對照腐爛變質程度達到50%.前期研究表明N-聚糖加工酶α-甘露糖苷酶(MeMNSs)與木薯PPD過程存在相關性[15],且N-糖基化修飾參與了木薯PPD調控過程,但其具體的分子調控機理尚待進一步明確.我們前期研究發現,隨著木薯塊根腐爛加重,Galt活性隨之增高.本研究表明MeGalt1-1及MeGalt1-3基因表達隨著采后生理腐爛程度的加深而顯著增強,進一步證實MeGalt表達與木薯PPD過程存在相關性.在此基礎上成功構建木薯Galt1-1和Galt1-3基因表達載體pCAMBIA1300r-MeGalt1-1和pCAMBIA1300r-MeGalt1-3,為進一步研究該基因以及蛋白質N-糖基化修飾在木薯采后生理腐爛過程中的生物學功能奠定了基礎.

