奈達鉑聯合吉西他濱對比順鉑聯合吉西他濱一線治療晚期肺鱗癌隨機對照臨床研究
陳勝佳 朱 凱 林金蘭 張 晶 徐振武 莊 武 徐海鵬
福建省腫瘤醫院 福建醫科大學附屬腫瘤醫院胸部腫瘤內科,福建福州 350014
目前晚期肺鱗癌的治療進展相對于晚期肺腺癌進展緩慢,一線治療方式上除了部分肺鱗癌可考慮給予單藥免疫治療和可選擇免疫聯合化療外,主要治療方式仍是以全身化療為主,傳統的鉑類因其不良反應,特別是消化道反應發生率高,人們期望探討新的治療方案[1]。奈達鉑作為一種新型的鉑類,目前在多種瘤種治療中應用[2-3]。為進一步探討奈達鉑在肺鱗癌治療中的效果,福建省腫瘤醫院(我中心)既往聯合福州市肺科醫院、廈門市第二醫院呼吸科、泉州市第一醫院呼吸科共4家中心于2012年9月至2013年12月完成101例奈達鉑聯合吉西他濱與順鉑聯合吉西他濱一線治療晚期肺鱗癌隨機對照臨床研究,之前報道了奈達鉑聯合吉西他濱(NDP+GEM)治療晚期肺鱗狀細胞癌的療效與不良反應[4]。目前更新了OS數據,現報道如下。
1 資料與方法
1.1 一般資料
病例入選標準:①經病理學(或細胞學)和影像學確診的ⅢB及Ⅳ期的肺鱗癌初治患者,臨床分期采用NSCLC AJCC/UICC第7版TNM分期標準;②PS評分0~1分;③臨床上至少有1個有可評價病灶;④年齡18~75歲;⑤預計生存期>3個月;⑥至少完成2個周期治療并完成療效評價;⑦無法手術治療及放射治療,未接受過全身放化療;⑧無合并嚴重的全身疾病;⑨治療前血常規、肝腎功能、心電圖等無明顯異常。研究設計:多中心、開放性、前瞻性、隨機對照臨床研究。按照治療組與對照組隨機入組。根據入選標準,研究期間試驗組入組69例,對照組入組32例,兩組患者一般資料比較,差異無統計學意義(P>0.05)。具有可比性。見表1。
1.2 給藥方法
試驗組:NDP(捷佰舒,南京先聲東元制藥有限公司,H20030884)80 mg/m2靜脈滴注d1,GEM(澤菲江蘇豪森藥業股份有限公司,H20030105)1000 mg/m2靜脈滴注d1,d8;對照組:DDP 75 mg/m2靜脈滴注 d1,GEM(澤菲)1000 mg/m2靜脈滴注 d1,d8;奈達鉑。給藥方法:80 mg/m2靜脈滴注,受試者每周期用藥一次,奈達鉑加入500 ml的生理鹽水中,靜脈滴注2 h,滴完后繼續靜滴輸液1000 ml以上,每3周重復。藥品來源:注射用奈達鉑,10 mg/支,由南京先聲藥業有限公司。本品為白色凍干粉針劑,遮光,密閉,室溫保存。注射用吉西他濱:200 mg/支,由江蘇豪森制藥有限公司。化療2個周期,對于穩定及有效的病例可以繼續應用原化療方案至4 ~ 6個周期。觀察兩組患者的療效及毒副反應。
1.3 療效評價
根據RECIST 1.1實體瘤療效評價標準分為:完全緩解(CR)、部分緩解(PR)、穩定(SD)和進展(PD)。計算 有 效率RR為(CR+PR)/總例 數×100%,臨床獲益率DCR為(CR+PR+SD)/總例數×100%[5]。無進展生存時間(PFS)是指患者隨機入組給藥時至任何有記錄的病變進展之日或任何原因引起的死亡之日的時間。總生存(OS):從隨機化分組開始,至因任何原因引起死亡的時間。自判定療效有效(CR和PR)或穩定(SD)之日開始,每2個月定期隨訪1次,以觀察有效或穩定患者的PFS和OS[6]。不良反應評價 按照NCI CTC 3.0的毒性指標及分級標準進行評價[7]。
1.4 統計學方法
本研究數據采用專業SPSS 20.0軟件進行統計學分析處理,計數資料用[n(%)]表示,采用χ2檢驗,計量資料以()表示,采用t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 兩組化療完成情況比較
兩組的大部分患者接受了至少兩個周期的化療,與對照組比較試驗組接受化療的周期略長,但差異無統計學意義(P>0.05),見表2。
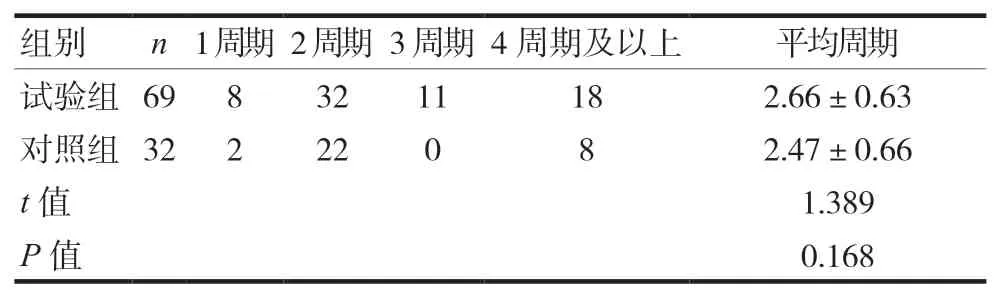
表2 兩組一線治療晚期肺鱗癌完成情況比較
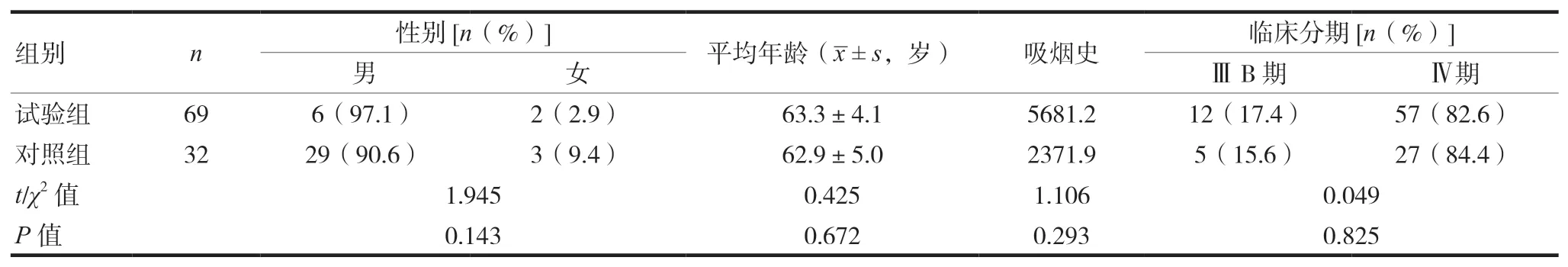
表1 兩組臨床一般情況比較
2.2 近期療效
兩組的CR患者均為0。兩組的RR分別是24.64%和18.75%,與對照組比較,差異無統計學意義(P>0.05)。兩組的DCR分別是75.36%和71.88%,與對照組比較,差異無統計學意義(P>0.05)。見表3(漸進性水平檢測為1)。
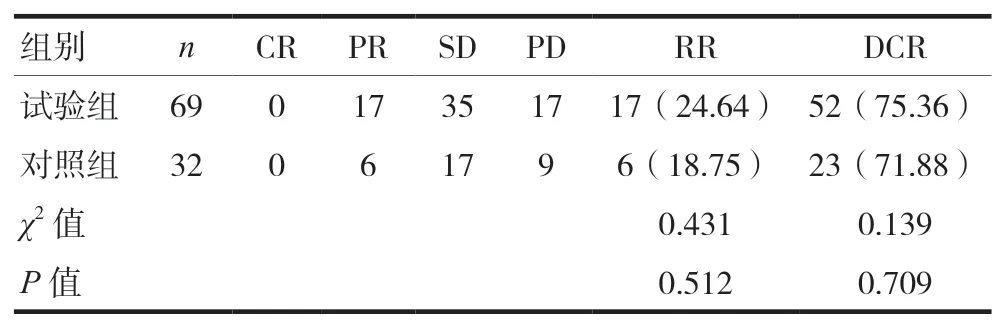
表3 兩組一線治療晚期肺鱗癌近期療效比較
2.3 兩組中位PFS
兩組一線治療晚期肺鱗癌PFS曲線(圖1)。試驗組中位PFS為4.0個月(95%CI:3.11~4.88個月),對照組中位PFS為4.0個月(95%CI:1.72~6.27個月),兩組差異無統計學意義(P>0.05)。
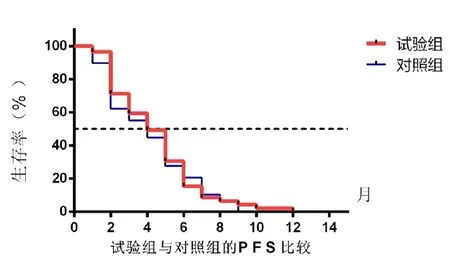
圖1 兩組的PFS比較
2.4 兩組中位OS
兩組一線治療晚期肺鱗癌OS曲線(圖2)。實驗組中位OS為10.10個月,對照組中位OS為8.05個月,試驗組OS比對照組延長了2.05個月,但兩組間比較差異無統計學意義(P>0.05)。
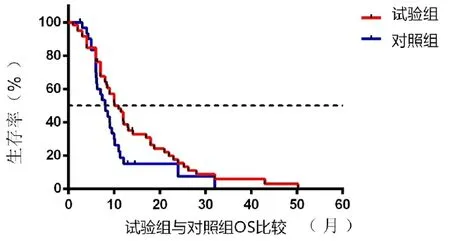
圖2 兩組的OS
2.5 兩組患者不良反應比較
兩組患者不良反應主要表現在骨髓抑制,兩組差異無統計學意義(P>0.05)。試驗組惡心嘔吐發生率低于對照組,有顯著性差異。試驗組有一例于第二周期化療時出現胸悶,氣促,顏面潮紅,血壓下降等反應,考慮奈達鉑過敏反應,予以停藥,抗過敏反應處理后緩解。第三周期以后改為順鉑化療。

表4 兩組一線治療晚期肺鱗癌不良反應比較
3 討論
隨著分子生物學及藥物學的進展,晚期非小細胞肺癌的治療已經邁入了個體化治療的時代。根據目前世界衛生組織(WHO)的分類,非小細胞肺癌包括許多病理亞型,主要可分為鱗癌和非鱗癌,非鱗癌中的腺癌可進一步進行分子分型[8-9],但鱗癌目前缺乏相對應的靶向藥物,在治療上,分子分型意義不大。近年來,以PD-1為代表的免疫檢查點抑制劑在非小細胞肺癌治療上取得了一定的進步,特別是缺乏靶向治療的晚期鱗癌治療上,這種進步顯得尤為重要,目前FDA已經批準了Nivolumab(Opdivo)納武單抗用于轉移性鱗狀非小細胞肺癌二線治療。國家藥品監督管理局也批準了納武利尤單抗注射液用于治療表皮生長因子受體(EGFR)基因突變陰性和間變性淋巴瘤激酶(ALK)陰性、既往接受過含鉑方案化療后疾病進展或不可耐受的局部晚期或轉移性非小細胞肺癌(NSCLC)成人患者的二線治療。但由于免疫治療藥物的可及性及昂貴的價格,傳統的含鉑兩藥聯合方案在晚期肺鱗癌的治療上依然占有重要的位置。如何優化治療方案,提高肺鱗癌的化療有效率,減輕毒性,提高晚期肺鱗癌生存期成為我們面對的難題。
奈達鉑自上市以來,適應癥為治療頭頸部癌、小細胞肺癌、非小細胞肺癌、食道癌、膀胱癌、睪丸腫瘤、卵巢癌、子宮頸癌等瘤種。因為晚期肺鱗癌有效治療藥物較少,所以前期有不少奈達鉑治療肺鱗癌的臨床研究。但大多數臨床研究均為小樣本的Ⅱ期臨床研究,包括一線治療和二、三線治療的研究。Masago等[10]報道的奈達鉑聯合吉西他濱治療晚期初治肺鱗癌Ⅰ期臨床研究中,最大耐受劑量為吉西他濱1000 mg/m2,奈達鉑80 mg/m2,推薦的劑量為吉西他濱800 mg/m2d1、d8,奈達鉑70 mg/m2d1進入Ⅱ期臨床研究。Teramoto等[11]在多西他賽聯合奈達鉑治療轉移性非小細胞肺癌的Ⅱ期臨床研究中發現該方案對鱗癌療效更佳。Naito等[12]進行的一項研究奈達鉑聯合多西他賽治療晚期初治肺鱗狀細胞癌,共有21例患者參與研究,其中18例是男性。患者中位年齡為67歲,客觀反應率為62%,平均無進展生存時間為7.4個月,平均生存時間為16.1個月,1年生存率為66.7%。最常見的不良反應是中性粒細胞減少(3/4級,86%),非血液毒性相對較輕,該研究認為奈達鉑聯合多西他賽治療肺鱗癌活性高。在一項針對老年肺癌的研究中[13],入組了75歲以上的老年初治肺癌35例,予以吉西他濱800 mg/m2,第一天、第八天,奈達鉑80 mg/m2,第一天,每三周重復。結果RR為45.7%,MST為14個月,3~4級毒性包括粒細胞減少74.3%,血小板減少48.6%,貧血34.3%,感染2.9%,為治療相關的死亡。該方案對高齡肺癌有效且耐受性好。本中心關于奈達鉑聯合吉西他濱治療晚期復治肺鱗癌臨床觀察[14],入組26例晚期復治肺鱗癌,總有效率為26.1%,臨床獲益率為78.3%,PFS 4個月。主要毒性Ⅲ/Ⅳ級粒細胞下降為42.3%(11/26),Ⅲ~Ⅳ級血小板下降30.8%(8/26),Ⅲ級貧血7.7%(2/26)。而最近進行的一項比較大樣本的回顧性、隨機、對照臨床研究顯示[15],奈達鉑與三代細胞毒藥物的聯合實驗組緩解率(ORR)和疾病控制率(DCR)分別為48.6%和95.2%,較對照聯合組為35.1%和89.2%(P<0.01),顯著提高。實驗組的生存時間較對照組延長(P<0.01)。實驗組貧血、肌酐升高、惡心和嘔吐發生率較對照組明顯降低(P<0.05)。以上研究均表明,以奈達鉑為主的兩藥聯合方案無論在一線治療或二線治療,亦或高齡患者,治療晚期肺鱗癌活性高,不良反應可耐受。
本研究選擇標準劑量的順鉑聯合吉西他濱作為標準對照,根據奈達鉑聯合吉西他濱Ⅰ期臨床研究推薦的劑量,兩組用藥劑量,入組的年齡、性別、分期、吸煙情況、化療完成情況、因不良反應減低劑量等均均衡可比。試驗組的RR、DCR、PFS與對照組比較,差異無統計學意義,雖然中位OS絕對值延長了2個月,但也未達到統計學差異。不良反應方面,試驗組白細胞下降比較明顯,但與對照組比較,差異無統計學意義(P>0.05)。而對照組胃腸道反應較為嚴重(P<0.05)。實驗組包括肝腎功能損傷、皮疹、神經毒性等均比較輕微,均能很好耐受。
綜上所述,奈達鉑聯合吉西他濱治療晚期肺鱗癌有效率高,不良反應輕,相對于標準方案,肺鱗癌的化療提供了一個等效低毒的選擇,可以作為肺鱗癌一線治療的選擇之一。

