不同鈣基吸附劑捕集CO2后的硫酸化反應特性研究
孫 鋒,申 成,羅 聰,羅 童
(1.中國艦船研究設計中心,湖北 武漢 430064;2.華中科技大學 煤燃燒國家重點實驗室,湖北 武漢 430074)
0 引 言
利用鈣基吸附劑的碳酸化-煅燒循環反應捕集CO2的技術,也叫鈣循環(Calcium looping),被認為極具應用潛力的燃燒后CO2捕集技術之一[1]。其基本原理是利用CaO與CO2進行循環碳酸化-煅燒反應來捕集煙氣中的CO2。但存在重大問題亟需深入研究:普通CaO吸附劑的CO2捕集性能會隨著循環反應次數的增加而大幅衰減,且吸附劑捕集煙氣中CO2過程中,會受到微量有害氣體的負面影響[2]。其中SO2是對鈣循環系統影響最大的有害氣體[3]。燃煤中含有微量硫分,燃煤煙氣中會存在0.05%~0.30%的SO2。在高溫條件下,鈣基吸附劑可與低濃度SO2反應生成CaSO4。研究發現,吸附劑表面生成的不易分解的CaSO4,不但使吸附劑中CaO含量逐漸下降,且CaSO4產物層會使具有多孔結構的CaO阻塞,從而導致CaO的CO2吸附能力大幅下降[4]。
Sun等[5]提出可以先對燃煤煙氣脫硫,再將脫硫后的煙氣通入鈣基循環系統進行CO2捕集,增強鈣基吸附劑的循環使用壽命。Manovic等[6]發現經歷多次碳酸化-煅燒反應后的鈣基吸附劑,其CO2吸附能力幾乎完全喪失,但SO2吸附能力卻大幅增強。因此,提出可以先將鈣基吸附劑用于循環CO2捕集系統,待CO2吸附活性喪失后,將其應用于循環流化床脫硫系統,可提高燃煤尾氣的脫硫效率。Li等[7]進一步利用木醋酸改性鈣基吸附劑,提高了吸附劑的循環CO2吸附能力,發現隨著碳酸化-煅燒循環次數的增加,吸附劑的脫硫能力得以增強,100次循環CO2捕集后的改性吸附劑的硫酸化轉化率可以達到40%。Qin等[8]提出了一種顆粒模型,描述了吸附劑在循環捕集CO2過程中煅燒-硫酸化的傳熱傳質過程,發現反應氣氛、顆粒大小對吸附劑的碳酸化-煅燒-硫酸化影響較大。
為了提高鈣基吸附劑的CO2捕集性能,本課題組提出了燃燒法制備高性能吸附劑粉末[9],并將吸附劑粉末與水泥混合擠壓得到大顆粒,其循環碳酸化反應性能會大幅增強[10-15]。但鮮見針對高性能鈣基吸附劑顆粒經歷數百次循環碳酸化-煅燒反應后,將其用于脫硫的試驗研究。鑒于此,本文詳細考察了經歷不同循環反應次數的高性能合成鈣基吸附劑顆粒和石灰石吸附劑的硫酸化反應動力學特性,以獲悉兩者在硫酸化反應特性上的差異。
1 試 驗
1.1 高性能鈣基吸附劑的制備方法
制備所用試劑均為分析純試劑,購置于阿拉丁試劑有限公司。高性能合成鈣基吸附劑顆粒的制備方法為:首先,將四水硝酸鈣、一水檸檬酸溶解于去離子水中(鈣與檸檬酸的摩爾比為1∶1,鈣與水的摩爾比為1∶10),在80 ℃恒溫水浴條件下攪拌0.5 h得到糊狀膠體。然后,將膠體放入600 ℃馬弗爐內,有機物被點燃,燃燒完畢后得到灰黑色含碳鈣基粉末,再將粉末在850 ℃氮氣氛圍中煅燒10 min即可得到高性能CaO吸附劑粉末,平均粒徑約為1 μm。將該粉末黏結為高性能鈣基吸附劑顆粒,具體步驟為:將該粉末與水泥末按質量比3∶1干混合并機械震蕩均勻;加入少量水使之攪拌成泥狀,將泥狀混合物于造粒機內擠壓成條,并在滾圓機內滾動形成大顆粒。再將大顆粒在烘箱中于110 ℃條件下干燥8 h,最后在900 ℃馬弗爐內煅燒1 h可得到合成鈣基吸附劑大顆粒。該制備方法與本課題組先前研究中所采用的制備方法相同[22]。
1.2 吸附劑的硫酸化測試方法
進行硫酸化反應測試前,先將大顆粒(粒徑約2 mm)磨碎。本文測試了粒徑250~400 μm顆粒的相關物理與化學特性。采用賽默飛Cahn 121熱重分析儀(TGA,thermogravimetric analysis)進行了吸附劑硫酸化反應動力學試驗,步驟為:將20 mg左右的吸附劑放入樣本籃中,初始氣流為80 mL/min N2,從室溫以20 ℃/min升溫速率加熱到850 ℃,并維持恒溫10 min,使吸附劑中鈣基物質完全分解成CaO。將試驗氣體切換為100 mL/min的N2、O2、SO2混合氣流并進行CaO硫酸化反應(氣氛為0.2% SO2與5% O2,由N2平衡)。CaO硫酸化效率用式(1)計算(基于CaO的硫酸化產物全為CaSO4,無CaSO3)。先前研究發現,溫度超過740 ℃時,CaO的硫酸化產物全為CaSO4[16]。
(1)
其中,X(CaSO4)為CaO的硫酸化轉化率;m′為吸附劑硫酸化后的質量,g;m0為吸附劑初始煅燒后的質量,g;M(SO3)和M(CaO)分別為SO3和CaO的摩爾質量,g/mol;b為吸附劑中CaO質量比。實際煙氣中,硫酸化時除了SO2和O2,還有CO2和HCl,但試驗時加入這些氣氛會對吸附劑的硫酸化性能測試產生干擾,因此本文不考慮CO2和HCl對硫酸化的影響。
1.3 吸附劑的循環碳酸化-煅燒測試方法
吸附劑的碳酸化-煅燒循環反應試驗仍采用TGA分析儀測試,步驟為:將20 mg左右吸附劑放入樣本籃中,通入100 mL/min N2,從室溫溫以20 ℃/min升溫速率加熱850 ℃,并保持10 min,使吸附劑中的鈣基物質完全分解成CaO。
碳酸化-煅燒循環反應步驟為:將100 mL/min N2切換為100 mL/min CO2進行碳酸化反應,反應時間3 min;隨后,將100 mL/min CO2切換為100 mL/min N2進行煅燒反應,反應時間3 min,由此完成一次循環碳酸化-煅燒試驗,反復循環直至完成所需循環次數。
試驗氣氛條件為理想條件下的氣氛:碳酸化為100% CO2,煅燒為100% N2,硫酸化為0.2% SO2、5% O2和94.8% N2。選擇理想氣氛條件可以有效排除雜質成分的干擾。實際煙氣中,碳酸化時CO2濃度12%左右產生較大影響的雜質氣體是SO2和HCl,但試驗時加入這些氣氛會對吸附劑的循環性能測試產生干擾。煅燒時主要氣氛為CO2,如果使用該條件,熱重分析儀中的煅燒溫度需設置在950 ℃以上,碳酸化時又需要較長時間的降溫處理,與實際條件不一致。為了便捷地測試吸附劑的循環反應性能,將熱重分析儀設置在850 ℃進行等溫碳酸化-煅燒反應。
2 試驗結果與討論
2.1 鈣基吸附劑的CO2和SO2吸附特性
樣品的X射線衍射圖譜如圖1所示,顯示了原料和合成鈣基吸附劑顆粒的主要物相組分。吸附劑主要成分是CaO,水泥主要成分是CaAl2O4和Ca12Al14O33。之前研究認為Ca12Al14O33是一種良好的能延緩CaO晶粒之間發生燒結的原子骨架物,在800~1 000 ℃,鈣和鋁的混合氧化物會生成穩定的Ca12Al14O33。
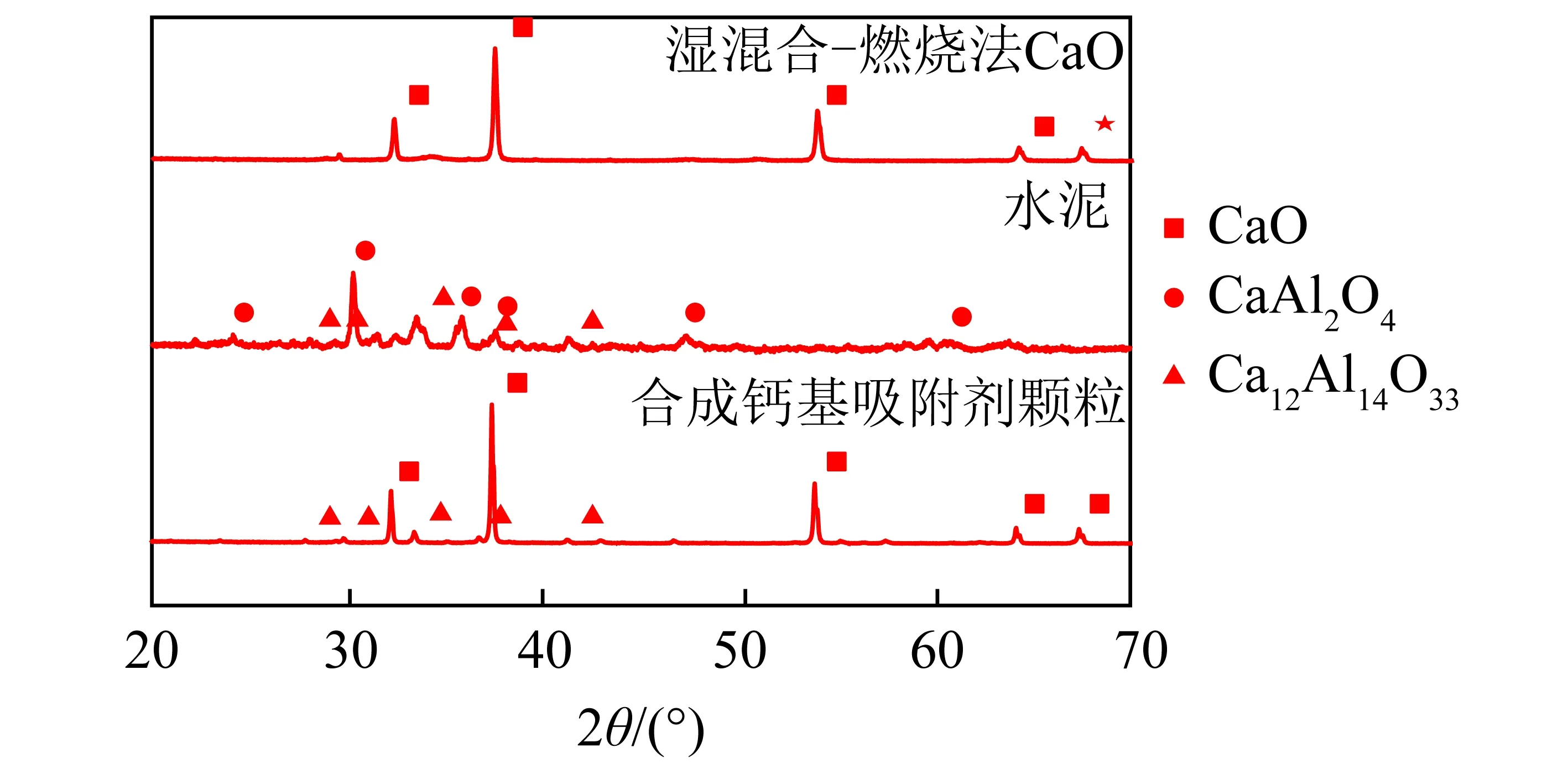
圖1 原料與制備樣本煅燒后的XRD圖[22]
本文煅燒溫度為900 ℃,由圖1可知,合成鈣基吸附劑顆粒的主要組分是CaO和Ca12Al14O33,說明水泥中大部分CaAl2O4和CaO發生反應,生成了Ca12Al14O33,研究結果與之前研究一致,具體反應為

(2)
合成鈣基吸附劑顆粒與普通天然石灰石的初次碳酸化反應動力學特征如圖2所示,可知2種吸附劑在初始化學反應控制階段的反應速率較快,且大部分反應均在化學反應控制階段完成。特別是合成鈣基吸附劑顆粒,不僅反應速率高于石灰石,還在化學反應控制階段完成了絕大部分的碳酸化反應,占整個碳酸化過程的90%,產物層擴散反應階段的碳酸化程度約為10%。說明合成鈣基吸附劑顆粒的反應活性很高。

圖2 2種吸附劑初次碳酸化反應動力學特征[22]
2種吸附劑第20次碳酸化反應動力學特征如圖3所示,可知其碳酸化速率相比初次碳酸化反應發生明顯變化。2種吸附劑的碳酸化反應過程仍包含化學反應控制階段和產物層擴散控制階段,但合成吸附劑顆粒在化學反應控制階段結束時達到的碳酸化程度是石灰石的3倍,且合成吸附劑顆粒在產物層擴散控制反應階段仍可進行一定程度的碳酸化反應。

圖3 2種吸附劑第20次碳酸化反應動力學特征[22]
相比之下,天然石灰石在化學反應控制階段的反應速率和碳酸化轉化率均較低,且在產物層擴散控制階段的反應程度很低,質量變化曲線幾乎與橫坐標軸平行,這說明石灰石吸附劑內部的燒結與結塊嚴重,阻礙了其產物層擴散反應過程。
2種吸附劑的碳酸化-煅燒循環反應性能如圖4所示,可知合成鈣基吸附劑顆粒的循環CO2捕捉能力相對于天然石灰石有巨大優勢,在500次循環反應后,相同單位質量新型鈣基吸附劑的CO2吸附能力是石灰石吸附劑的10倍,吸附劑在一次循環中分別能夠吸附CO20.171 g/g和0.016 g/g。石灰石吸附劑在多次碳酸化和煅燒反應后,孔隙結構發生明顯變化,其CO2吸附性能已經幾乎為0,原因是吸附劑內的介孔大幅減少,吸附劑的碳酸化反應取決于介孔的容積大小。合成鈣基吸附劑顆粒在多次循環反應后,維持了較好的碳酸化反應活性,而石灰石吸附劑在多次循環后幾乎喪失了碳酸化反應活性。無論是石灰石吸附劑還是合成鈣基吸附劑顆粒,其CO2捕集能力下降幅度最大的區間是0~100次循環,而在100次循環反應之后,其CO2捕集能力相對穩定。吸附劑的燒結被認為是造成鈣基吸附劑活性下降的根本原因[2],但當吸附劑在高溫條件下經歷了較長時間反應后,其吸附劑的內部形成了相對穩定的硬骨架,可以抵御吸附劑的進一步燒結[17],所以2種吸附劑在100次循環后,其CO2捕集能力保持穩定。

圖4 2種吸附劑的碳酸化-煅燒循環反應性能
Laursen等[18]提出鈣基吸附劑的硫酸化反應可分為3種類型:均勻硫酸化、內通硫酸化和核殼硫酸化。對于均勻硫酸化類型的吸附劑,其硫酸化反應速率不隨粒徑的變化而變化,而另外2種類型硫酸化的主要特點是,硫酸化反應速率受吸附劑顆粒影響比較明顯。為了判定本文2種鈣基吸附劑的硫酸化反應類型,選取了不同粒徑的2種鈣基吸附劑進行硫酸化反應動力學測試,如圖5所示。可知合成鈣基吸附劑顆粒的硫酸化反應速率不受顆粒粒徑的影響,說明新型鈣基吸附劑的硫酸化反應類型是均勻硫酸化類型。對于石灰石吸附劑,其硫酸化反應速率受顆粒粒徑影響不大,只在400~600 μm較大粒徑下,其硫酸化反應速率略下降,總體來說,本文所選石灰石仍屬于均勻硫酸化類型的吸附劑。合成鈣基吸附劑顆粒的硫酸化反應速率大于石灰石吸附劑,這是由于新型吸附劑具有較高的反應活性。

圖5 2種新鮮吸附劑的硫酸化反應速率
2.2 多次鈣循環后吸附劑的SO2吸附特性
石灰石吸附劑在經歷過0、100和500次CO2吸附/再生反應后硫酸化轉化率與時間的關系如圖6所示,可知石灰石的硫酸化反應速率隨著其經歷過CO2吸附/再生反應循環次數的增加而增加,與之前研究一致[19],這是由于石灰石吸附劑在多次碳酸化和煅燒反應中,介孔大幅減少,大孔增加所致。介孔有利于碳酸化反應,大孔有利于硫酸化反應[20]。
合成鈣基吸附劑顆粒在0、100和500次CO2吸附/再生反應后硫酸化轉化率與時間的關系如圖7所示,結果與石灰石吸附劑的曲線略有不同。

圖6 石灰石(經歷多次碳酸化反應后)的硫酸化反應速率
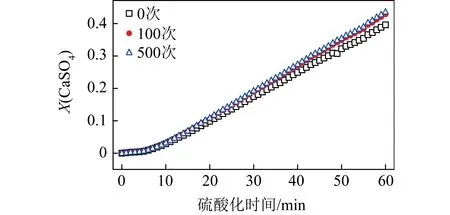
圖7 合成吸附劑顆粒(經歷多次碳酸化反應后)的硫酸化反應速率
雖然合成鈣基吸附劑顆粒的硫酸化速率高于石灰石吸附劑,但其經歷過多次CO2吸附/再生反應后的硫酸化反應速率提升幅度并不明顯,特別是經歷了100次和500次CO2吸附/再生反應后的硫酸化曲線趨于一致。這與合成鈣基吸附劑本身的物理特性相關,之前研究發現,合成鈣基吸附劑顆粒在多次碳酸化/煅燒循環反應中,其微觀結構保持相對穩定[9]。在高溫循環反應中仍穩定的微觀結構使得新型吸附劑不會和石灰石一樣不斷形成大孔豐富的微觀結構,從而使合成鈣基吸附劑顆粒在經歷多次CO2吸附/再生反應后,硫酸化反應性能提升幅度不大。
2.3 吸附劑的硫酸化反應動力學
為了進一步理解2種鈣基吸附劑的硫酸化反應動力學特性,本文采用了Szekeley和Evans[21]提出的微粒模型對新鮮吸附劑和經歷了多次CO2吸附/再生反應后吸附劑的硫酸化反應進行了反應動力學特性研究。該模型認為多孔顆粒是由一定形狀的微粒組成,是一群微粒集合體。由于本文所用2種吸附劑的硫酸化類型都是均勻型,硫酸化速率不受吸附劑粒徑大小影響,所以能采用微粒模型模擬其硫酸化反應過程。
根據微粒模型,吸附劑在化學反應控制階段轉化率為
(3)
其中,r為吸附劑的本征反應速率;t為反應時間;X為吸附劑的轉化率,將式(3)積分得
1-(1-X)1/3=rt。
(4)
由式(4)可知,1-(1-X)1/3與反應時間的函數可求出鈣基吸附劑本征反應速率。2種吸附劑的1-(1-X)1/3與反應時間的函數關系如圖8所示。發現2種吸附劑在化學反應控制階段的微粒模型曲線均是線性的,擬合直線的斜率是吸附劑的本征表面反應速率r。
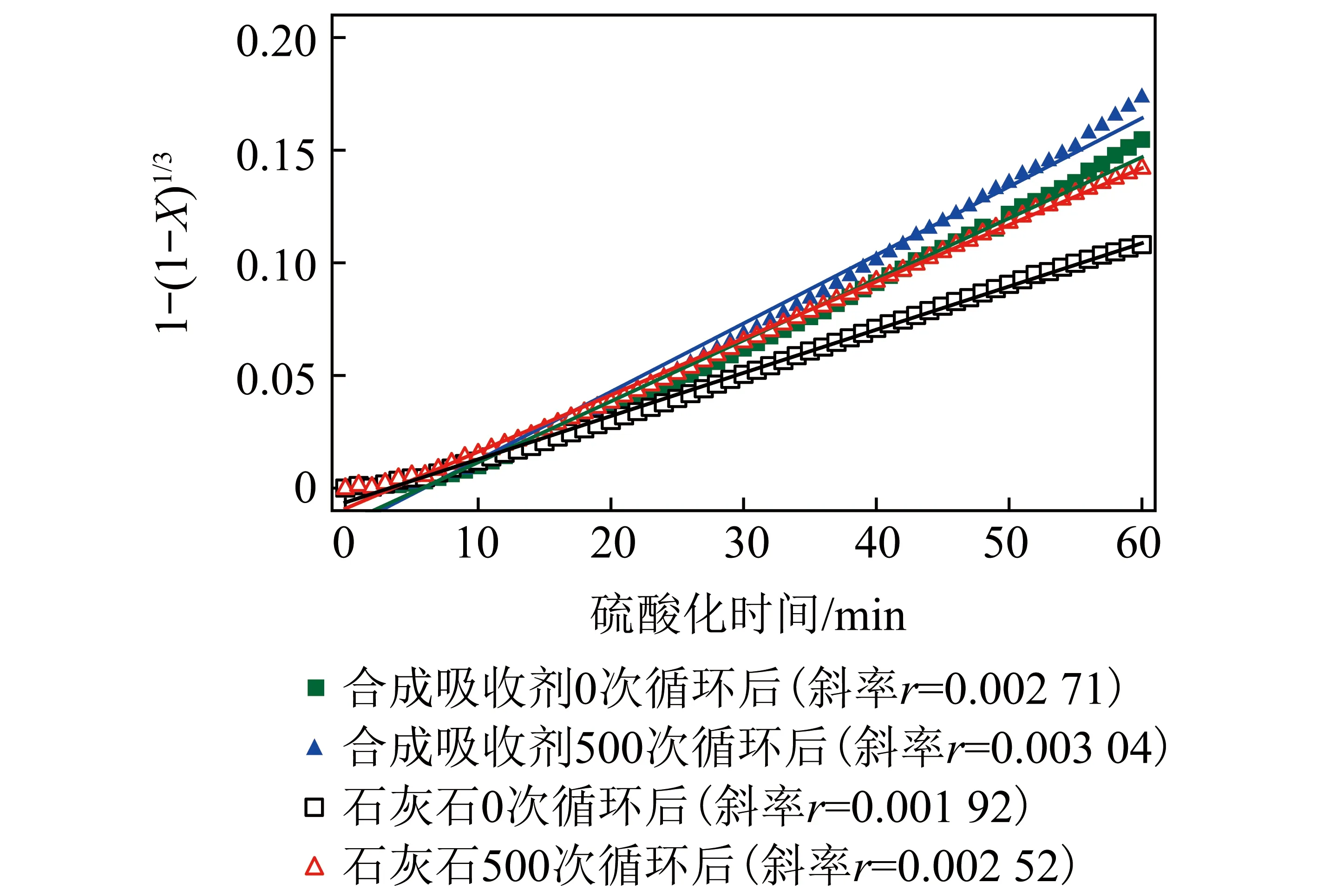
圖8 2種吸附劑的微粒模型反應速率曲線
吸附劑的本征表面反應速率基本不變,其初始狀態下的本征表面反應速率r0可代表其本征表面反應速率,即
r0=r。
(5)
氣固反應速率R為
(6)
式(6)可表示為能量守恒形式
(7)
其中,ks為本征反應速率常數,mol/(m2·min·Pan);n′為CaO-SO2反應的級數;P(SO2)為系統的SO2分壓,Pa;Peq(SO2)為CaO-SO2反應的平衡SO2分壓,Pa,由于850 ℃,Peq(SO2)小于1.01 Pa,所以可忽略不計。
式(3)和式(7)可以推出
R=3r(1-X)-1/3=M(CaO)ksP(SO2)n′S,
(8)
其中,S為吸附劑的表面積,m2/g,對于吸附劑的初始狀態t=0時,表面積為S0(由試驗結果顯示煅燒后石灰石和合成吸附劑顆粒的表面積分別12、15 m2/g),代入式(8)得
(9)
將式(9)進行對數變換后,可得
lnr0=n′lnP(SO2)+ln(M(CaO)ksS0/3)。
(10)
從lnr0與lnP(SO2)的斜率可以求出吸附劑硫酸化反應與SO2分壓相關的反應級數。
常壓下,硫酸化溫度為850 ℃時,不同SO2體積濃度(0.1%、0.2%、0.3%、0.4%)對2種吸附劑的lnr0與lnP(SO2)的關系如圖9所示。可知2種吸附劑的CaO-SO2反應級數為1.03~1.09。

圖9 2種吸附劑的微粒模型CaO-SO2反應級數曲線
由于2種吸附劑的反應級數接近一級反應,可以近似認為n′=1。本征反應速率常數可表示為
(11)
其中,k0為吸附劑反應速率的指前因子,mol/(m2·s);E為鈣基吸附劑的活化能,J/mol;Rt為氣體常數,8.314 J/(mol·K);T為溫度,K。代入式(11)得
(12)
式(12)為Arrhenius方程,根據lnr0與T-1的函數圖可以擬合出鈣基吸附劑的活化能與反應速率的指前因子。SO2體積分數為0.2%時,在不同硫酸化溫度條件下(750、800、850、900 ℃),2種鈣基吸附劑的lnr0與T-1的函數關系如圖10所示。

圖10 2種吸附劑的微粒模型CaO-SO2反應Arrhenius曲線
根據圖10擬合曲線的斜率可以分別求得2種鈣基吸附劑的活化能。對于合成鈣基吸附劑顆粒在初始狀態下和經歷了500次CO2捕集反應后的活化能分別為43和41 kJ/mol;而石灰石吸附劑在初始狀態下和經歷了500次CO2捕集反應后的活化能分別為64和47 kJ/mol。石灰石吸附劑在多次碳酸化/煅燒循環后的硫酸化反應活化能的下降幅度明顯大于合成鈣基吸附劑顆粒。說明多次碳酸化/煅燒循環反應對石灰石吸附劑的硫酸化反應活性的影響明顯,而對合成鈣基吸附劑顆粒的硫酸化反應影響較小。合成鈣基吸附劑顆粒在多次CO2捕集利用后,其SO2吸附性能仍較強。
3 結 論
1)100次循環碳酸化-煅燒反應后,高性能合成鈣基吸附劑的CO2吸附能力是石灰石的10倍以上;但高性能合成鈣基吸附劑的SO2吸附能力是石灰石的1.4倍。
2)2種吸附劑都屬于均勻硫酸化類型的吸附劑,其硫酸化反應速率不受吸附劑粒徑大小的影響。但經歷多次碳酸化/煅燒反應后,其硫酸化反應性能的提升幅度不同。石灰石吸附劑的硫酸化轉化率從26%提升到35%,高性能合成鈣基吸附劑的硫酸化轉化率從38%提升到43%。
3)2種吸附劑的硫酸化過程均是與SO2濃度相關的一級反應,多循環捕集CO2反應后,石灰石吸附劑的硫酸化反應活化能下降幅度接近30%,而高性能合成鈣基吸附劑的硫酸化反應活化能只下降了5%。說明2種鈣基吸附劑進行了多次捕集CO2反應后,均能較好地應用于SO2的脫除。

