白花鬼針草中多烯炔類成分的分離及其生物活性研究
謝金丹, 陳仲康, 謝富達, 胡娟娟, 梁慧君, 李倩然, 袁捷*
白花鬼針草中多烯炔類成分的分離及其生物活性研究
謝金丹a, 陳仲康b, 謝富達c,d, 胡娟娟a, 梁慧君a, 李倩然a, 袁捷a*
(廣州中醫藥大學, a. 中醫藥數理工程研究院; b. 中藥學院; c. 基礎醫學院; d. 基礎醫學院中西醫結合研究中心,廣州 510006)
為了解白花鬼針草(var.)的化學成分,采用多種色譜技術從其提取物中分離多烯炔類成分,并對其生物活性進行研究。結果表明,從白花鬼針草乙酸乙酯提取部位中分離鑒定出4個多烯炔類化合物,分別為5-acetoxy-2-phenyl- ethinyl-thiophene (1)、1-phenylhepta-1,3,5-triyne (2)、5-phenyl-2-(1-propynyl)-thiophene (3)和icthyothereol acetate (4)。體外活性評價結果表明,化合物1~4均具有中等抗MRSA活性,且均對人肝LO2細胞無毒性。首次為化合物1提供核磁數據并進行結構解析,化合物3、4為首次從該屬植物中分離得到。
白花鬼針草;多烯炔;MASA;肝細胞毒性
菊科(Compositae)鬼針草屬()植物約有230種,廣泛分布于全球熱帶及溫帶地區,尤以美洲的種類最為豐富。我國有9種2變種,遍布全國各地,已有數種可供藥用,為民間常用草藥[1]。目前從鬼針草()、柳葉鬼針草()、狼杷草()、婆婆針()和小花鬼針草()中共分離得到300多個單體化合物,主要包括黃酮類、多烯炔類、苯丙素類、萜類成分,此外還有揮發油類、氨基酸、無機鹽等[2–3],但關于該屬植物白花鬼針草的藥效物質基礎和藥效學研究則相對較少。
白花鬼針草(var.)主要分布于亞洲和美洲的熱帶和亞熱帶地區,亦產于我國華東、華中、華南、西南各省區,生于村旁、路邊及荒地中[4]。在我國,白花鬼針草常用于治療上呼吸道感染、急性黃疸型肝炎、胃腸炎等疾病[4]。研究表明,鬼針草屬植物中特征性的多烯炔類成分具有結構類型多樣、含量高、藥理作用顯著等特點, 尤其在抗炎、抗腫瘤、抗瘧疾、降血糖、殺蟲等方面具有良好活性[5–7]。本研究對白花鬼針草的特征性成分多烯炔與其生物活性進行研究,采用多種色譜技術分離鑒定多烯炔類成分,并對其進行體外抗MRSA活性以及肝細胞毒性評價。
1 材料和方法
1.1 儀器、試劑及耗材
核磁共振譜:Bruker Avance III 400 MHz核磁共振儀,(ppm),以氘代試劑殘留溶劑峰為內標; 液相色譜與質譜聯用儀:Waters 2695 LC偶聯Waters Acquity ELSD、Waters 3100 SQDMS,分析色譜柱型號: Waters Sunfire?RP C-18,3.5m, 4.6 mm×100 mm;質譜:Waters 3100 SQDMS (低分辨ESI);CO2細胞培養箱(上海力申科學儀器有限公司);垂直超凈工作臺(上海智城分析儀器制造有限公司);S1010低速離心機(美國賽洛捷公司);FM-500型倒置熒光生物顯微鏡(上海普丹光學儀器有限公司);TU-1901雙光束紫外可見分光光度計(北京普析通用儀器有限公司);MK3型酶標儀(美國Thermo Fisher公司); 超低溫冰箱(日本三洋SANYO公司)。
MTT噻唑蘭(美國Sigma公司);柱層析硅膠: 200~300和300~400目硅膠均為青島海洋化工廠生產;TLC預制薄層板:HSGF254為德國Merck公司生產;葡聚糖凝膠Sephadex LH-20:Pharmacia Bio- tech AB、Uppsala、Sweden;胎牛血清(FBS) (澳大利亞Gibco公司);青霉素-鏈霉素(P/S) (Thermo公司);RPMI-1640培養基(德國Biological Industries公司); DMEM培養基(美國Gibco公司);96孔細胞培養板(美國CORNING公司);DMSO溶液(美國Sigma公司); HPLC分析用乙腈(Merck公司); 實驗用水由美國Milli- pore公司純水、超純水系統提供;其他有機溶劑均為國產分析純產品;TLC顯色劑為5%香蘭素乙醇液。
1.2 材料
白花鬼針草(var.)于2018年10月采集自廣東省廣州市,標本號No. 20181001, 存放于廣州中醫藥大學中醫藥數理工程研究院。
1.3 細胞株
肝細胞株 人肝LO2細胞;購自中國科學院上海生命科學研究院細胞資源中心。
細菌細胞株 大腸桿菌(,ATCC8739)、蠟樣芽孢桿菌(CMCC 44102)、金黃色葡萄球菌(CMCC26003)、耐甲氧西林金黃色葡萄球菌(Methicillin-resistant, MASA JCSC 4474);購自廣東省微生物研究所微生物菌種保藏中心。
1.4 多炔類化學成分的提取分離
將白花鬼針草的干燥地上部分(8.0 kg)剪成2 cm小段,在室溫下用10倍體積的95%乙醇浸泡3次,每次5 d。將浸泡液減壓濃縮,得浸膏747.1 g, 將得到的總浸膏用水懸浮,然后用乙酸乙酯萃取, 減壓濃縮萃取液,得到水部位(579.9 g)和乙酸乙酯部位(167.2 g)。將乙酸乙酯部位用硅膠柱層析(200~300目)處理,以石油醚-乙酸乙酯(100∶1~2∶1,/) 進行梯度洗脫,同時通過TLC薄層色譜分析進行合并,最終得到12個子組分A1~A12。A1組分經硅膠柱層析(300~400目)處理,用石油醚-乙酸乙酯(100∶1~2∶1,/)洗脫,得到化合物2 (5.73 g)。A2組分先進行凝膠柱層析處理,甲醇洗脫,再經硅膠柱層析(300~400目)處理,用石油醚-乙酸乙酯(100∶1~ 10∶1,/)洗脫,得到化合物3 (30.9 mg)。A5組分先經凝膠柱層析處理,甲醇洗脫,再通過制備型高效液相色譜分離,用乙腈-水(70%~90%,/)洗脫,得到化合物1 (208.8 mg)。A7組分先通過凝膠柱層析處理,甲醇洗脫,再用硅膠柱層析(300~400目)處理,石油醚-乙酸乙酯(100∶1~10∶1,/)洗脫, 得到化合物4 (1.88 g)。
1.5 結構鑒定
化合物1 黃色油狀物。ESIMS中顯示準分子離子峰257.27 [M + H]+,結合13C NMR數據確定其分子式為C15H12O2S,不飽和度為10。化合物1的13C NMR譜中給出15個碳信號(表1),其中包括:1個伯碳、1個仲碳(為連氧仲碳)、7個叔碳以及6個季碳(其中包括1個酯羰基碳)。此外,由13C NMR譜可推導出10個烯烴碳信號和2個炔烴碳信號(C82.4, 93.6)。因此化合物1為多烯炔類成分。1H NMR圖譜中,顯示2組特征性信號H7.50 (2H, m)和7.36 (3H, m)(表1),該信號在1H-1H COSY圖譜中相關,因此該2組信號應為苯環信號,提示化合物1結構中含有苯環結構單元。可知,化合物1中共含有10個烯烴碳信號,扣除苯環烯烴碳還剩余4個,共占2個不飽和度。而由化合物分子式推知,化合物的不飽和度為10,扣除1個羰基、1個苯環、1個炔基以及4個烯烴碳,還剩1個不飽和度,故該化合物應該含有1個環結構。在1H-1H COSY圖譜中,可觀察到H-3與H-4相關,且結合它們較小的耦合常數以及分子式中存在的硫原子,可推導該兩個烯烴鍵與硫原子形成噻吩環。苯環、炔基、噻吩環和乙酰基結構片段的連接位置可由HMBC圖譜推導, ①C-2′′與H-4′′/H-8′′相關,可推導炔基通過C-3′′?C-2′′與苯環相連;②C-1′′與H-3相關,可推導炔基通過C-1′′?C-2與噻吩環相連;③C-1′與H-4相關,可推導噻吩環通過C-5?C-1′與乙酰基相連。因此,化合物1鑒定為5-acetoxy-2-phenyl- ethinyl-thiophene[8],這是首次提供其核磁數據并進行結構解析(圖1)。
化合物2 黃棕色固體,1H NMR (400 MHz, CDCl3):H7.50 (2H, m, H-2/H-6), 7.37 (1H, t,= 7.3 Hz, H-4), 7.31 (2H, t,= 7.2 Hz, H-3/H-5), 2.00 (3H, s, H-7)。13C NMR (100 MHz, CDCl3):C4.73 (C- 7), 58.99(C-3), 64.93 (C-5), 67.45 (C-4), 74.64 (C-2), 75.23 (C-6), 78.31 (C-1), 121.14 (C-1), 128.48 (C-3/C- 5), 129.53 (C-4), 132.98 (C-2/C-6)。化合物2的1H、13C NMR數據與1-phenylhepta-1,3,5-triyne[9]的一致。
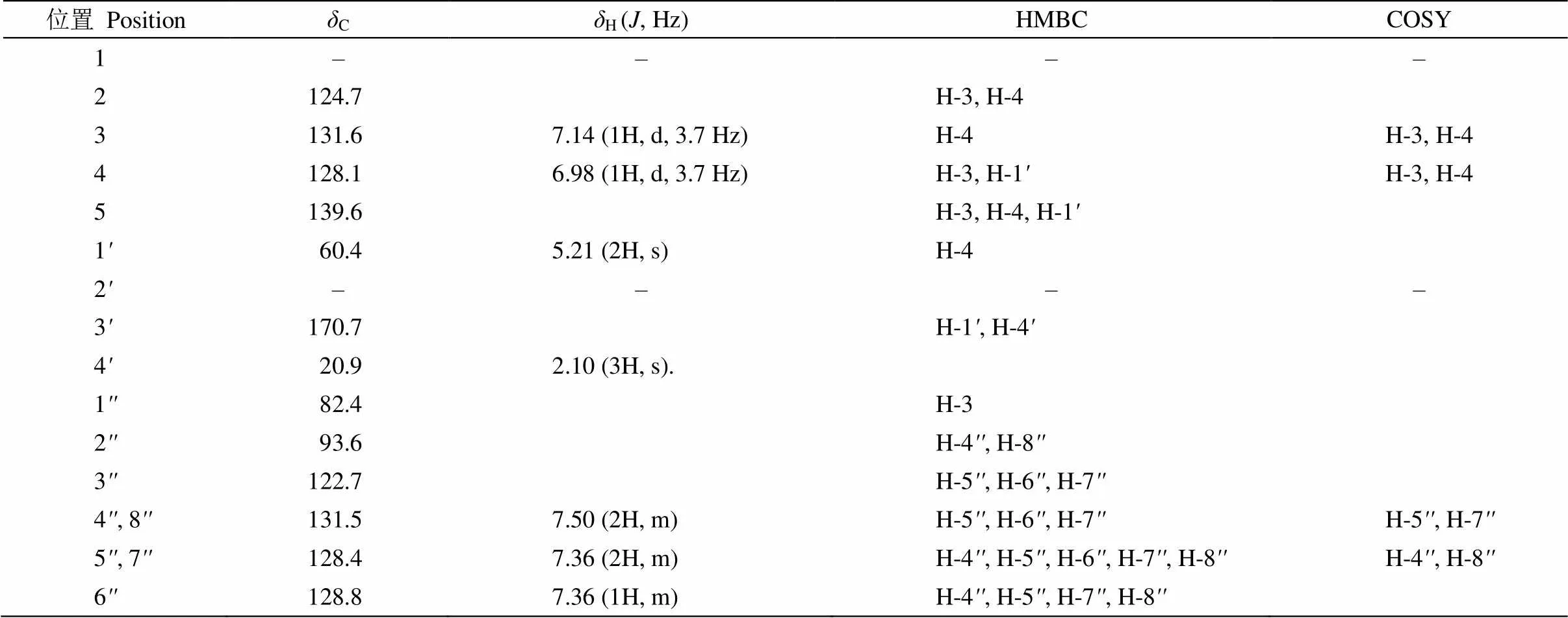
表1 化合物1的氫譜和碳譜數據
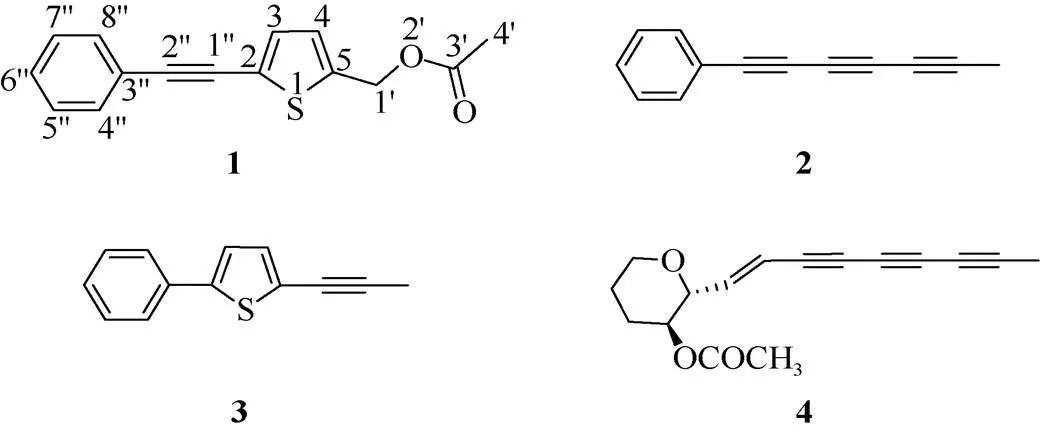
圖1 多烯炔化合物的化學結構式
化合物3 淡黃色油狀物,1H NMR (400 MHz, CDCl3):H7.55 (2H, m, H-2/H-6), 7.36 (2H, m, H-3/ H-5), 7.29 (1H, m, H-4), 7.14 (1H, d,= 3.8 Hz, H-3), 7.07 (1H, d,= 3.8 Hz, H-4), 2.10 (3H, s, H-3)。13C NMR (100 MHz, CDCl3):C4.75 (C-3), 73.13 (C-1), 90.82 (C-2), 122.74 (C-3), 123.41 (C-5), 125.80 (C-2/ C-6), 127.76 (C-4), 128.93 (C-3/C-5), 132.10 (C- 4), 133.89 (C-1), 144.40 (C-2)。以上數據與5-phenyl- 2-(1-propynyl)-thiophene[9]的一致。
化合物4 黃色油狀物,1H NMR (400 MHz, CDCl3):H6.31 (1H, dd,= 16.0, 5.4 Hz, H-1), 5.79 (1H, d,= 16.0 Hz, H-2), 4.49 (1H, m, H-2), 3.96 (1H, m, H-5), 3.78 (1H, ddd,= 9.3, 5.4, 1.4 Hz, H-1), 3.41 (1H, m, H-5), 2.20 (1H, m, H-3), 2.05 (3H, s, H- 3), 1.99 (3H, s, H-9), 1.70 (2H, m, H-4), 1.48 (1H, dd,= 11.0, 5.2 Hz, H-3)。13C NMR (100 MHz, CDCl3):C4.68 (C-9), 21.11 (C-3), 24.74 (C-4), 29.26 (C-3), 58.90 (C-5), 64.87 (C-7), 67.38 (C-6), 67.50 (C-5), 71.47 (C-2), 73.46 (C-3), 75.62 (C-4), 78.30 (C-8), 78.74 (C-1), 110.23 (C-2), 144.40 (C-1), 169.93 (C- 2)。以上數據與icthyothereol acetate[10]的一致。
1.6 生物活性篩選
1.6.1 體外抗MRSA(耐甲氧西林金黃色葡萄球菌)活性篩選
采用梯度稀釋技術[11],測定化合物的最低抑菌濃度(MIC)。首先將指示劑溶液(100g/mL的刃天青水溶液)與待測菌溶液(1.25×106CFU/mL)按3∶2的比例混勻,即得混合菌液,并向第一列的所有測試孔中各加入200L混合菌液,向第二至第八列的所有測試孔中各加入100L混合菌液。然后,將含待測樣品的DMSO溶液2L分別加入到第一列的各個板孔中,均勻混合后取出100L的溶液轉移到第二列相應的板孔中,并依次稀釋到第8列。最后,將孔板放入到恒溫培養箱,37℃培養12 h。觀察孔板中菌液的顏色,菌液變成紅色為無抑菌活性,維持藍色為有抑菌活性,菌液維持藍色的最低給藥濃度被認為是待測化合物的最低抑菌濃度。陽性對照為萬古霉素,每個樣品做2組并重復測定3次。
1.6.2 體外人肝細胞毒性評價
采用MTT法[12],測定化合物對人肝LO2細胞的毒性。收集對數生長期的人肝LO2細胞,加入含有10% FBS和1%青霉素-鏈霉素的DMEM培養基制成細胞懸液,以1×105CFU/mL的濃度接種于96孔板,每孔100L,于37℃、5% CO2培養箱中培養,待細胞貼壁后,設置給藥孔、陰性對照孔(DMSO溶劑)、調零孔(培養基),給藥孔分別加入濃度為100、50、25、12.5、6.25、3.12g/mL的待測藥液,設置6個復孔。置于37℃、5% CO2培養箱中分別培養24 h。每孔加入20L新鮮配制的5 mg/mL的MTT溶液,繼續培養4 h,輕輕吸棄孔內液體,停止培養。每孔加入150L的DMSO,于水平搖床混勻10 min,后置于酶標儀490 nm波長處測定各孔的吸光值,計算細胞的存活率。
2 結果和討論
多烯炔類成分結構新穎獨特,其生物活性的開發逐漸引起國內外研究學者的關注。有研究報道化合物2~4具有抗真菌、殺蟲、抗瘧等藥理作用[9–10,13–14]。
耐甲氧西林金黃色葡萄球菌(MRSA),被稱為“超級細菌”,已成為全球院內感染的首要致病菌, 其對青霉素、頭孢克洛等絕大部分臨床常用抗生素表現出耐藥性[15–16]。因此,尋找能抑制MRSA的新型抗生素迫在眉捷。本研究評價了多炔類化合物1~ 4對革蘭氏陰性菌(大腸桿菌ATCC8739)、革蘭氏陽性菌(金黃色葡萄球菌CMCC26003,蠟樣芽孢桿菌CMCC44102)、耐甲氧西林金黃色葡萄球菌(MRSA JCSC4474)的抑制活性。結果表明(表2), 化合物1~4對MRSA JCSC 4474表現出中等抑制活性, 化合物1、2、4的抑菌MIC值為50g/mL, 化合物3的為25g/mL。
近十年來,已上市的部分藥物有潛在的肝毒性,或與其他藥物相互作用所致的肝毒性陸續報道,而藥物性肝毒往往在臨床實踐中具有很高的發病率和死亡率[17–18]。評價多烯炔類化合物的肝細胞毒性, 對此類化合物的開發和利用具有科學指導作用。因此,本研究采用MTT法測定人肝LO2細胞的存活率,結果表明,化合物1~4不具有肝細胞毒性作用。
本研究分離鑒定了白花鬼針草植物中的4個多烯炔類成分:5-acetoxy-2-phenylethinyl-thiophene (1)、1-phenylhepta-1,3,5-triyne (2)、5-phenyl-2-(1-propynyl)- thiophene (3)和icthyothereol acetate (4)。首次為化合物1提供核磁數據并進行結構解析,化合物3和4為首次從該屬植物中分離得到。同時,本研究評價了所獲化合物的抗MRSA活性和肝細胞毒性。本研究所獲得的多烯炔類化合物具有一定抗MRSA作用,為白花鬼針草的民間抗感染應用提供了科學依據;此外,化合物1~4不具有肝細胞毒性作用,具有抗MRSA活性多烯炔類成分的發現,將為新型抗菌藥物的開發提供物質基礎與科學依據。
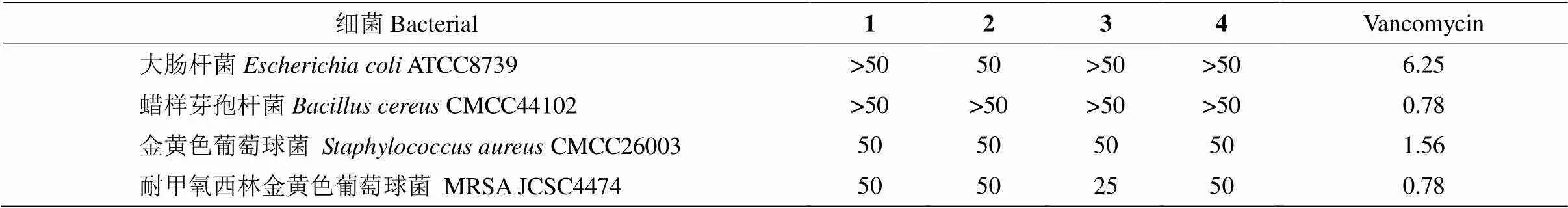
表2 化合物1~4的體外抑菌活性[MIC (μg/mL)]
[1] Deletis Florae Reipublicae Popularis Sinicae, Agendae Academiae Sinicae Edita. Florae Reipublicae Popularis Sinicae, Tomus 75 [M]. Beijing: Science Press, 1979: 369. 中國科學院中國植物志編輯委員會. 中國植物志, 第75卷 [M]. 北京: 科學出版社, 1979: 369.
[2] ZENG X Y, ZHANG T, PAN W S, et al. Research progress of chemical constituents of[J]. J Chin Med Mat, 2017, 40(3): 748–753. doi: 10.13863/j.issn1001-4454.2017.03.056. 曾曉燕, 張婷, 潘衛松, 等. 鬼針草屬藥用植物化學成分研究進展 [J]. 中藥材, 2017, 40(3): 748–753. doi: 10.13863/j.issn1001-4454.2017.03.056.
[3] Silva F L, Fischer D C H, Tavares J F, et al. Compilation of secondary metabolites fromL. [J]. Molecules, 2011, 16 (2): 1070–1102. doi: 10.3390/molecules16021070.
[4] Deletis Florae Reipublicae Popularis Sinicae, Agendae Academiae Sinicae Edita. Florae Reipublicae Popularis Sinicae, Tomus 75 [M]. Beijing: Science Press, 1979: 378. 中國科學院中國植物志編輯委員會. 中國植物志, 第75卷 [M]. 北京: 科學出版社, 1979: 378.
[5] WANG R, TONG L, LIU C Y, et al. Research progress of polyace- tylenes fromgenus plants and their biological activity [J]. Chin Trad Herb Drugs, 2018, 49(17): 4189–4196. doi: 10.7501/j.issn.0253- 2670.2018.17.034.王瑞, 童玲, 劉彩云, 等. 鬼針草屬植物中多烯炔類成分及其活性研究進展[J]. 中草藥, 2018, 49(17): 4189–4196. doi: 10.7501/j.issn. 0253-2670.2018.17.034.
[6] CHEN Y M, PENG S Y, LUO Q Z, et al. Chemical and pharma- cological progress on polyacetylenes isolated from the family Apiaceae [J]. Chem Biodiv, 2015, 12(4): 474–502. doi: 10.1002/cbdv.20130 0396.
[7] WAN S Q, XU H H, ZHAO S H, et al. Study on bioactivity of polyac- etylene compounds to[J]. J S China Agric Univ, 2007, 28 (2): 56–60. doi: 10.3969/j.issn.1001-411X.2007.02.014.萬樹青, 徐漢虹, 趙善歡, 等. 多炔類化合物對菜粉蝶的生物活性研究[J]. 華南農業大學學報, 2007, 28(2): 56–60. doi: 10.3969/j. issn.1001-411X.2007.02.014.
[8] MARCHANT Y Y, GANDERS F R, WAT C K, et al. Polyacetylenes in Hawaiian[J]. Biochem Syst Ecol, 1984, 12(2): 167–178. doi: 10.1016/0305-1978(84)90030-9.
[9] KIMURA Y, HIRAOKA K, KAWANO T, et al. Nematicidal activities of acetylene compounds fromL. [J]. Z Naturforsch C, 2008, 63(11/12): 843–847. doi:10.1515/znc-2008-11-1210.
[10] RAGASA C Y, CO A L K C, RIDEOUT J A. Antifungal metabolites from[J]. Nat Prod Res, 2005, 19(3): 231–237. doi:10.1080/14786410410001709773.
[11] WU J W, LI B L, XIAO W J, et al. Longistylin A, a natural stilbene isolated from the leaves of, exhibits significant anti- MRSA activity [J]. Int J Antimicrob Agents, 2020, 55(1): 105821. doi: 10.1016/j.ijantimicag.2019.10.002.
[12]MOSMANN T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays [J]. J Immunol Methods, 1983, 65(1/2): 55–63. doi: 10.1016/0022-1759(83)90303-4.
[13] ALVAREZ L, MARQUINA S, VILLARREAL M L, et al. Bioactive polyacetylenes from[J]. Planta Med, 1996, 62(4): 355– 357. doi: 10.1055/s-2006-957902.
[14] TOBINAGA S, SHARMA M K, AALBERSBERG W G L, et al. Isolation and identification of a potent antimalarial and antibacterial polyacetylene from[J]. Planta Med, 2009, 75(6): 624– 628. doi: 10.1055/s-0029-1185377.
[15] XIAO Y H, WANG J, LI Y. Bacterial resistance surveillance in China: A report from Mohnarin 2004-2005 [J]. Eur J Clin Microbiol Infect Dis, 2008, 27(8): 697–708. doi: 10.1007/s10096-008-0494-6.
[16] ARêDE P, MILHEIRICO C, DE LENCASTRE H, et al. The anti- repressor MecR2 promotes the proteolysis of theA repressor and enables optimal expression of-lactam resistance in MRSA [J]. PLoS Pathog, 2012, 8(7): e1002816. doi: 10.1371/journal.ppat.1002816.
[17] BUNCHORNTAVAKUL C, REDDY K R. Drug hepatotoxicity: Newer agents [J]. Clin Liver Dis, 2017, 21(1): 115–134. doi: 10.1016/j.cld. 2016.08.009.
[18]PARVEZ M K, RISHI V. Herb-drug interactions and hepatotoxicity[J]. Curr Drug Metab, 2019, 20(4): 275–282. doi: 10.2174/138920022066 6190325141422.
Studies on Isolation of Polyacetylenes fromvar.and Their Biological Activities
XIE Jin-dana, CHEN Zhong-kangb, XIE Fu-dac,d, HU Juan-juana, LIANG Hui-juna, LI Qian-rana, YUAN Jiea*
(a. Mathematical Engineering Academy of Chinese Medicine; b. School of Pharmaceutical Sciences; c. Department of Biochemistry, School of Basic Medical Science; d. Research Center of Integrative Medicine, School of Basic Medical Science; Guangzhou University of Chinese Medicine, Guangzhou 510006, China)
In order to understand the chemical constituents ofvar.,the four polyacetylenes were isolated from ethyl acetate extract ofvar.by using multiple column chromatography, and their biological activities were studied. Four polyacetylenes were identified as 5-acetoxy-2-phenylethinyl- thiophene (1), 1-phenylhepta-1,3,5-triyne (2), 5-phenyl-2-(1-propynyl)-thiophene (3), and icthyothereol acetate (4).activity screening, all these compounds showed moderate anti-MRSA activity, and were not toxic to human liver LO2cells. The NMR spectroscopic data along with the detailed elucidation of compound 1 was firstly presented, besides, compounds 3 and 4 were isolated fromgenus for the first time.
var.; Polyacetylenes; MRSA; Hepatotoxicity
10.11926/jtsb.4312
2020–09–27
2020–10–17
國家自然科學基金項目(81903509)資助
This work was supported by the National Natural Science Foundation of China (Grant No. 81903509)
謝金丹,女,碩士研究生,研究方向:中藥新藥研發。E-mail: 2496749715@qq.com
. E-mail: yuanjie@gzucm.edu.cn

