雙水相萃取韭籽粕多糖的工藝優化及其抗氧化活性研究
尹國友,孫 婕,2,*,澹 博,王一萍,吳靜嫻,周文雅
(1.河南城建學院 生命科學與工程學院,河南 平頂山 467036;2.南昌大學 食品科學與技術國家重點實驗室,江西 南昌 330047)
韭菜籽是韭菜干燥成熟的種子,性溫、味微甜,具有溫補肝腎、壯陽固精等功效[1]。韭菜籽中包含核苷酸類、生物堿類、不飽和脂肪酸、多糖和多肽等多種有效化學成分[2]。其中,多糖作為主要的有效成分之一,具有改善免疫功能、抗氧化、調節生殖系統、抗疲勞等藥理作用[2-3]。目前常用水提醇沉、超聲輔助熱水浸提和雙水相萃取等方法提取多糖。
雙水相萃取技術作為一種新型的綠色分離、富集技術,具有簡單、省時、高效等特點,已被應用于生物活性物質的分離純化以及天然產物的提取等領域[4-5]。雙水相體系主要包括聚合物- 聚合物雙水相體系、聚合物- 鹽雙水相體系、離子液體- 鹽雙水相體系和小分子有機溶劑- 鹽雙水相體系。聚合物- 鹽雙水相體系,如聚乙二醇(PEG)-硫酸銨雙水相體系用鹽代替聚合物- 聚合物雙水相體系中的一種聚合物作為成相物質,在降低體系黏度和生產成本的同時,還具備聚合物生物相容性好的優點,可在工業規模化生產中進行應用,但少見在韭籽粕多糖中有應用。因此,本研究選擇PEG-硫酸銨雙水相體系提取韭籽粕多糖,采用響應面分析法優化工藝參數[6],并對提取的多糖進行抗氧化評價,以期為下一步韭籽粕多糖的分離純化、結構鑒定和構效研究提供理論數據。
1 材料與方法
1.1 材料與試劑
韭籽粕(含油率<1%),本課題組采用超臨界二氧化碳萃取法得到。PEG1000、PEG2000、PEG4000、PEG6000,國藥集團化學試劑有限公司;PEG8000,天津市大茂化學試劑廠;硫酸銨、苯酚、濃硫酸(純度96%~98%)等,洛陽市化學試劑廠。
1.2 儀器與設備
ME204E型電子天平,梅特勒- 托利多儀器有限公司;101- 1SA型電熱恒溫鼓風干燥箱,金壇市盛藍儀器制造有限公司;JW- 1042型低速離心機,安徽嘉文儀器裝備有限公司;KQ5200DE型超聲波清洗器,昆山市超聲儀器有限公司;UV- 1100型紫外可見分光光度計,上海美普達儀器有限公司。
1.3 實驗方法
1.3.1多糖含量測定
采用苯酚- 硫酸法測定多糖含量,制作標準曲線[7]。
1.3.2PEG-硫酸銨雙水相相圖繪制
分別精準稱取0.5 g PEG1000、PEG2000、PEG4000和PEG6000于錐形瓶中,加入1 mL雙蒸水,配制成質量分數為50%的PEG溶液,記錄PEG溶液的質量。向滴定管中加入質量分數為50%的硫酸銨溶液緩慢滴定PEG并振蕩,當錐形瓶中開始出現渾濁時停止滴定,記錄滴加鹽溶液的質量。再向混合物中加水,直至溶液再次變得澄清,記錄滴加的水的質量。繼續滴加硫酸銨溶液,直至再次出現渾濁,重復上述操作步驟數次,記錄每次質量。硫酸銨和PEG質量分數計算見式(1)、式(2);以渾濁時硫酸銨在系統中的質量分數為橫坐標,PEG的質量分數為縱坐標繪圖,即可得到雙節線[8]。
w(PEG)=m1/(m1+m2+m3)×100%;
(1)
w(硫酸銨)=m2/(m1+m2+m3)×100%。
(2)
式(1)、式(2)中,m1,PEG在系統中的總質量,g;m2,鹽溶液在系統中的總質量,g;m3,水在系統中的總量,g。
1.3.3韭籽粕多糖提取
稱取10 g韭籽粕加入150 mL去離子水,設定溫度60 ℃、功率80 W,提取2 h,冷卻后分裝于離心管中,4 000 r/min離心20 min,取上清液,置于冰箱中保存。從燒杯中準確移取1.00 mL溶液稀釋25倍,取1 mL稀釋液于試管中,然后依次在試管中加入1.0 mL蒸餾水、1.00 mL 質量分數5%苯酚溶液,搖勻后迅速加入5.00 mL濃硫酸,再次搖勻待其冷卻至室溫,以蒸餾水為空白組,測定吸光度。
1.3.4雙水相萃取
準確量取多糖溶液20 mL,稱取一定質量的PEG,溶解后稱取不同質量的硫酸銨,充分混合,在室溫條件下靜置30 min。上、下相溶液各取1 mL,加蒸餾水稀釋至10 mL,再取1 mL稀釋液于試管中,依次加入1 mL蒸餾水、1.0 mL 5%苯酚溶液、5.0 mL濃硫酸,搖勻,室溫靜置冷卻。以蒸餾水為空白對照,測定490 nm處吸光度,根據葡萄糖標準曲線計算多糖在上、下相中的含量。根據式(3)至式(5)計算雙水相體系的分配系數和多糖的萃取率。
K=ρa/ρb;
(3)
R=Va/Vb;
(4)
Y=1/(1+RK) 。
(5)
式(3)~式(5)中,K,多糖在PEG-硫酸銨兩相中的分配系數;R,上下相體積之比;Y,多糖在下相中的萃取率,%;ρa,上相中的多糖質量濃度,mg/mL;ρb,下相中的多糖質量濃度,mg/mL;Va,上相體積,mL;Vb,下相體積,mL。
1.3.5單因素實驗設計
選取PEG相對分子質量(1 000、2 000、4 000、6 000、8 000)、PEG質量分數(10%、15%、20%、25%、30%)、硫酸銨質量分數(15%、20%、25%、30%、35%)和萃取時間(20、30、40、50、60 min)4個因素進行實驗,考察單一因素改變對韭籽粕多糖萃取率的影響,平行重復5次,結果取平均值。
1.3.6響應面試驗設計
依據單因素實驗結果,使用Design Expert 8.0.6軟件進行結果分析。選定PEG的相對分子質量、PEG質量分數、硫酸銨質量分數作為響應面的3個因素變量[9],以韭籽粕多糖萃取率為響應值,設計響應面試驗,并對結果進行回歸分析和優化,各因素與水平見表1。
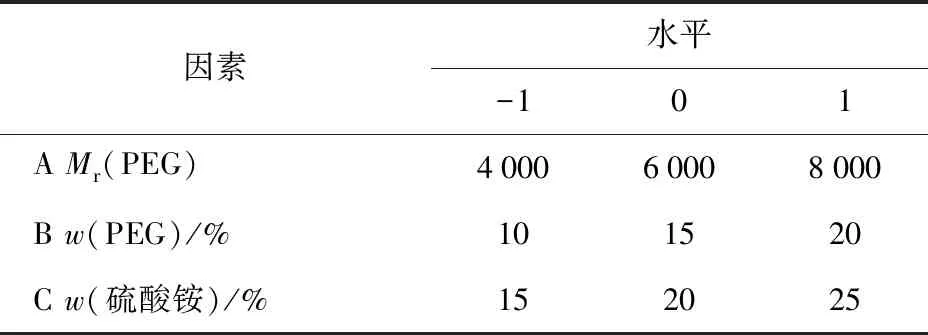
表1 響應面分析法的因素與水平Tab.1 Factors and levels of response surface methodology
1.3.7韭籽粕多糖抗氧化活性測定
1.3.7.1 DPPH·清除能力測定
參照Sellal等[10]方法并稍有改動。使用無水乙醇配置質量濃度為0.5、1.0、1.5、2.0、2.5、3.0 mg/mL的樣品溶液,并配置相同質量濃度的維生素C溶液為對照。取1.0 mL濃度為0.2 mmoL/L的DPPH溶液和1.0 mL樣品溶液,混勻后于室溫暗反應30 min,無水乙醇為參比,測定517 nm處的吸光度A;測定1.0 mL無水乙醇與1.0 mL樣品溶液的吸光度A0及1.0 mL DPPH溶液與1.0 mL無水乙醇的吸光度A1。重復實驗3次,按式(6)計算DPPH·清除率。

(6)
1.3.7.2 ·OH清除能力測定
參考孫婕等[11]方法,反應體系中加9 mmol/L FeSO42.0 mL、9 mmol/L水楊酸- 乙醇2.0 mL,不同質量濃度樣品溶液各3.0 mL,然后加8.8 mmol/L H2O22.0 mL,37 ℃反應1 h,以蒸餾水為空白對照,在510 nm測定各質量濃度樣品的吸光度。·OH清除率計算見式(7)。

(7)
式(6)中,A0為空白對照液的吸光度,A1為加入待測樣品后的吸光度,A2為不加顯色劑H2O2的待測樣品溶液吸光度。
1.3.7.3 總還原能力測定
參照李珊等[12]的方法,使用無水乙醇配制質量濃度為0.5、1.0、1.5、2.0、2.5、3.0 mg/mL的多糖溶液,并配制同樣質量濃度的2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)溶液作為對照。在2.0 mL pH值6.6、濃度為0.2 mol/L的磷酸鹽緩沖溶液中分別加入樣品溶液2.0 mL和質量分數為1%的鐵氰化鉀溶液2.0 mL,混勻后在50 ℃恒溫20 min,冷卻后加入2.0 mL質量分數為10%的三氯乙酸溶液,然后以3 000 r/min離心10 min,取上清液2.0 mL,加2.0 mL雙蒸水、0.4 mL體積分數0.1% FeCl3溶液,混勻后靜置10 min,在700 nm處測定吸光度,吸光度與還原能力之間呈正相關[13]。
1.4 數據處理
實驗數據統計及繪圖均采用Excel 2007軟件,所有實驗重復5次。
2 結果與分析
2.1 葡萄糖標準曲線的繪制
葡萄糖標準曲線見圖1。
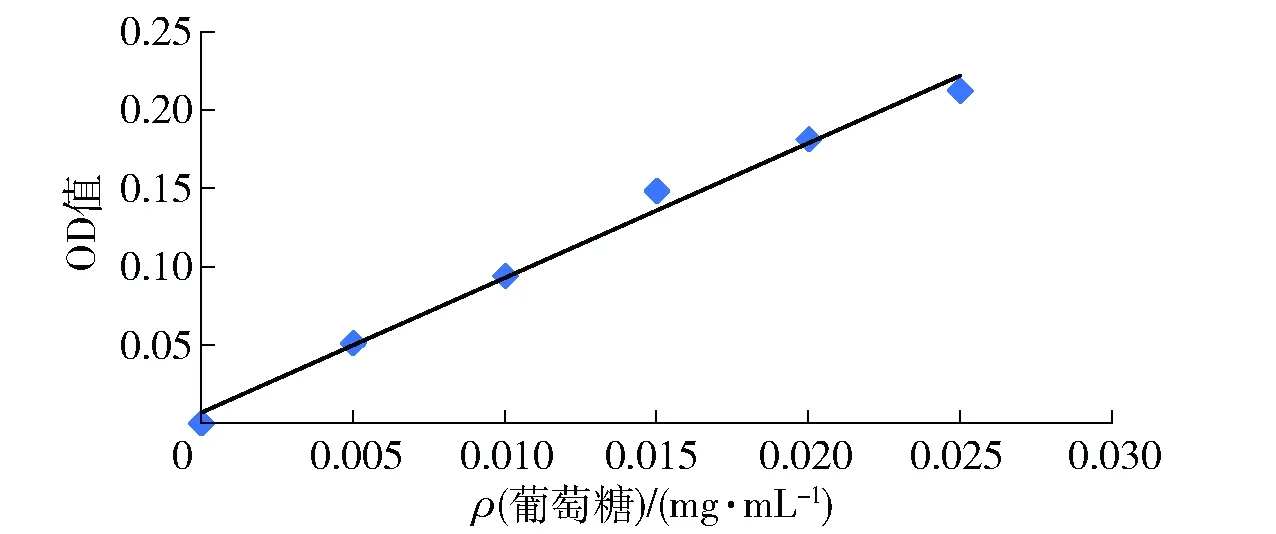
圖1 葡萄糖標準曲線Fig.1 Standard curve of glucose
通過苯酚- 硫酸法顯色反應實驗,確定葡萄糖質量濃度和吸光度之間的線性關系,y=8.594 3x+0.006 9,R2=0.990 8。
2.2 雙水相相圖分析
不同分子質量PEG相圖見圖2。由圖2可知,當成相物質的濃度在雙節線以下時,不會出現上下相分離的現象,所以要選擇系線上方的點作為萃取體系。當(NH4)2SO4質量分數為30%時,PEG1000的質量分數需達到61.57%才能形成雙相,PEG2000的質量分數需達到45.89%,PEG4000的質量分數需達到29.46%,PEG6000的質量分數則需達到15.31%,這與王飛等研究一致[14]。由此可知,隨著聚乙二醇相對分子質量的增大,相分離的動力增強,形成雙水相體系所需的成相物質濃度減小[15]。PEG相對分子質量增大,其疏水性增強,形成雙水相的臨界濃度降低[16]。當PEG相對分子質量增大時,系統的黏度也增大,不易發生滲透作用。造成分子間碰撞次數的減少,相相分離的阻力增大,分相時間延長。
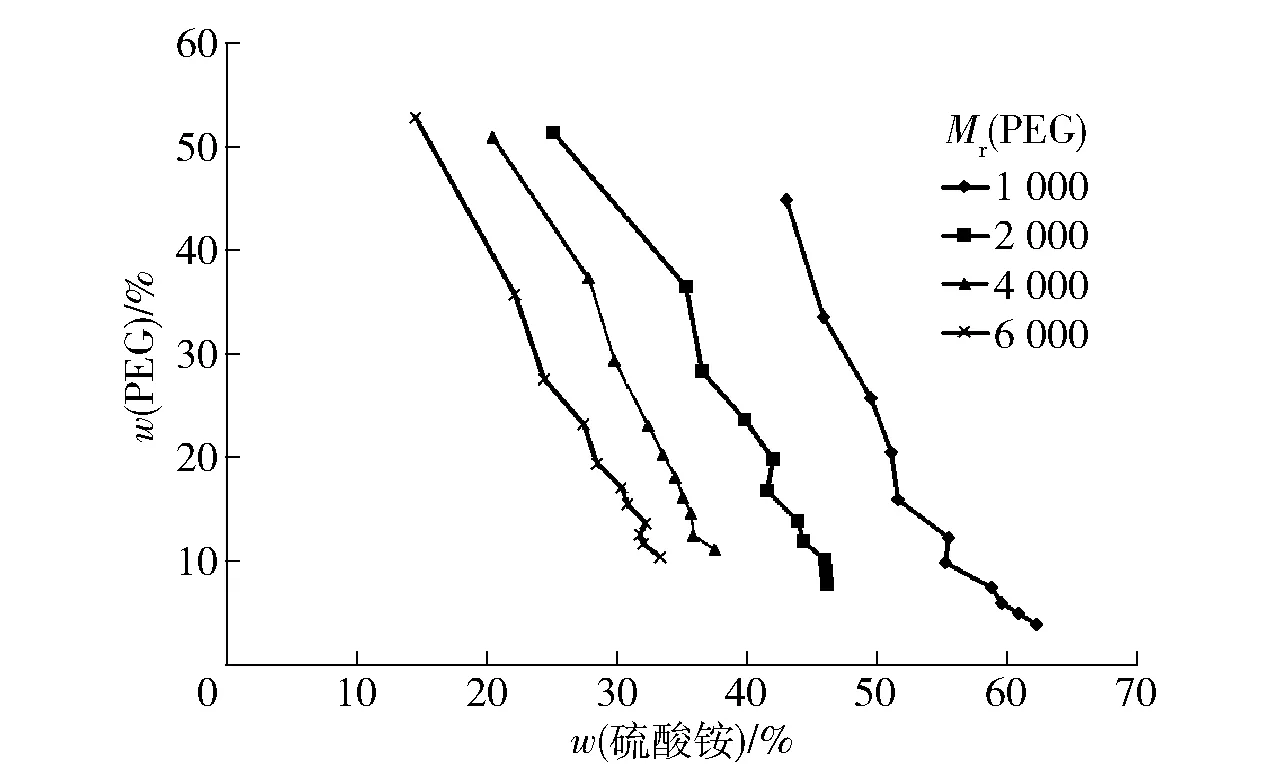
圖2 不同相對分子質量PEG相圖Fig.2 Phase diagram of PEG with different relative molecular weights
2.3 單因素實驗分析
2.3.1PEG相對分子質量對韭籽粕多糖萃取率的影響
不同相對分子質量PEG對韭籽粕多糖萃取率的影響如圖3。PEG-硫酸銨萃取系統中,硫酸銨一般在下相,PEG主要在上相,下相主要存在靜電作用,上相主要表現為疏水作用,韭籽粕多糖主要分布于下相。在硫酸銨和PEG的質量分數一定的情況下,當PEG相對分子質量增大時,上相體積逐漸變小,下相體積逐漸變大,總體變化不大,這和徐海軍等[17]的研究結果一致。由圖3可知,多糖的分配系數和萃取率隨著PEG相對分子質量的增大變化較明顯,分配系數呈現先減小后增大的趨勢;萃取率呈現先增大后減小的趨勢,在PEG相對分子質量為6 000時最大,因為PEG相對分子質量越大,黏度增加,成相物質分子的空間阻礙作用增大[18]。因此,PEG相對分子質量為6 000時最有利于多糖在下相的富集,此時萃取率為84.37%。

圖3 多糖萃取率與PEG相對分子質量的關系Fig.3 Relationship between polysaccharide extraction rate and relative molecular weight of PEG
2.3.2PEG質量分數對韭籽粕多糖萃取率的影響
PEG質量分數對韭籽粕多糖萃取率的影響見圖4。當硫酸銨添加量一定時,上下相比隨著PEG質量分數的變大而增大,分配系數逐漸減小,多糖萃取率先增大后減小,這與徐海軍等[17]的研究結果一致。由圖4可知,在PEG質量分數為15.00%時,多糖萃取率最大為84.34%。繼續增加PEG含量會導致溶液黏度增大,影響兩相的相比且給工業生產帶來不利影響;由于相比的增加,韭籽粕多糖萃取率開始降低,所以較佳的PEG質量分數為15.00%。
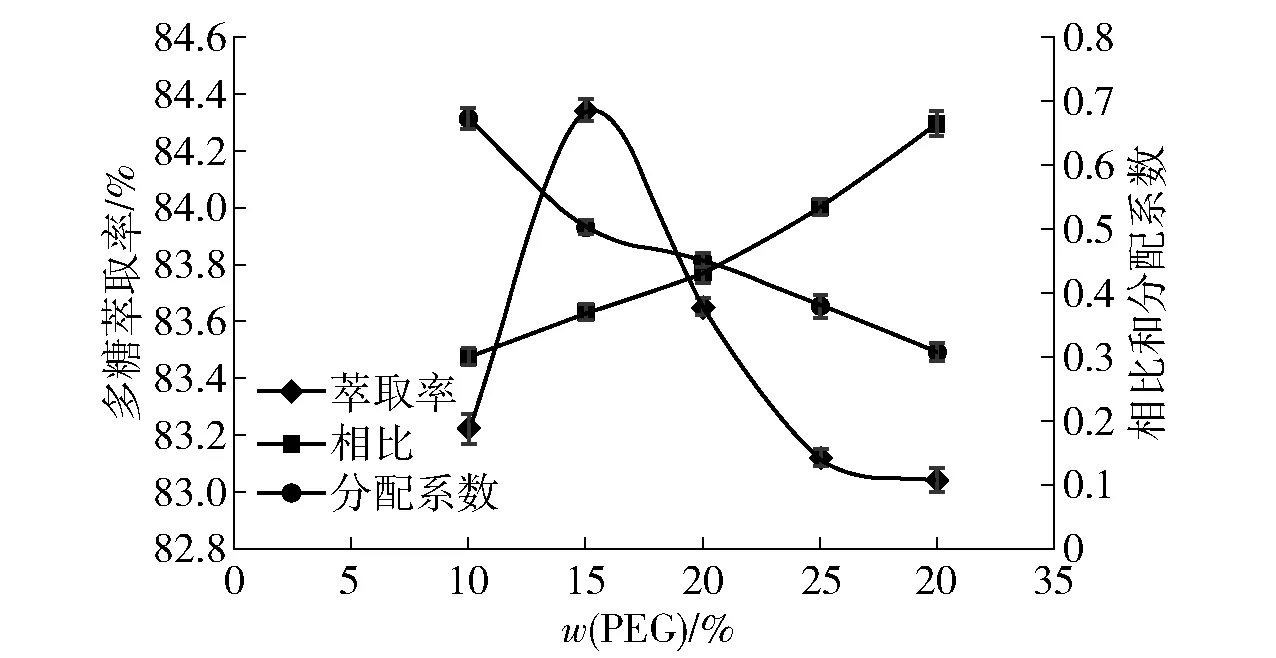
圖4 多糖萃取率與PEG質量分數的關系Fig.4 Relationship between polysaccharide extraction rate and mass fraction of PEG
2.3.3硫酸銨質量分數對韭籽粕多糖萃取率的影響
硫酸銨質量分數對韭籽粕多糖萃取率的影響如圖5。當PEG的添加量一定時,隨著下相硫酸銨質量分數的增加,下相的吸水能力增強,下相體積呈增大趨勢,所以相比逐漸減小。體系中多糖的分配系數先降后增。由圖5可知,多糖萃取率先增大后減小,當硫酸銨質量分數達到20.00%時,多糖萃取率達到最大值80.60%。吳學昊等[19]發現當雙水相系統中硫酸銨的含量過大時,會造成硫酸銨飽和析出,不易溶解,影響PEG的回收。

圖5 多糖萃取率與硫酸銨質量分數的關系Fig.5 Relationship between polysaccharide extraction rate and mass fraction of ammonium sulfate
2.3.4萃取時間對韭籽粕多糖萃取率的影響
萃取時間對韭籽粕多糖萃取率的影響如圖6。當硫酸銨和PEG的質量分數都固定時,隨著時間的增加,上下相比逐漸減小但總體變化不明顯。由圖6可知,多糖萃取率在20~30 min的增加并不明顯,20 min時間較短,多糖不能完全分配好。但隨后在30~60 min內,多糖萃取率卻下降明顯。當時間為30 min時,多糖的萃取率相對較大,可達到84.03%。在工業上應用時需要減少時間和財力的浪費,因此,萃取時間不作為響應面優化試驗的考察因素。
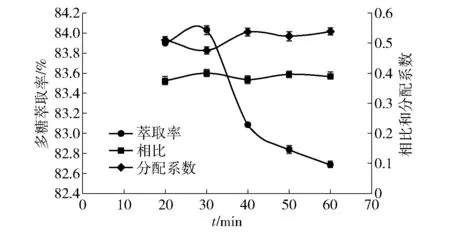
圖6 多糖萃取率與萃取時間的關系Fig.6 Relationship between polysaccharide extraction rate and extraction time
2.4 響應面試驗分析
2.4.1響應面試驗結果
根據單因素實驗,設定響應面的3個因素變量為PEG相對分子質量、PEG質量分數、硫酸銨質量分數,韭籽粕多糖萃取率為響應值,利用軟件進行響應面設計,優化提取工藝,以獲取最佳的提取率。響應面設計及結果如表2。
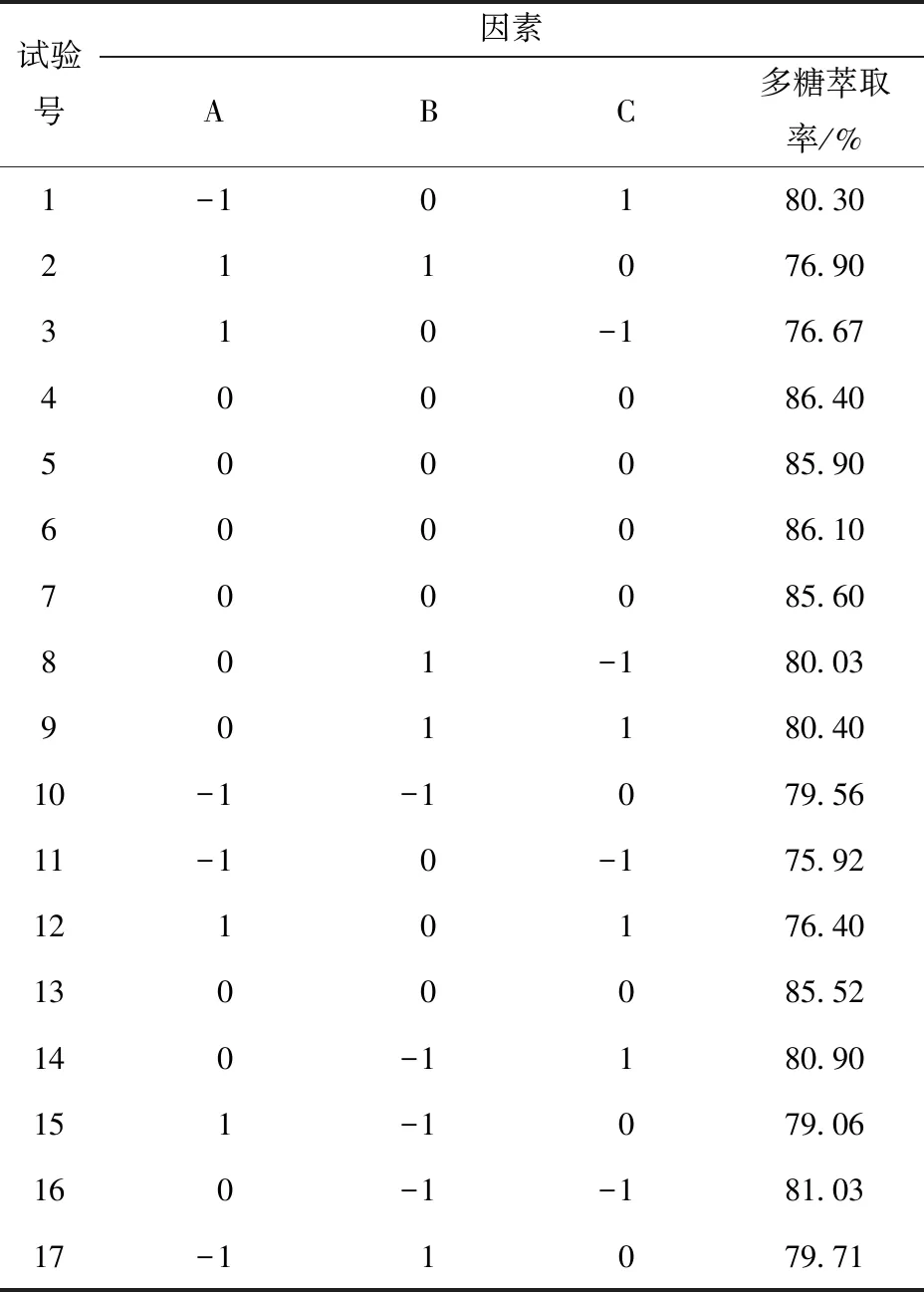
表2 響應面設計及結果Tab.2 Design and results of response surface
2.4.2回歸模型分析
對響應面的結果進行多元回歸擬合,得到雙水相體系下相的韭籽粕多糖萃取率與PEG相對分子質量、PEG質量分數、硫酸銨質量分數的多元回歸方程為:
Y=5.90-0.81A-0.44B+0.54C-0.58AB-
1.16AC+0.13BC-5.18A2-1.91B2-3.40C2
多元二次模型的方差分析見表3。

表3 響應面二次模型方差分析Tab.3 Variance analysis of response surface quadratic model

根據回歸方程的方差分析可知,該模型的一次項A的P值為0.006 1小于0.01,B的P值為0.073 3大于0.05,C的P值為0.035 0小于0.05,表明PEG相對分子質量對韭籽粕多糖萃取率影響極顯著,PEG的質量分數對韭籽粕多糖萃取率影響不顯著,硫酸銨的質量分數對韭籽粕多糖萃取率影響顯著,影響因素主次順序依次為PEG相對分子質量、硫酸銨質量分數、PEG質量分數。交互項AB、BC的P值都大于0.05,對多糖的萃取率影響不顯著;AC的P值為0.005 6小于0.01,對多糖萃取率的影響極顯著。二次項A2、B2、C2的P值均小于0.01,表明三者對韭籽粕多糖萃取率的影響均極顯著。研究表明,韭籽粕多糖萃取率受多種因素影響,且不是簡單的線性關系。
2.4.3交互作用分析
各因素對多糖萃取率的交互作用見圖7。根據等高線及響應面分析可以直觀地反映出各因素對響應值的影響。觀察圖7等高線的形狀和3D圖的顏色、傾斜度,可知AB、BC不顯著,AC極顯著。
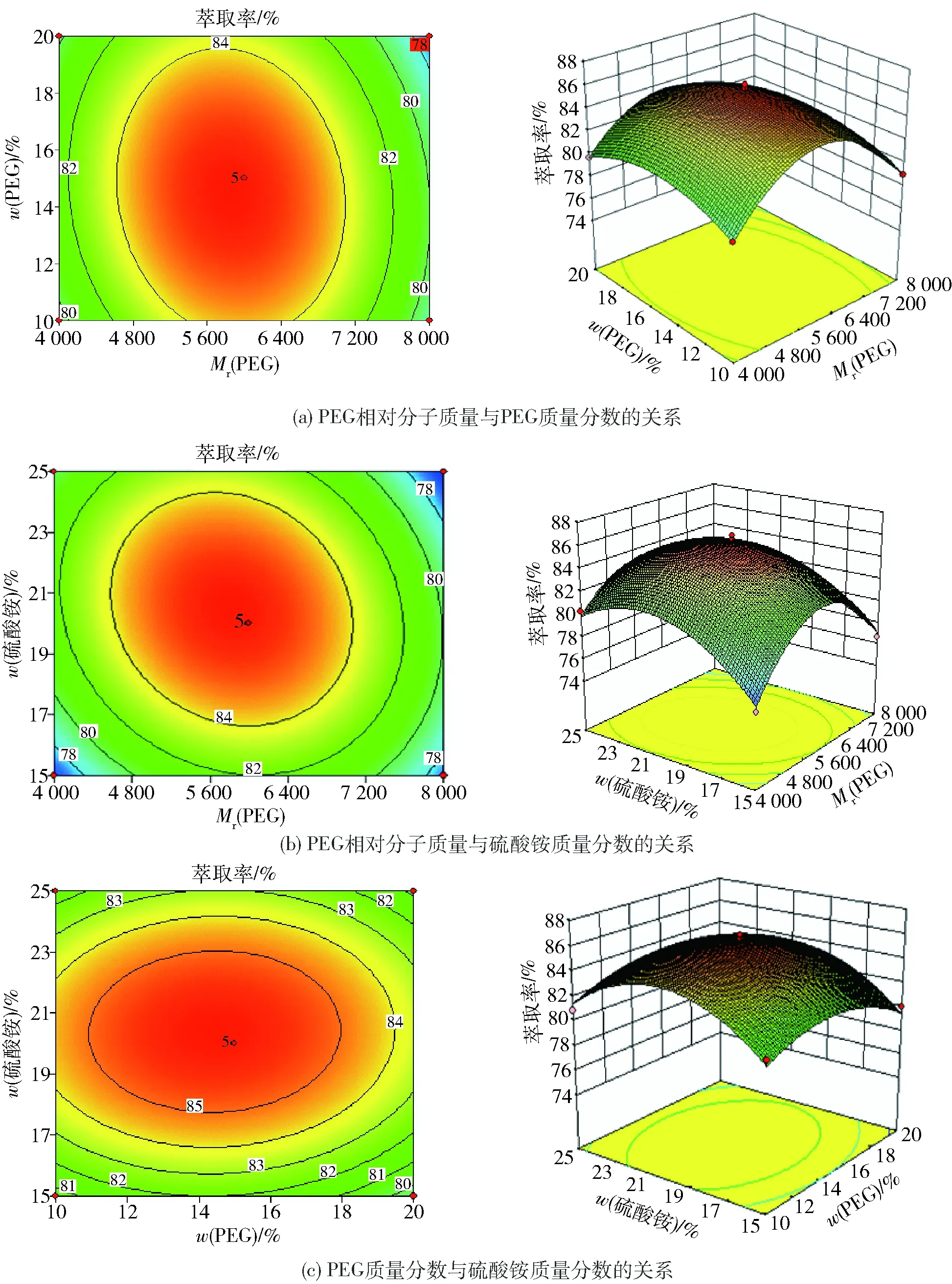
圖7 各因素對韭籽粕多糖萃取率的交互作用Fig.7 Interaction of factors on extraction rate of polysaccharides from leek seed meal
2.4.4驗證實驗
根據Design Expert軟件分析3個因素較優實驗點為PEG相對分子質量6 000,硫酸銨質量分數20.46%,PEG質量分數14.50%,在此條件下多糖萃取率的預測值為85.98%。為驗證模型預測的準確性,優化條件下進行驗證實驗,3次驗證實驗的平均萃取率為85.39%,與理論值相差0.59%(相對誤差<5.00%),說明該方程與實際情況擬合很好,通過響應面法優化得到的工藝條件可靠。
2.5 韭籽粕多糖抗氧化活性分析
2.5.1DPPH·清除能力分析
韭籽粕多糖對DPPH·的清除能力用清除率表示,清除率越高則韭籽粕多糖對自由基的清除能力越好,見圖8。由圖8可知,維生素C、BHT和韭籽粕多糖對DPPH·均有清除能力,且均隨樣品質量濃度的增大而略微增大。當韭籽粕多糖質量濃度達到3.00 mg/mL時,DPPH·清除率最大,達53.22%。
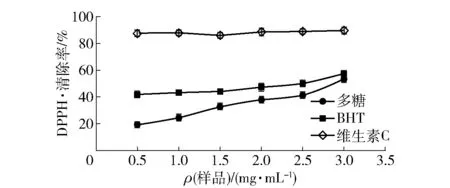
圖8 韭籽粕多糖對DPPH·的清除能力Fig.8 Scavenging capacity of polysaccharide from leek seed meal to DPPH free radicals
2.5.2·OH清除能力分析

圖9 韭籽粕多糖對·OH的清除能力Fig.9 Scavenging capacity of polysaccharide from leek seed meal to hydroxyl radical
2.5.3總還原能力分析
抗氧化劑能使鐵氰化鉀的三價鐵還原成二價鐵(亞鐵氰化鉀),二價鐵(亞鐵氰化鉀)進一步和三氯化鐵反應生成在700 nm處有最大吸光度的普魯士藍(Fe4[Fe(CN)6]3),因此測定700 nm處的吸收峰可以間接反映抗氧化劑的還原能力大小,吸光度越大,還原能力越強。韭籽粕多糖的總還原能力見圖10。隨著維生素C、BHT和多糖質量濃度的增加,三者在700 nm處的吸光度也在增加,即三者的總還原能力在增加。說明維生素C、BHT和韭籽粕多糖均能抑制自由基轉移電子,從而終止自由基鏈反應。而維生素C、BHT與多糖相比,維生素C和BHT表現出較強的還原能力。

圖10 韭籽粕多糖的總還原能力Fig.10 Total reducing capacity of polysaccharide from leek seed meal
3 結 論
雙水相萃取提取韭籽粕多糖的單因素實驗結果表明,PEG相對分子質量6 000、PEG質量分數15.00%、硫酸銨質量分數20.00%,分別有較高的多糖萃取率。進而運用Design Expert 8.06軟件進行響應面設計分析。由多元二次回歸方程相關系數的顯著性大小可知,各因素對萃取率的影響由大到小依次為PEG相對分子質量、硫酸銨質量分數、PEG質量分數。根據軟件得到的優化條件為PEG相對分子質量6000、PEG質量分數14.50%,硫酸銨質量分數20.46%,在此條件下韭籽粕多糖萃取率為85.39%。
韭籽粕多糖對DPPH·和·OH均有一定的清除效果;總還原力的測定中,隨著多糖質量濃度的增大,抗氧化能力也在增加,可初步判斷采用雙水相萃取得到的韭籽粕多糖具有良好的抗氧化活性。

