1例少見V型PML-RARA基因的急性早幼粒細胞白血病報告并文獻復習*
盛宏霞,謝婧,胡國亮,藍三春,趙志強,楊揚,孫婷,任婧,魏然,李欲航,胡亮釘,張斌
(中國人民解放軍總醫院第五醫學中心血液學醫學部,北京 100071)
急性早幼粒細胞白血病(acute promyelocytic leukemia,APL)是急性髓細胞白血病(acute myeloid leukemia,AML)的一種特殊類型,FAB協作組定為AML-M3型。APL約占AML的10%,其中90%的APL伴有t(15;17)(q22;q21)遺傳學異常,根據15q22斷裂位點的不同,可分為3種PML-RARA亞型,分別為長型(L型)、變異型(V型)和短型(S型),且相應的臨床特點不同[1]。但也有一些伴或單獨擁有其他少見的X-RARA融合基因的情況[2-3],較少見。我院收治1例t(15;17)(q24;q21)的PML-RARA融合基因少見V型的APL病例,報道如下。
1 病歷資料
患者,男,43歲。2019年6月末于南京行常規體檢,WBC 2.2×109/L。于南京市鼓樓醫院就診,WBC 2.3×109/L,中性粒細胞計數1×109/L,骨髓細胞形態學檢查發現骨髓有核細胞增生減低,G∶E=2.2∶1,異常早幼粒細胞占28%,提示不排除APL;免疫分型提示異常細胞在有核細胞中占比約為26.24%,該群細胞表達CD13、CD33、CD64、CD117,不表達CD34、HLA-DR。上述結果提示APL。為進一步診治于解放軍第307醫院住院。入院查體:體溫36.9 ℃,神志清楚,無貧血貌,全身皮膚黏膜未見皮疹及出血點,肝脾肋下未觸及,WBC 2.09×109/L,Hb 126 g/L,PLT 117×109/L。
入院后復查骨髓細胞形態學:骨髓增生減低-活躍,粒系占有核細胞49.5%,其中多顆粒早幼粒細胞占20.5%,見柴捆樣Auer小體,見圖1。免疫分型提示45.5%(占有核細胞)為可疑幼稚細胞,該群細胞表達CD117;不表達CD34。染色體核型為46,XY,t(15;17)(q24;q21)[10]/46,XY[14](圖2)。FISH分析結果提示PML-RARA融合基因陽性細胞占95.4%,見圖3。融合基因定性篩查,PML-RARA(L型、S型、V型)陰性;常規PML-RARA(L型、S型、V型)定量檢測,PML-RARA/ABL1為0。血液病相關基因檢測:未見與目前已經報道的髓系血液疾病相關的致病性突變相關基因。雖然RT-PCR檢測PML-RARA融合基因為陰性,結合其他檢測結果診斷為APL(低危型)。經維甲酸+亞砷酸雙誘導方案治療后,行骨穿復檢。實驗室檢查:骨髓增生活躍,原幼單核細胞1.5%,未見特異性早幼粒細胞。免疫分型:未見異常表型細胞。FISH分析:PML-RARA融合基因陽性細胞占0%。考慮為完全緩解狀態。后患者出院,轉回當地醫院繼續完成后續鞏固治療。2020年4月1日隨訪患者,仍為完全緩解狀態。
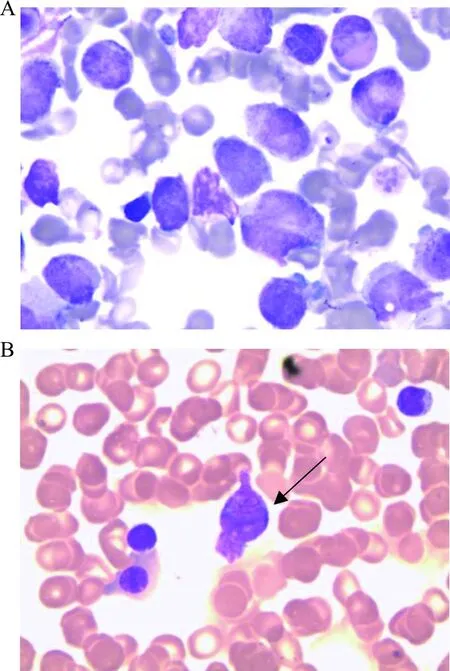
注:A,以多顆粒早幼粒細胞為主;B,箭頭示柴捆樣Auer小體。
依據染色體核型及FISH結果可見:該患者有PML-RARA的融合基因存在,開始未檢出,可能其融合位置發生非常規斷裂位點的重排,查詢文獻[4],重新合成引物進行一代測序,結果示:該標本檢測到PML基因的6號外顯子發生斷裂與RARA基因3號外顯子發生融合(見圖4),與常見V型不同是,PML6號外顯子常規斷裂位點缺失25 bp、插入11 bp后與RARA基因的3號外顯子連接。且根據測序結果設計定量引物及探針,其序列見表1。將首次入院骨髓樣本進行重新定量檢測,PML-RARA/ABL1的結果為24.8%。
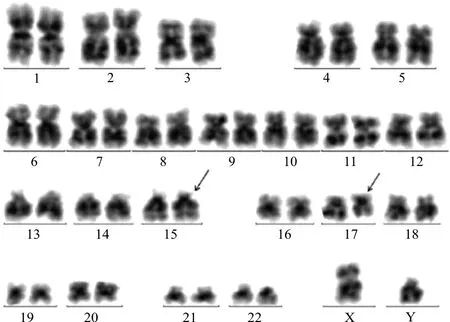
注:G顯帶示,46,XY,t(15;17)(q24;q21)[10]/46,XY[14]。
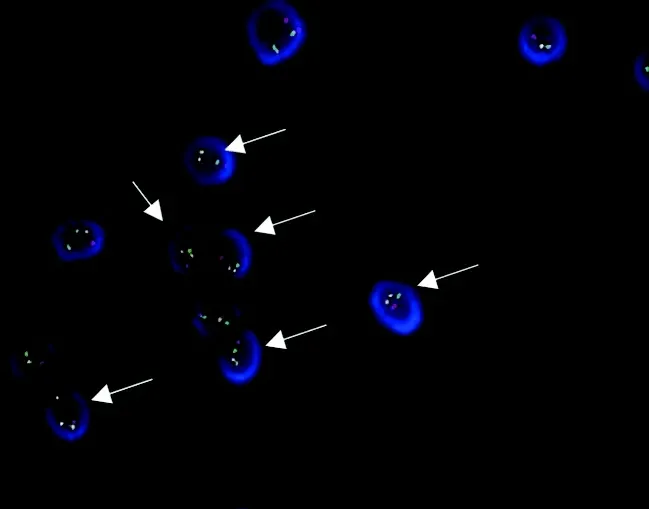
注:箭頭示PML-RARA陽性細胞。
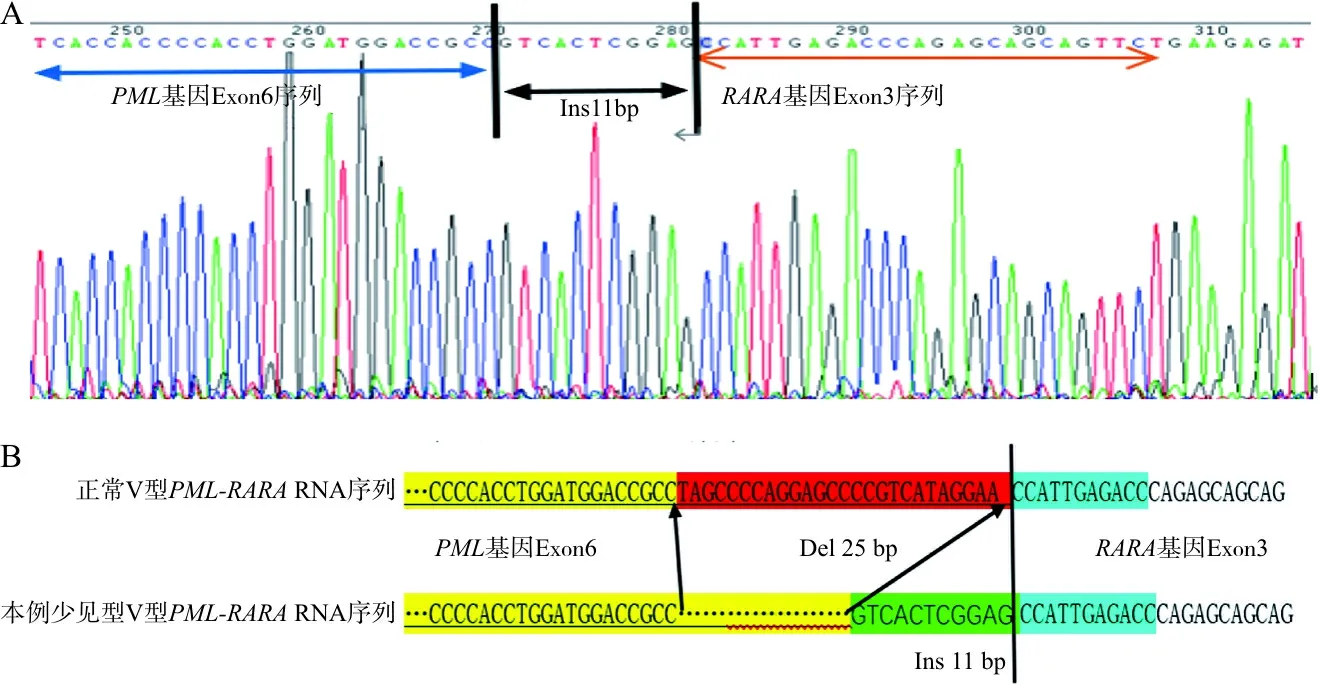
注:A,該患者骨髓樣本部分測序正向圖譜,PML基因正常V型斷裂位點位于6號外顯子,與RARA的3號外顯子連接;B,本例患者標本在PML 6號外顯子斷裂位點與常見不一樣,顯示缺失25 bp、插入11 bp片段后與RARA基因的3號外顯子相連。

表1 該少見V型PML-RARA基因定量檢測的引物與探針序列
2 討論及文獻復習
約70%~90%的APL具有特異染色體t(15;17)易位,形成PML-RARA融合基因,這是APL特有的細胞遺傳學標志[5]。根據PML的斷裂位點不同,PML-RARA基因分3個類型,L型、S型、V型,其中V型只占4%~5%[6],V型斷裂位點在PML基因的6號外顯子中,且V型患者合并出血的比例低于L型和S型。本文報道1例少見V型PML-RARA的病例。該初治骨髓標本檢測發現PML6號外顯子常見斷裂位點缺失25 bp后插入11 bp的片段,查閱文獻且在Cosmic與Clinvar上進行序列比對,V型PML-RARA自身既發生缺失又發生堿基插入的片段的情況未見報道。
本報道患者因行常規體檢發現白細胞低而就診于當地醫院,進行檢測診斷為APL,予以維甲酸治療。入我院檢查染色體分析結果為46,XY,t(15;17)(q24;q21)[10]/46,XY[14],骨髓細胞形態及免疫表型均支持APL,且FISH檢測提示存在PML-RARA融合基因,WBC<10×109/L,綜合分析診斷為APL低危型。該病例經過維甲酸+亞砷酸雙誘導方案治療后一直較好,經治療8個月后仍處于完全緩解狀態。
臨床上全反式維甲酸誘導分化治療能使85%左右的APL患者獲得緩解,預后較好;極少數無此融合基因者,維甲酸治療不敏感,預后較差。該患者標本雖然斷裂位點與常見V型不同,但由其臨床治療效果可見,該患者對全反式維甲酸誘導分化治療反應良好。除典型的t(15;17)外,其他變異性的易位也有不少報道。2007年[3]報道1例在幼年型粒單核細胞白血病(juvenile myelomonocytic leukemia,JMML)中由t(4;17)(q12;q21)引起位于4q12的基因FIP1L1和17q21的基因RARA產生的新的FIP1L1/RARA融合基因。也有報道隱匿的PML-RARA基因存在,其斷裂位點出現在PML的Exon7b和RARA的Exon3,產生了一個新的PML-RARA轉錄本[7]。該患者在第2次鞏固化療后獲得了分子緩解,并在22個月后仍處于完全緩解狀態。Liu等[8]報道了1例IRF2BP2-RARA合并N-RAS突變的APL在經全反式維甲酸和三氧化二砷與柔紅霉素結合,治療后12個月出現了復發,患者對所有其他的化療都有耐藥性。經文獻復習提示,對于少見變異性PML-RARA的融合基因,后期治療效果是否良好可能與其是否合并其他突變有關[8],對于本報道中的少見V型PML-RARA可能需要進行長期的隨訪及微小殘留監測。
實時定量PCR可在99%的典型APL患者中檢出PML-RARα融合基因,但仍有1%的APL患者可出現假陰性[9],通過本病例的系統性檢測,表明在白血病的診斷檢測中合理運用MICM檢測有助于患者的診斷及后期的治療,使患者能得到最大的獲益。

