非共價作用力對魚明膠-果膠復合凝膠體系的影響
王夢楠,涂宗財,2,3,胡月明,王 輝,*
(1.南昌大學 食品科學與技術國家重點實驗室,江西 南昌 330047;2.江西師范大學 國家大宗淡水魚加工技術研發分中心,江西 南昌 330022;3.江西師范大學 江西省淡水魚高值化利用工程技術研究中心,江西 南昌 330022)
明膠是由哺乳動物的結締組織或表皮組織中膠原部分通過降解變性而得到的一種天然高分子多肽聚合物。明膠具有良好的生物相容性和生物可降解性,具有很多功能特性。據報道,約95%的商業用明膠來源于哺乳動物豬、牛等的骨與皮筋腱膜,約5%來源于豬和牛的骨[1]。在食品工業中,明膠的凝膠性、起泡性、乳化性、成膜性等功能性質,被廣泛用于食品、醫藥品、化妝品和攝影行業等領域[2]。但是,由于瘋牛病和“口蹄疫”等人畜共患病的肆意傳播,加之工業明膠代替食品級明膠的食品安全問題,哺乳動物明膠的安全性越來越受廣大消費者的質疑[1-3]。食品安全原因使哺乳動物明膠在食品領域中的應用受到很大限制,從而使哺乳動物明膠市場份額占有率不足1.5%[3]。為此,人們開始著眼于其他來源的膠原與明膠產品來替代由哺乳動物制成的明膠。
研究者們主要尋找魚明膠、禽類明膠、植物來源的多糖體系以及蛋白質-多糖復合體系代替哺乳動物明膠[4-5]。魚明膠作為漁業副產物加工利用的產物,雖然其凝膠特性比哺乳動物明膠的凝膠特性稍差,但是大量研究證明,只要對魚明膠進行稍加改性或修飾,即可達到更佳的效果。目前物理法、化學法、酶法及復合修飾法等方法研究的較多[5-15]。其中,對于蛋白質-多糖復合體系的研究已經有很多成果,這些研究多集中在改善復合膠體的理化特性和凝膠特性[16]。其中,蛋白質-多糖修飾法在明膠改性實驗中頗受歡迎,一方面,大多數多糖屬于植物膠,如果膠、槐豆膠、海藻膠和纖維素膠等,具有優良的膠凝性和穩定性;另一方面這些多糖在抗腫瘤、降血糖、抗衰老、免疫促進等方面都發揮著生物活性作用。
果膠是富含D-半乳糖醛酸的植物細胞壁多糖,具有保持植物水分和固定纖維網絡結構等作用,水果和蔬菜也因此具有較硬的質地。果膠是一種天然的食品添加劑,主要從食品加工業廢物(檸檬或蘋果皮)獲得,具有很多功能特性[17]。果膠物質的分子不是以直線形式存在的,而是曲折折疊樣式,因此分子內極易形成氫鍵;但其酯化程度較高時,分子內氫鍵相對含量較小,導致溶解度在一定程度上增加。在食品工業中,果膠常用做食用薄膜、運輸材料等[18-19]。魚明膠-果膠復合膠體主要是通過非共價相互作用(靜電相互作用、疏水相互作用和氫鍵)結合,達到穩定結構[20]。這種結合的本質就是分子水平上自發的、有序的物理自組裝過程。魚明膠-果膠復合膠體正是屬于蛋白質-多糖復合體系,對其改性應用的研究也較為常見[18,21-24]。但是很少有人對其中的機理進行探索。
在許多食品中,一些高聚物分子(如多糖或蛋白質)能形成海綿狀的三維網狀凝膠結構。連續的三維網狀凝膠結構是由高聚物分子通過氫鍵、疏水相互作用、范德華引力、離子橋聯、纏結或共價鍵形成的連接區,網孔中充滿了由分子質量小的溶質和部分高聚物組成的水溶液。在蛋白質多糖體系中,形成復合物的作用力受到體系的pH值和離子強度的影響,其中,pH值通過影響魚明膠氨基酸側鏈電荷分布,改變蛋白質分子間的相互作用,進而影響魚明膠-果膠復合凝膠的非共價鍵作用力和結構[25]。
基于上述研究現狀分析,本實驗擬以魚明膠、果膠為原料,通過改變體系pH值,研究非共價相互作用類型(氫鍵、疏水相互作用和靜電排斥作用等)對魚明膠-果膠復合凝膠體系的影響,以期為多糖修飾魚明膠的研究提供理論基礎。
1 材料與方法
1.1 材料與試劑
羅非魚魚皮明膠(260~270 Bloom) 蘇州吉利鼎海洋生物科技有限公司;高酯化果膠 中國Sigma Chemical公司;鹽酸、氫氧化鈉等均為分析純。
1.2 儀器與設備
ML104/02電子天平 中國Mettler-Toledo公司;HH-4數顯恒溫水浴鍋 常州潤華電器有限公司;PHS 25雷磁pH計 上海儀電科學儀器股份有限公司;紫外-可見分光光度計 日本日立公司;臺式離心機 上海安亭科學儀器廠;Nano ZS90粒度儀 英國馬爾文儀器有限公司;LabRAM HR激光拉曼光譜儀 法國HORIBA Jobin Yvon公司;Synergy H1酶標儀 美國Bio Tek公司;MCR302流變儀 德國Anton Paar公司。
1.3 方法
1.3.1 樣品的制備
稱取8 mg/mL的果膠和6.67%的魚明膠混勻后加入蒸餾水,45 ℃水浴溶解至完全,并用1.0 mol/L的NaOH和HCl溶液調pH值至4、5、6、7、8、9,即為魚明膠-果膠復合溶液,分別命名為FG-P 4、FG-P 5、FG-P 6、FG-P 7、FG-P 8、FG-P 9。
1.3.2 濁度和粒徑
對復合膠體進行濁度測試[26]。將凝膠溶液用去離子水稀釋100 倍,使用紫外-可見分光光度計在600 nm波長處對樣品稀釋液進行濁度測量,用去離子水校準至100%的透射率,測試溫度為25 ℃。
對復合凝膠進行粒度分析測試[27]。采用納米粒度儀對復合凝膠稀釋液粒度分布情況進行測定,測定強度設定在90°,每個樣品測定3 次,取平均值。
1.3.3 非共價相互作用
疏水相互作用、氫鍵[28]:將所有樣品放置在載玻片上4 ℃冰箱孵化16~18 h,然后用激光拉曼光譜儀進行測量激發波長514 nm;激光出射功率:10 mW;顯微物鏡:50 倍長焦距;光柵:1 800;狹縫:200 μm;積分時間:20 s;重復3 次,累加得譜。
靜電相互作用[29]:對凝膠溶液進行稀釋100 倍處理,每次測定最終電位值為連續3 次測試的平均值。
1.3.4 魚明膠-果膠復合膠體流變學特性[20]
溫度掃描:應變0.5%,頻率1 Hz,按照0.5 ℃/min,從40 ℃降至5 ℃,5 ℃保持30 min,再從5 ℃升至40 ℃。剪切速率:測試溫度為25 ℃,剪切速率為0.01~100 s-1。
1.3.5 魚明膠-果膠復合膠體的凝膠強度[20]
取配制好的魚明膠溶液10 mL倒入25 mL的小燒杯中(膠體為33 mm×22 mm,直徑×長度),并置于10 ℃恒溫培養箱中放置16~18 h。使用質地分析儀測定膠體的凝膠強度。測定參數如下:探頭為直徑1.27 cm的P 0.5R,測試前、測試中、測試后速率均為1.0 mm/s。凝膠強度即為探頭下壓深度為4 mm所承受的最大壓力。
1.3.6 魚明膠-果膠復合膠體的質構學特性
將制備好的明膠溶液倒入直徑為2.2 cm的模具中,4 ℃孵化16~18 h。取出膠體并切成高度為1.5 cm的圓柱膠體,利用質地分析儀進行TPA檢測,探頭為P 36R,形變量為40%,循環測量2 次,測試前、測試中、測試后探頭移動速率均為1.0 mm/s。
1.4 數據分析
所有實驗均重復3 次。采用Origin 2018軟件進行作圖,SSPS 24軟件對數據進行單因素分析。P<0.05,差異顯著。
2 結果與分析
2.1 濁度和粒徑
濁度代表著不溶性復合物的形成[26,30]。通常蛋白質-多糖不溶性復合物是通過以下3 個步驟形成:1)形成可溶性“主要”蛋白質-多糖復合物,主要是通過帶正電的蛋白質和陰離子多糖之間的靜電吸引作用;2)引發主要復合物的聚集以形成準中和的主要復合物和聚集體;3)通過進一步聚集形成電荷中和的不溶性復合物,導致宏觀相分離成富含復合物和富含溶劑的相[16,31-33]。由圖1A可知,在pH 5時,體系的濁度特別高,此時體系中魚明膠和果膠之間存在強烈的靜電吸引,魚明膠-果膠體系自組裝形成較大的不溶性聚合物分子,而大量不溶性復合物(凝聚物)的積累導致體系達到最高的濁度。這與Yang等[33]研究結果類似,魚明膠與阿拉伯膠混合物電荷被中和時,不溶性復合物形成最為密集。而且,成熟的膠體(圖2)在pH 5條件下,果膠處于最穩定狀態,果膠處于最穩定狀態的靜電引力促使大而致密絡合物的形成,魚明膠-果膠顏色呈乳白不透明狀[34]。主導的非共價相互作用變化后的復合膠體溶液都變得透明,因此在pH值略微變大或變小的過程中,濁度均呈現降低的趨勢[35]。隨著pH值再次增大,復合體系的濁度顯著降低。在pH值達到7以后,復合膠體的濁度不再有顯著性差異。這可能是因為大分子的果膠在強酸強堿性環境下,分解成較小的分子或者是半乳糖醛酸等小分子物質,同時靜電斥力阻止了絡合物的形成[36]。
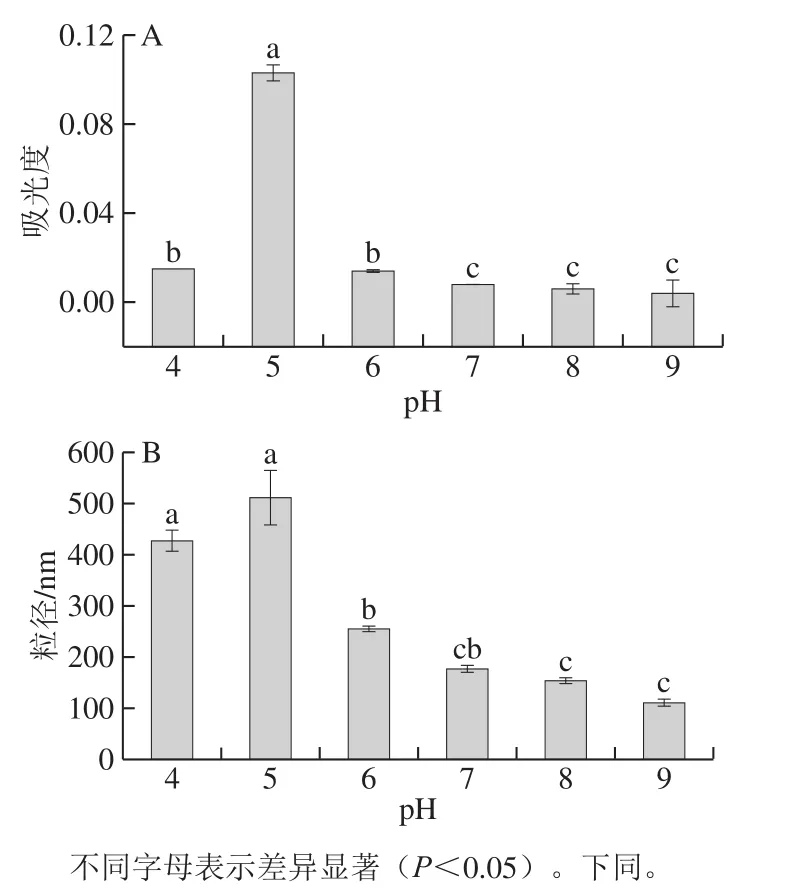
圖 1 不同pH值條件下復合膠體的濁度(A)和粒徑(B)Fig. 1 Turbidity (A) and particle size (B) of composite gel systems under different pH conditions

圖 2 成熟的復合膠體Fig. 2 Mature complex gel systems
由圖1B可知,魚明膠-果膠復合體系在pH值為5時,蛋白質在靠近等電點附近時,表面凈電荷最少,靜電斥力最小,粒徑最大。這是因為蛋白發生解聚,充分伸展,結構變得無序,疏水基團等活性殘基的暴露,非共價作用力形成,蛋白質之間的作用較強,蛋白聚集速度最快,形成較大的聚集體[25,28]。聚合體的形成主要受到分子間氫鍵作用、蛋白或多糖結構及體系電荷分布的影響[37]。因此,采用0.45 μm的濾膜對溶液進行過濾處理,消除了外來聚集體的影響,在25 ℃測試。由圖1B可以發現,弱酸或弱堿性條件下,果膠分解程度較小,果膠分子和魚明膠分子自組裝形成的聚合物粒徑較大[38]。在等電點附近時(pH 5),蛋白質分子以雙極離子存在,總凈電荷接近零,靜電引力較大,易凝集成大顆粒,因而最不穩定,溶解度最小,易沉淀析出。而在堿性條件下果膠降解成小分子物質,通過氫鍵作用,填充在魚明膠的三維凝膠網絡結構中,致使體系的平均粒徑顯著降低,穩定性也顯著增加[39]。
2.2 非共價相互作用的測定
2.2.1 疏水相互作用
色氨酸、酪氨酸等疏水性氨基酸殘基的拉曼光譜圖能夠反映蛋白質微環境的變化[38,40]。在拉曼光譜圖中,因苯丙氨酸環在1 003 cm-1處的強度不隨蛋白質的結構改變而發生變化,因此將該頻譜的呼吸振動作為內標,用于標準化頻譜。將760 cm-1附近的拉曼譜帶的歸一化強度歸因于色氨酸殘基環的拉伸振動,可用于研究Trp殘基的疏水性,然后反映蛋白質凝膠的疏水相互作用[41-42]。如圖3所示,在酸性條件下,魚明膠-果膠復合體系的疏水相互作用先增大后減小,在pH 5時,疏水相互作用最大,蛋白分子間靜電作用的減弱有利于疏水相互作用的增強,pH 5時體系靜電排斥作用最小,疏水作用最強,魚明膠之間的作用加強,魚明膠與果膠以及魚明膠與水之間的作用減弱,同樣印證了這一結論;在堿性環境下,隨pH值的增大,I760/I1003值逐漸增大,疏水相互作用逐漸增強,且隨著pH值的不斷增大,魚明膠與魚明膠、魚明膠與果膠、果膠和果膠之間的疏水作用不斷增大,這與粒徑、濁度的變化剛好相反,說明在堿性環境下,體系隨pH值的增大,越來越穩定。
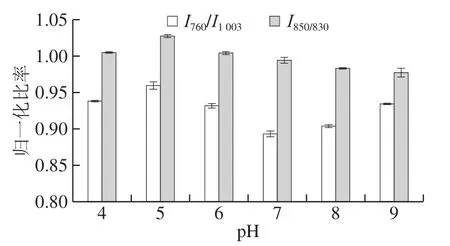
圖 3 不同作用力下,復合體系的I760/I1 003和I850/I830雙峰帶的歸一化比率Fig. 3 Normalized I760/I1 003 and I850/I830 ratios of composite gel systems under different pH conditions
2.2.2 氫鍵
I850/I830值可以用來判斷酪氨酸殘基的暴露和包埋狀態,I850/I830值越小,體系的氫鍵越大[28,40]。其中,當I850/I830值<0.9,表明酪氨酸酚羥基被包埋在疏水環境中,或者它們作為強氫鍵供體存在;比值在0.9~2.5之間時,表明酪氨酸殘基處于暴露狀態,在極性環境或水環境中可以參與中等或較弱的氫鍵形成[25]。由圖3可知,在所有pH值下的I850/I830值均在0.9~2.5之間,說明復合體系均表現為酪氨酸殘基暴露在非極性環境中,與水結合形成了中等或弱氫鍵。本實驗中,氫鍵含量隨pH值先減小后增大,在pH 5時達到最小,在堿性條件下不斷增大。靜電斥力不斷增大,蛋白質結構完全伸展,蛋白質表面與水的結合位點增多,水化面積增大,因此魚明膠蛋白質分子與水的氫鍵作用增強。相比之下,FG-P 7比FG-P 9有更弱的疏水相互作用,因此,在pH 7時,體系中的氫鍵含量較多,氫鍵為主導作用力;FG-P 9時靜電排斥相互作用較強。
2.2.3 靜電相互作用
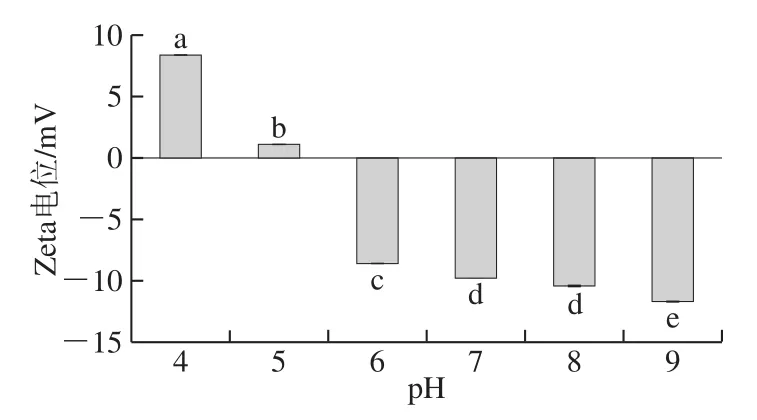
圖 4 不同pH值條件下復合體系的靜電相互作用Fig. 4 Electrostatic interaction of complex gel systems under different pH conditions
通過電位分析可以了解不同pH值條件魚明膠-果膠復合體系的穩定性以及影響體系穩定性的靜電相互作用強弱。混合體系的電位一般受到體系的pH值、魚明膠和果膠比例及總固形物含量等因素的影響[43-44]。因為魚明膠和果膠帶異性電荷,因此在混合過程中,魚明膠和果膠最先發生靜電吸引作用,即在pH 5時是其復合物充分混合后的原始狀態。如圖4所示,在酸性條件下,隨著樣品pH值的增大,魚明膠-果膠復合凝膠溶液的Zeta電位絕對值顯著降低(P<0.05),當pH 4時,體系電負性為正值,說明FG-P復合體系是以FG-FG作用為主導的凝膠體系。在pH 5時,Zeta電位為1.14 mV,絕對值最小。此時,靜電吸引力作用最強,粒徑最大,體系濁度最高,說明魚明膠和果膠通過靜電結合并發生凝聚[35]。蛋白分子間靜電斥力的減弱有利于疏水相互作用的增強,這與pH 5時魚明膠-果膠復合體系的疏水作用最強結果一致[35]。Zeta電位的絕對值大小可以反映溶液體系的穩定性,絕對值越大,則體系越穩定。帶正電荷的魚明膠和帶負電荷的果膠通過靜電吸引,傾向于凝聚或凝結,形成不穩定的復合物[35]。在堿性條件下,魚明膠-果膠復合凝膠體系隨著pH的增加,靜電斥力增強,疏水作用主導的體系表現得更加穩定。
2.3 不同作用力對復合膠體融膠溫度的影響
膠融溫度是評價明膠凝膠性質的重要因素之一。它在食品加工及應用中也起到很重要的作用,如軟糖、藥物膠囊等,高溫條件下很有可能會緩慢融化,使得產品口感黏滑[20]。因此,較高的膠融溫度將會使產品易于貯藏、藥物得到更好的緩釋效果。
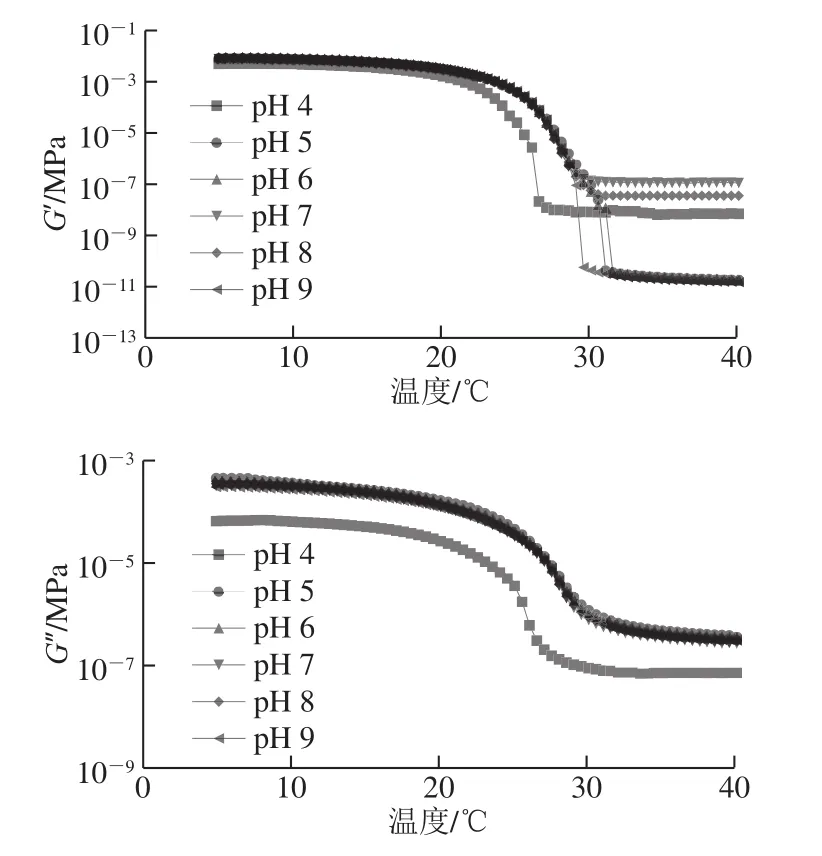
圖5 不同非共價作用力條件下魚明膠-果膠復合膠體的融膠過程模量變化Fig. 5 Changes in storage and loss moduli during melting of composite gel systems under different pH conditions
由圖5可知,復合膠體在融膠過程中,G?和G″均隨著溫度的升高而降低,明膠體系表現出單一的相轉變(固體到液體)。本實驗中,羅非魚魚皮明膠-果膠復合膠體的膠融溫度在(26.37~28.06)℃、pH 5條件下,達到最高為(28.06±0.16)℃。且由表1可知,魚明膠-果膠復合體系中,FG-P 5的膠融溫度(28.06±0.16)℃略高于FG-P 9的膠融溫度(27.84±0.1)℃,分析可能因為在pH 5時,靜電(排斥)相互作用減弱,分子間氫鍵含量較多,在pH 9時,靜電排斥作用最強,氫鍵相互作用較強,因此樣品FG-P 5和FG-P 9的膠融溫度較大。但整體上看,pH 5~9時的膠融溫度差異并不是很大,而pH 4時,體系的膠融溫度最低,推測可能是因為酸性條件下,FG-P交聯占據主導地位,蛋白質的分子間氫鍵含量較少,疏水相互作用和靜電引力是該環境下的主要作用力。
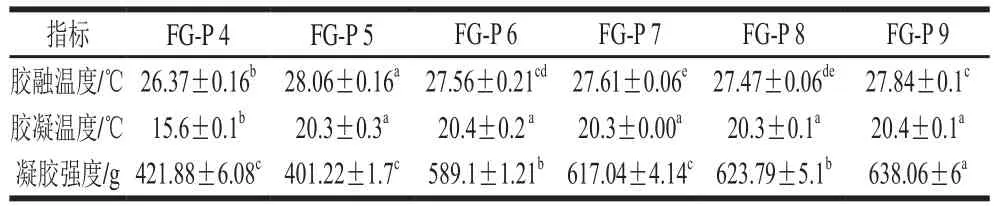
表 1 復合膠體的膠融溫度、凝膠溫度和凝膠強度Table 1 Melting temperature, gelling temperature and gel strength of composite gel systems
2.4 不同作用力對復合膠體凝膠強度的影響
凝膠強度是反映膠體品質的主要參數之一[45]。如表1所示,隨著pH值的增加,魚明膠-果膠復合體系的凝膠強度先降低后增加,最后基本平穩。當pH 5時,體系的凝膠強度最小(401.22±1.7)g,在pH 9時,達到最大(638.06±6)g。凝聚主要發生在靜電吸引較高且Zeta電位幾乎為零時[35]。當pH值為5時,體系的疏水相互作用最強,靜電排斥作用最弱,魚明膠分子與果膠分子通過靜電吸引,凝聚形成超大分子聚集體,但這種結構并不穩定,很容易遭到破壞[35]。體系pH值為4時與FG-P 5凝膠強度的差異不大。隨著pH值的增加,疏水相互作用逐漸減弱,而靜電排斥作用及氫鍵逐漸增強,魚明膠分子形成穩定的凝膠網絡結構,與此同時,果膠分子受到強堿性環境的影響會降解成小分子的糖鏈,通過靜電排斥和氫鍵作用貫穿并交聯于魚明膠網絡結構中,增強了體系的凝膠網絡結構,使得魚明膠-果膠復合膠體的凝膠強度逐漸增強[39]。
2.5 不同作用力對復合膠體溶液表觀黏度的影響
黏度反映了明膠產品的加工特性,也是評價明膠品質的關鍵因素[46]。一般采用溶液的表觀黏度表征其流動性。明膠的水溶液具有黏性,并決定了其產品的加工特性。表觀黏度的增大與pH值有極大的關系。實驗證明,在等電點處,明膠溶液的黏度達到最低。果膠可以顯著提高魚明膠的黏度,一方面是果膠增大了溶液的總物質的量,另一方面是果膠通過氫鍵和靜電相互作用與魚明膠形成了大量聚集體。魚明膠溶液為非牛頓流體,通常表現為剪切稀釋現象[9]。實驗表明,隨著果膠含量的增大,其溶液剪切變稀現象越明顯,說明此時的復合膠體溶液表現為非牛頓流體特征[20]。本實驗還發現,一些魚明膠-果膠復合膠體,在低剪切速率下,具有較高的表觀黏度。分析認為,在剪切速率較低時,剪切壓力也較低,未能破壞溶液的穩定狀態,因而呈現出較高的表觀黏度值;然而隨著剪切速率的逐漸增大,剪切速率也隨之變大,氫鍵和其他弱鍵的斷裂,蛋白質網絡結構解體,導致復合膠體溶液的表觀黏度逐漸降低,最終趨于一種平衡狀態。
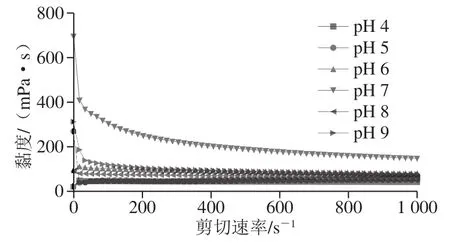
圖 6 剪切速率掃描對不同作用力下的魚明膠-果膠體系的表觀黏度Fig. 6 Apparent viscosity versus shear rate curves of composite gel systems under different pH conditions
研究認為,剪切速率為50 s-1時所對應的黏度值(η=50)與食品的黏度、潤滑性等品質相關[47]。由圖6可知,魚明膠-果膠復合膠體均表現出較高的黏度值(η=50),尤其樣品FG-P 7和FG-P 9最為顯著。體系pH值為7時,疏水相互作用比較弱,氫鍵和靜電排斥較強,膠體的三股螺旋網絡結構增強,促進凝膠體系的增強,從而表現出較高的黏度。FG-P 9較FG-P 7略低,但高于其余樣品的黏度。體現了以氫鍵和靜電排斥主導的復合膠體的三股螺旋含量較高,促進凝膠網絡結構的增強,凝膠體系更加穩定。
2.6 不同作用力對復合膠體質構學特性的影響
膠體的質構學特性測試可以模擬其在口腔中咀嚼時的品質變化,表達膠體食物在人口腔中被咀嚼時的物理特性。魚明膠-果膠復合凝膠體系的硬度在pH 5時,達到最小;在pH 6~9范圍內不斷增大;FG-P 4與FG-P 6的硬度值接近。復合膠體FG-P 5是由靜電相互吸引作用以及疏水相互作用維持的FG-P主導的凝膠網絡結構,形成的分子凝膠網絡結構較弱,彈性較低,表明復合膠體FG-P 5被破壞時,需要的能量較低。其他復合膠體的網絡結構較強,想要破壞其凝膠結構則需要較多的能量。表2列出了復合膠體的所有質構數據,FG-P 5內聚性是最差的,此時的魚明膠和果膠復合膠體主要是通過靜電相互吸引而形成的超大分子聚集體,其穩定性很差[35],因此,在探頭擠壓穿刺之后,其完整性很難得到維持。而其他膠體均表現出較強的內聚性,說明其凝膠網絡結構比較穩定,不易被破壞。這與前文數據保持一致。
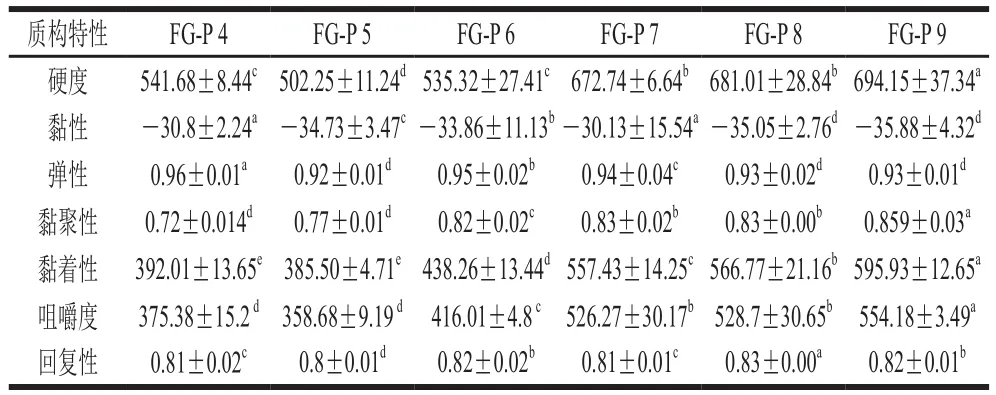
表 2 不同pH值條件下,果膠修飾魚明膠對復合膠體質構特性的影響Table 2 Texture properties of composite gel systems under different pH conditions g
3 結 論
當魚明膠-果膠復合凝膠體系在pH值為5時形成導致超大分子的復合聚集體,疏水相互作用最強,而復合體之間也具有強烈的靜電引力。體系pH值為7時,疏水相互作用整體減弱,而氫鍵較強。體系pH值為9時,Zeta電位絕對值在所有的樣品中達到最大,因此FG-P 9的靜電斥力最強。所有樣品體系均不是單一作用力形成的,且這些非共價作用力均是弱相互作用,這些弱的相互作用力雖然不是形成復合膠體的主要作用力,但卻對蛋白質折疊起著至關重要的作用。因此,每一種穩定體系都是由不同比例的不同作用力共同平衡存在的。以疏水相互作用主導的復合膠體穩定性較差,但魚明膠-果膠復合膠體的膠融溫度和凝膠溫度均較高;而以靜電排斥主導的復合膠體具有較高的凝膠強度和穩定性;以氫鍵主導的復合膠體具有更強的凝膠網絡結構,體系更加穩定。因此,不同的非共價相互作用對魚明膠-果膠復合膠體的性質作用不同,這對建立蛋白質-多糖復合凝膠體系目標性質具有基礎作用。

