大鼠骨髓mMSC和RS細胞肝組織內注射對肝硬化大鼠肝功能及肝臟病變的改善作用觀察
謝麗平,林濤發,郭子寬,王少揚
1 中國人民解放軍聯勤保障部隊第九〇〇醫院,福建福州350001;2 軍事醫學科學院放射與輻射醫學研究所
肝硬化(hepatic cirrhosis)是由不同病因引起的肝臟慢性、彌漫性改變。目前尚無有效內科治療肝硬化的方法,肝移植是目前臨床公認最有效的治療方法,但移植價格昂貴、肝源匱乏等因素限制了其臨床應用。間充質干細胞(mesenchymal stem cell,MSC)具有低免疫源性、多向分化潛能、取材方便、來源豐富等優勢,目前已被廣泛用于肝臟疾病的治療中。MSC 是一個異質性的細胞群體,體外培養可見多數細胞為梭形成纖維細胞和大而扁平細胞,即成熟MSC(mature MSC,mMSC),同時還可觀察到一種圓形細胞,其體積很小、顆粒度很低,命名為快速自我更新細胞(rapidly self-renewing cell,RS 細胞),這類細胞具有更強的多向分化能力[1],認為可能是更原始的干細胞。mMSC、RS 細胞是否可用于肝硬化的治療中?2020 年2 月—10 月,我們向肝硬化大鼠肝組織內注射mMSC、RS 細胞,比較其抗肝纖維化的效果有無區別,同時體外經HGF 誘導培養后通過RT-PCR 測其ALB、AFP 表達水平,以期進一步探討RS細胞的肝(樣)細胞分化能力。
1 材料與方法
1.1 動物、試劑 6周齡Wistar雄性大鼠36只,2周齡Wistar 雄性大鼠1 只,均購于解放軍軍事醫學科學院,按實驗室標準飼料喂養。Mouse anti-Rat CD31-PE、 CD45-PE、 CD11b/c-PE、 CD86-FITC、CD44-FITC(美國 Becton Dickinson 公司),Human HGF(美國 Peprotech 公司),RNAsimple Total Kit、FastKing One Step RT-PCR Ki(t北京天根生化科技公司),Rat anti-AFP Polyclonal Antibody、Rat anti-ALB Polyclonal Antibody(北京嘉美公司),大鼠源白蛋白(ALB)、甲胎蛋白(AFP)、β-Actin引物均由奧科鼎盛生物科技有限公司合成。
1.2 大鼠骨髓mMSC、RS細胞分離培養及鑒定
1.2.1 大鼠骨髓MSC分離、培養及鑒定 取2周齡Wistar 雄性大鼠1 只,處死后取脛骨和股骨,剪去骨骺端,DMEM 沖出骨髓液,與 PBS 按 1∶1 混勻,200 目尼龍網過濾,收集至50 mL 離心管,1 000 r/min 離心5 min,棄上清,加入含10%胎牛血清的DMEM 培養基重懸細胞,105/cm2密度接種于10 mm 培養皿,37 ℃、5%CO2培養箱中培養,每3天更換一次新鮮培養基,待細胞生長至80%左右傳代(6 000/cm2傳代)。
將分離培養的細胞按每流式管1×106分裝,各管分別加入CD45-PE、CD31-PE、CD11b/c-PE 和CD44-FITC、CD86-FITC,另設1 管陰性對照(無標抗體標記),室溫避光 30 min,PBS 洗滌 2 次,流式細胞儀(FACS Calibur,Becton Dickinson)檢測。MSC 體外成脂肪和成骨鑒定按本實驗室常規方法進行[2-3]。接種24 h 時大鼠骨髓單個核細胞開始貼壁,72 h 見到少量成纖維樣細胞(呈長梭形)及很小的圓形細胞,培養6 d 后長梭形細胞呈漩渦狀生長,圓形細胞增多散布于梭形細胞之間。流式細胞分析結果為,細胞 CD44 表達呈強陽性,CD31、CD11b/c、CD45 和CD86 表達均呈陰性。體外成骨誘導經堿性磷酸酶染色呈陽性,而對照細胞染色陰性;成脂誘導經油紅O 染色呈陽性,對照細胞染色陰性。最終鑒定培養細胞為 MSC[6]。
1.2.2 mMSC、RS 細胞分離培養及鑒定 根據文獻[1]確定mMSC直徑15~50 μm、RS細胞直徑7 μm,因此將培養鑒定的細胞通過直徑10 μm 濾膜分離RS、mMSC細胞,分別收集于2個無菌試管中。
①采用流式細胞術鑒定MSC 細胞表型。分離出 RS 細胞(直徑<10 μm)通過流式細胞儀鑒定CD34、CD31、CD44、CD45、CD73 等表型。直徑<10 μm 的細胞 CD44、CD73 表達陽性,CD34、CD31、CD45 表達陰性,鑒定為 MSC[5]。②取 mMSC、RS 細胞進行CM-Dil 染色,按105/cm2密度接種于培養皿,加入HGF(20 ng/mL),在37 ℃、5% CO2培養,每3 d更換培養基及補充HGF。因RS 細胞為半貼壁懸浮細胞,遂將正常貼壁細胞經放射后作為滋養層細胞培養。培養14 d 時取細胞進行CM-Dil 染色,結果發現RS細胞是存活細胞,具有細胞活力。
③另取大鼠肝臟細胞、mMSC 及RS 細胞,RTPCR 法檢測細胞 ALB、AFP。設計 ALB、AFP、βactin 的 引 物 序 列 :ALB:5'-AGCACACAAGAGTGAGATCG-3'和 5'-TGTCATCCTTGTGCTGCAGG-3',323 bp;AFP:5'-AACAGCAGAGTGCTGCAAAC-3'和5'-AGGTTTCGTCCCTCAGAAAG-3',668 bp;β-actin:5'-AGAGGGAAATCGTGCGTGAC-3'和5'-AGGAGCCAGGGCAGTAATC-3',353 bp。收集mMSC、RS細胞及正常肝組織細胞,采用RNAsimple Total 試劑盒實驗操作步驟分離純化總RNA 并檢測其濃度。RTPCR 步驟根據FastKing One Step RT-PCR 試劑盒操作說明進行,總反應體積 50 μL:2×FastKing One Step RT-PCR MasterMix 25 μL,25×RT-PCR Enzyme Mix 2 μL,上游特異性引物(10 μmol/L)1.25 μL,下游特異性引物(10 μM)1.25 μL,RNA 模板 10 ng/μg total RNA,RNase-Free ddH2O 補水至 50 μL。擴增條件為:42 ℃逆轉錄30 min,95 ℃預變性3 min;94 ℃變性 30 s、58 ℃ 30 s、72 ℃ 30 s,35 個循環;72 ℃5 min。在1.0%瓊脂糖凝膠電泳檢測和紫外凝膠成像分析。結果顯示:肝細胞表達ALB、AFP;未經 HGF 誘導的 mMSC、RS 細胞及經 HGF 誘導的mMSC、RS細胞均不表達ALB、AFP。
1.3 大鼠肝硬化模型制備、mMSC 和RS 細胞注射方法 ①模型制備:取 Wistar 大鼠按文獻[4]報道方法建立肝硬化模型,制備肝硬化大鼠模型共計6周。6 周后隨機取3 只大鼠,取肝臟組織做病理學檢查,可見肝細胞濁腫,少量脂肪變,肝小葉結構模糊不清,有大小不等的假小葉形成。②分組:36 只肝硬化大鼠隨機分為A、B、C 三組。A、B 組大鼠乙醚麻醉成功后開腹,肝組織內分別注射mMSC、RS 細胞,注射細胞量5×106,治療后即刻關腹縫合;C 組大鼠開腹后注射NS。治療后三組大鼠繼續按建模方案喂養。
1.4 各組大鼠肝功能指標及肝臟病理變化觀察分別于治療前和治療1、2、4 周時,各組大鼠尾靜脈取血1 次(2.5 mL),檢測血清谷丙轉氨酶(ALT)、總膽紅素(TBIL)。治療4 周時處死三組大鼠,觀察肝臟形態,取肝組織進行病理HE 和Masson 染色,對肝組織進行病理分級評分[5](包括肝纖維化、肝細胞壞死及脂肪變性評分)。
1.5 統計學方法 采用統計軟件SPSS19.0 進行數據處理。計量資料以表示,多組間比較采用單因素方差分析,多重比較采用LSD-t檢驗。P<0.05為差異具有統計學意義。
2 結果
2.1 各組大鼠血清ALT、TBIL 水平比較 造模成功、治療1 周、治療2 周及治療4 周時各組大鼠血清ALT、TBIL 水平比較見表 1。與 C 組比較,治療1、2、4 周時 A 及 B 組血清 ALT、TBIL 水平降低(P 均<0.05)。
表1 造模成功、治療1周、治療2周及治療4周時各組大鼠血清ALT、TBIL水平()

表1 造模成功、治療1周、治療2周及治療4周時各組大鼠血清ALT、TBIL水平()
組別A組B組C組n ALT(U/L)TBIL(μmol/L)造模成功350.75±11.58 354.07±11.42 353.00±11.53治療1周29.83±10.02 25.83± 3.11 328.53±17.25 12 12 12治療2周45.90±17.10 40.80±23.60 338.00±17.78治療4周50.17±14.00 40.07±16.11 333.67± 8.02造模成功1.78±0.13 1.79±0.09 1.80±0.06治療1周0.33±0.15 0.50±0.26 1.80±0.20治療2周0.30±0.21 0.47±0.21 1.50±0.46治療4周0.70±0.66 0.80±0.20 1.57±0.25
2.2 各組大鼠肝組織病理評分及病理變化 A 組大鼠肝纖維化、肝細胞壞死、脂肪變性評分分別為(2.42 ± 0.51)、(1.92 ± 0.51)、(1.83 ± 0.39)分,病理評分為(6.25 ± 0.87)分;B 組分別為(2.17 ±0.39)、(1.58 ± 0.51)、(1.75 ± 0.45)及(5.50 ±0.80)分;C 組分別為(3.67 ± 0.49)、(3.17 ± 0.39)、(1.83± 0.58)及(8.75± 1.14)分,與C 組比較,A 及B 組肝纖維化、肝細胞變性壞死評分低(P均<0.05)。C 組的肝臟假小葉形成,肝細胞水腫變性、壞死(++),見少量脂肪空泡;A、B 組的肝臟假小葉的纖維纖細,肝細胞變性、壞死(+),見少量脂肪空泡(圖1)。
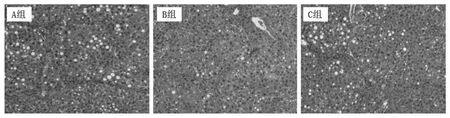
圖1 治療4周時各組肝組織病理變化(HE染色,200×)
3 討論
肝硬化是各種原因導致肝損傷終末期臨床表現,肝移植是目前臨床治療肝硬化的唯一手段,但肝源匱乏、費用昂貴及移植后排斥反應等諸多因素限制了其應用。MSC 具有抗肝纖維化的作用,因此MSC可能成為治療肝纖維化、肝硬化的有效手段。
研究[7]發現,將骨髓MSC(BMSC)細胞移植植入肝硬化大鼠體內,BMSC 細胞歸巢至肝臟后,首先分化成肝卵圓細胞,隨后分化成肝(樣)細胞,并證實BMSC 分化的肝前體細胞可減輕肝纖維化。當肝硬化患者接受MSC 移植治療后,患者肝功能、終末期肝病模型(MELD)評分及肝臟儲備功能分級標準(Child-Pugh)均明顯恢復,表明MSC 可改善肝功能及肝纖維化[8]。本研究結果發現,肝硬化大鼠給予mMSC、RS細胞治療后,血清ALT、TBIL水平均下降,同時病理結果證實大鼠肝壞死及肝纖維化情況均得到改善。
MSC 可通過多個環節抑制肝組織纖維化,一方面MSC 分化為肝細胞或者肝卵圓細胞促進肝臟修復再生[9],MSC 植入肝臟后,可能與受損的肝細胞融合,或者分化為肝(樣)細胞[10-11]。不管是人源還是鼠源MSC 都可以表達肝細胞的某些基因型,因此,MSC 存在分化為肝細胞的潛能[12-13]。另一方面,MSC 通過旁分泌或產生細胞因子等機制抑制肝星狀細胞(HSC)的活化,促進HSC凋亡,減少細胞外基質(ECM)的形成[14]。MSC 與HSC 體外共培養時,可分泌某些細胞因子,抑制HSC 的增殖及活性[15]。研究[16]發現,BMSC 可通過干擾 LPS-TLR4 和 NF-κB 信號途徑抑制 HSC 的增殖和激活。Cao 等[17]研究發現,BMSC 可以抑制 ACTA2 和 HGF 表達,誘導 HSC凋亡。Kim 等[18]研究發現,MSC 可能通過 HGF 阻斷細胞外信號調節激酶的磷酸化作用,使α-SMA 陽性細胞的增殖受到抑制,從而抑制成纖維細胞的生長、增加凋亡,緩解肝纖維化。旁分泌作用的另一機制,MSC 可以通過分泌前列腺素E2 增加IL-10 的分泌,減少TNF-α、IFN-γ和IL-4水平,從而抑制炎癥,改善肝纖維化[19-20]。MSC 還可以促進基質金屬蛋白酶(MMP)的表達,從而降解EMC 減輕肝纖維化[21]。多數研究者[22-23]認為MSC 抗肝纖維化的機制是多方面機制共同作用的結果,即可能是免疫效應及旁分泌的協同作用,或是肝細胞分化、旁分泌效應、免疫效應三者共同發揮協同作用。
Colter等[1]在培養中發現,MSC多數為梭形成纖維細胞和大而扁平細胞,表面粗糙呈顆粒狀,即成熟MSC(mMSC),當MSC在進行極低密度接種時(3/cm2),單細胞克隆群中出現一種小而圓形的細胞,將其命名為RS 細胞,這類細胞體積小、顆粒度低,增殖迅速。RS 細胞表達與mMSC 不同的蛋白和表面抗原,已有研究發現RS細胞表面抗原數表達比mMSC更少,RS細胞表達 CD117、KDR 顯著高于 mMSC,表明 RS 細胞是一種更原始的細胞,具有更強的多向分化潛能。Javazon 等[24]通過觀察細胞增殖過程,認為RS細胞是mMSC 的前體細胞。當MSC 以3/cm2密度初始接種時,培養2周后細胞擴增可達2 000倍,培養6周增殖可達2×109倍;而當以5 000/cm2高密度接種時,細胞擴增15 倍左右后即停止生長[25],表明MSC細胞亞群的組成與細胞接種的密度及時間相關,低密度接種可產生更多的RS細胞亞群。
綜上所述,肝組織內注射mMSC、RS 細胞的肝硬化大鼠治療后肝功能及肝纖維化均有改善,表明RS 細胞在改善肝纖維化方面與mMSC 有同樣功能。但我們在分離鑒定細胞時發現,mMSC 和RS 細胞體外HGF誘導培養后,RS細胞沒有向肝(樣)細胞分化的能力。今后應進一步探索RS細胞培養條件,包括細胞接種密度、時間和刺激劑種類,以及細胞輸注途徑、時機等,尋找更好的細胞亞群提高肝硬化治療的效果。

