結直腸癌肝轉移預后評分系統的現狀及臨床應用
張果,張瑞,陳進宏
結直腸癌(colorectal cancer,CRC)是中國第二常見的惡性腫瘤,占全部癌癥病例的12.2%,死亡率位于第五位(8.6%)[1]。據統計,2018年全球CRC 患者多達180 萬人[2],其中約50%的患者最終會發生肝轉移[3]。有效的全身治療和積極的包括手術在內的局部治療,是提升結直腸癌肝轉移患者療效的關鍵。肝切除術為結直腸癌肝轉移(colorectal liver metastasis,CRLM)患者提供治愈和長期生存的機會[3],但在肝切除術后兩年內的再次復發率仍大于50%[4],肝切除術后復發是導致結直腸癌肝轉移患者死亡的主要原因。不同復發風險的患者治療選擇有所不同,因此建立有效的CRLM 預后評分系統,以指導其個體化治療至關重要。1999 年Fong等人提出的用于預測CRLM復發及生存的評分系統——臨床危險評分(clinical risk score,CRS)[5]目前應用最為廣泛。近年來,隨著對疾病認識的加深,以及腫瘤分子生物學的發展,臨床研究者又提出多個結合臨床特征和分子生物學指標的CRLM 預后評分系統,預測準確性進一步提升。臨床醫生通過使用預后評分系統將病人分層,可使治療方案更加個體化,延長患者總體生存時間。本文對CRLM 預后評分系統的發展現狀及臨床應用做一綜述。
1 CRLM 預后評分系統的建立及發展
1.1 Nordlinger 評分
1996 年,Nordlinger 等人分析 1568 位 CRLM 患者的臨床數據,通過單因素和多因素分析研究不同因素的預后價值,提出Nordlinger Score 評分系統[6]。該評分系統包含 7 個危險因素:年齡>60 歲(1 分)、原發灶分期為T4 或N+(1 分)、無病間隔期<2 年(1 分)、CEA 水平>200 ng/mL(1 分)、最大肝轉移灶直徑≥5 cm(1 分)、轉移數目≥4 個(1 分)、手術切緣<1 cm(1 分)。根據總分將患者分為三個風險組,其2 年生存率有著顯著的差異:0~2 分為 79%,3~4 分為 60%,5~7 分為 43%。Nordlinger評分是最早的CRLM 患者肝轉移切除后預后風險評估系統,納入臨床實踐中易得的患者、腫瘤及手術特征,簡單有效。
1.2 CRS 評分
1999 年Fong 等人通過分析1001 例肝切除后CRML 患者的臨床及病理資料,建立CRS 評分系統[5],包括5 個危險因素:原發灶分期N+(1 分)、無病間隔期<12 個月(1 分)、肝轉移>1 個(1 分)、最大肝轉移灶直徑>5 cm(1 分)、癌胚抗原(CEA)>200 ng/mL(1 分),危險因素越多,生存率越低。0分者5 年生存率 60%,而 5 分者僅為 14%,0~2 分者與3~5 分者的5 年生存率分別為47%與24%,中位生存時間分別為74 個月與22 個月。相較于Nordlinger 評分,CRS 評分納入的危險因素更少,術前即可獲得,但仍可將低、中、高風險患者有效區分開來,較Nordlinger 評分更為簡便實用。
在CRS 評分后,有多個臨床預后評分系統被相繼提出。Iwatsuki 等人于1999 年將轉移灶分布在肝兩葉這一危險因素加入評分系統[7];2004 年Nagashima 等人及2008 年Rees 等人考慮了肝外轉移對預后的影響[8,9],但這些評分并未被廣泛使用。
1.3 m-CS 評分
CRS 等傳統臨床評分系統不包括腫瘤分子生物學信息,而RAS 基因突變在CRLM 患者中常見,約占20%~40%,與預后不良有關。Vauthey 等人研究發現RAS 基因突變的CRLM 患者3 年生存率為52.2%,低于RAS 基因野生型患者(81%)[10]。2017 年Brudvik 等人將RAS 突變這一危險因素加入評分體系,對CRS 評分進行改良,建立m-CS 評分[11]。該評分納入了以下三個危險因素:KRAS 突變(1 分)、原發灶分期N+(1 分)、最大肝轉移灶直徑>5 cm(1 分),m-CS 評分在相差1 分的風險分組之間的總體生存率即有顯著差異,而傳統評分為0 和 1、1 和 2、3 和 4 的患者之間沒有顯著生存差異,m-CS 評分相較傳統評分更優。
1.4 腫瘤負荷評分
2018 年Kazunari 等人提出了一種新的模型——腫瘤負荷評分(tumor burden score,TBS)[12]。用與最大腫瘤尺寸(x 軸)和病變數目(y 軸)相交的笛卡爾平面上距原點的距離定義,即:

并以扇形區域區分TBS<3、3≤TBS<9、TBS≥9 的 1、2、3 區,即低、中、高風險分組。Kazunari 等人使用了來自亞洲和歐洲的2 個外部隊列驗證了TBS 模型,其曲線下面積(area under the curve,AUC)為0.669,在預測總體生存率(overall survival,OS)方面優于最大腫瘤大小(AUC=0.619)和腫瘤數目(AUC=0.595)。隨著TBS 的增加,生存率逐漸下降(1 區、2 區和 3 區的 5 年生存率分別為 68.9%、49.4%和25.5%,P<0.05)。
其后,Mao等人基于TBS模型,加入手術切緣因素進行改良,發現R0切除患者有著更好的預后[13],進一步提高預測準確性。
1.5 GAME 評分
2018 年 TBS 模型提出后,Margonis 等人在 TBS模型基礎上建立一個新的預后評分系統:GAME(Genetic and Morphological Evaluation)[14]。研究人員對約翰霍普金斯醫院(JHH)接受CRLM切除術的一組患者進行分析,以尋找可在手術前評估患者總生存期(over all survival,OS)的獨立預測因素,隨后整合為CRLM 預后預測模型,并在外部患者隊列中進行驗證。GAME根據以下預測因素為每個患者評價預后得分:KRAS 突變(1 分)、CEA≥20 ng/mL(1 分)、原發瘤淋巴結轉移(1 分)、TBS 值在3 至8 之間(1 分)或大于9(2 分)和肝外轉移(2 分),依據得分將患者分為低風險組(0~1 分)、中風險組(2~3 分)及高風險組(≥4分)。JHH隊列中,高風險組的5 年OS 為11%,而低風險組為73.4%。在JHH和MSKCC 的隊列中(747 例患者)GAME 評分的預測能力均優于CRS 評分,證實了GAME 評分的有效性。GAME 是一個綜合形態學變量(TBS)和腫瘤分子生物學特征(KRAS 突變)的預后評分系統,在結直腸癌化療+靶向藥物的輔助治療時代具有更強的預測效能。
1.6 m-TBS 及 CERR 評分
2020年Chen等人基于中國患者隊列,對TBS及GAME進行改良,提出了CERR預后預測體系[16]:向TBS中引入CRLM雙葉轉移的系數,改良為mTBS:
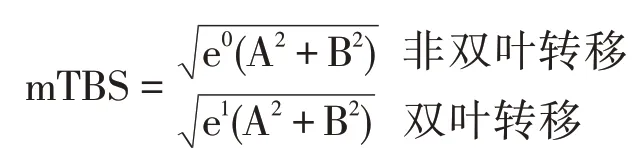
A=轉移瘤最大直徑
B=轉移瘤數目
e(自然常數)=2.71828
并將 KRAS 突變修改為 KRAS、NRAS 或 BRAF突變,將CEA指標修改為CEA或CA19-9指標,具體評分如下:KRAS/NRAS/BRAF 突變的腫瘤(1 分)、原發性腫瘤淋巴結轉移(1 分)、肝外轉移(1 分)、CEA>200 ng/mL 或CA19-9>200 U/mL(1 分)、mTBS在5到11之間(1分)或12以上(2分)。按其總分分組:低風險組(0~1 分)、中風險組(2~3)、高風險組(≥4)。其中低風險組3 年無復發生存期(relapsefree survival,RFS)為 39.90%,中位生存期為 23.7月;中風險組3 年RFS 為21.96%,中位生存期為12.7 個月;高風險組 3 年的 RFS 為 9.77%,中位生存期為7.3 個月。在該文章所使用的中國患者隊列中,CERR 評分體系較CRS 及GAME 相比具有更好的預后預測能力。
為了利于各個評分系統的比較,將常用的CRLM 預后評分系統列表如下,見表1。
2 CRLM 預后評分系統的臨床應用
2.1 預測CRLM 患者預后
經過20 余年的應用,CRS 評分受到了臨床醫生的廣泛認可。2004 年Mann 等人驗證它可以準確地預測患者的預后和生存[16]。2012 年 Shin 等人的研究發現,在肝切除后接受輔助治療的患者中,CRS 低(CRS≤2)和高(CRS>2)的患者的5 年生存率分別為88.5%和11.5%,有顯著差別;在初始不可切除的CRLM 患者中,化療后CRS 分數降低、并且最終接受手術切除的患者預后較優[17]。在我國,2015 年閏曉巒等人對比各個評分體系發現,Nordlinger 評分和CRS 評分在預測CRLM 患者術后總生存的準確性具有顯著差異(P<0.05),CRS 評分一致性指數為0.903,較Nordlinger 評分的0.872更高,預測效果最優[18]。
2.2 提升肝臟轉移灶的檢出率
CRLM 肝臟轉移灶多為多發,目前診斷依賴于肝臟增強磁共振或CT。肝臟轉移灶的R0 切除是提高CRLM 療效的關鍵,然而術前的影像學資料尚無法保證發現所有病灶,術中仔細探查以及術中B 超的應用有助于發現更多病灶,避免遺漏,對于肝轉移風險高的患者更應注意。
早在 2001 年,Jarnagin 等人分析 103 例計劃根治性切除的CRLM 患者病例,在剖腹行部分肝切除術之前進行腹腔鏡檢查,并分析CRS評分與探查結果、住院時間和住院費用間的關系[19]。研究發現,26 例患者存在術前影像學檢查未發現的無法切除病灶,而通過腹腔鏡探查發現14例,使其中10例患者免于接受開放手術。該研究還發現,CRS≤2 分的患者中,通過腹腔鏡發現不可切除病灶的僅有12%,而CRS>2 分的患者中有42%通過腹腔鏡檢查發現了不可切除的病灶;絕大多數CRS≤2 的并無法從腹腔鏡檢查中獲益,而對CRS>2 的患者術前進行腹腔鏡探查則可使一部分患者避免接受不必要的剖腹手術,減少住院時間及治療費用。2010 年Shah 等人研究發現,在術前進行腹腔鏡探查+肝臟超聲檢查(Staging laparoscopy and laparoscopic ultrasound,Lap+LUS)能夠發現一部分無法切除的病灶,在CRS≤2 分的患者中有7%發現了不可切除病灶,CRS>2 分的患者中有24%發現了不可切除的病灶;由此說明,CRS>2的患者可在術前進行Lap+LUS 檢查以避免接受不必要的剖腹手術[20]。
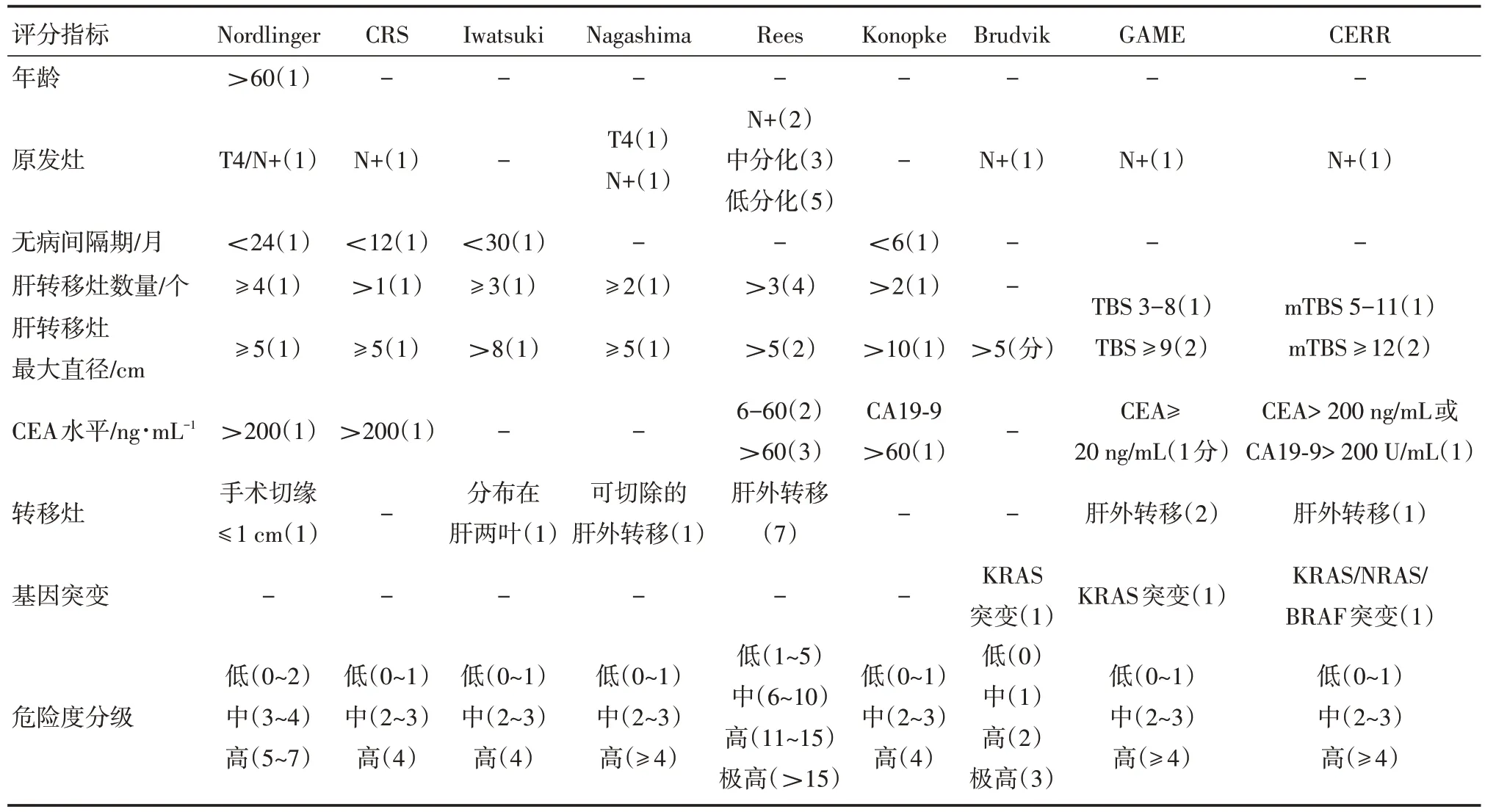
表1 不同CRLM 預后評分系統的比較
隨著影像學技術的進步,術前診斷的結果也越來越準確,而肝臟手術技術的不斷完善,術中才發現不可切除病灶的概率也在降低。然而基于可靠的CRLM 預后評分系統,對高危患者更多關注,可能有助于發現影像學遺漏的病灶,提高肝臟轉移灶的“真正R0 切除率”。
2.3 指導輔助治療及新輔助治療
CRLM 患者的療效提升,同樣也依賴于有效的全身治療。然而,不必要和過度的全身輔助治療不能提升療效,還會對患者身體狀況造成損害。目前對于結直腸癌患者,Ⅰ期和無高危因素的Ⅱ期患者并不主張術后輔助化療,IDEA 研究也建議對Ⅲ期結直腸癌患者術后化療時間可以縮短到3 個月[21]。CRLM 患者屬于Ⅳ期,常規推薦術后輔助化療。然而,2020 年美國臨床腫瘤學會(ASCO)年會發布一項結直腸癌肝轉移患者肝切除術后接受mFOLFOX6 化療或單純肝切除術的隨機Ⅱ/Ⅲ期臨床研究(JCOG0603 研究),結果卻顯示CRLM 患者肝切除術后采取輔助性mFOLFOX6 化療并不獲益[22]。2014 年,Rahbari 等人對 297 例 CRLM 術后患者進行了分析,發現在CRS>2 的高危患者中,術后輔助化療顯著提高生存率,而CRS≤2 的患者接受輔助化療后無明顯受益[23]。因此,基于有效預后評分系統,CRLM 患者術后輔助治療個體化選擇值得期待。
CRLM 患者是否需要新輔助治療,以及新輔助治療的方案,同樣是這一領域熱點問題。EPOC(40983)研究的中期結果顯示圍手術期化療可顯著延長初始可切除CRLM 的無進展生存期(progression-free survival,PFS)[24],然而其長期結果卻顯示圍手術期化療并不能明顯改善長期預后[25]。New EPOC研究顯示,CRLM患者術前使用西妥昔單抗聯合化療不能延長 PFS[26],據此,NCCN 指南將靶向藥物在CRLM 新輔助治療方案中剔除[27]。而ESMO 指南卻認為,對于生物學行為差、手術難度大的CRLM 患者,建議使用包括靶向藥物在內的新輔助治療方案[28]。2015 年,Ayez 的研究分析了363 例 CRLM 手術患者,并依據 CRS 評分分組,在低CRS(CRS≤2)組中,接受新輔助化療和未接受新輔助化療的患者之間的中位OS 無顯著差異,在高 CRS(CRS>2)組中,接受新輔助化療和未接受新輔助化療的患者之間的OS 差異顯著。該研究認為高CRS 患者可以受益于新輔助化療,而對于低CRS 患者,新輔助化療可能并無益處[29]。Ninos 等人發現,對于新輔助化療前的患者CRS 評分的預測效能較差,但是在新輔助化療后重新評估CRS 仍可用于預測預后[30],說明了對于新輔助化療的敏感性也是預測患者預后的重要因素,拓寬CRS 評分在目前CRLM 患者中應用的范圍。基于有效預后評分系統將CRLM 患者進行分層,探討新輔助治療的必要性以及具體方案,應該有助于CRLM 患者療效的進一步提升。
3 總結與展望
二十余年中,CRLM 預后評分系統的不斷更新換代,與其診斷及治療手段的進步密不可分。Nordlinger 和Fong 等人提出的評分體系根據80 年代和90 年代接受手術的患者得出,僅包含患者個人特征、簡單的腫瘤特征及手術信息。當時CRLM患者接受肝切除的指征更嚴格,圍手術期治療手段有限,因此Nordlinger 和CRS 評分用于現代患者存在局限性。在后續的各種改良評分中,患者年齡均未成為預后的不良因素,說明目前對于CRLM患者,年齡并不是絕對的全身治療與手術治療的禁忌。Kerstin 等人發現,在接受新輔助化療的患者中,包含肝外轉移因素的Nagashima 評分的評估效果更優[31]。Brudvik 等人將 RAS 突變這一危險因素加入評分體系建立的m-CS 評分相較傳統評分更優,說明了在CRLM 綜合治療的時代,RAS 突變對于CRLM 患者預后影響的重要性。
影響CRLM 預后的因素多種多樣,評分體系也應隨著診斷及治療手段的變化不斷完善。隨著影像資料三維重建技術的發展,對腫瘤形態的描述越來越精準;除此之外,不同原發灶位置(左半結腸/右半結腸)已被證明有著截然不同的分子生物學特點,并與CRLM 患者預后相關,在預后評分體系中加入原發灶的位置因素,或可更精確地預測患者復發風險[32]。未來免疫治療的普及,勢必會進一步提高CRLM 患者預后,并影響具有較好預后的患者特征。可以想見在未來,在腫瘤免疫、代謝、表觀遺傳等方面,每一個新發現的治療靶點和藥物,都可能會有一批對其敏感的患者因此獲益。在精準醫學時代,腫瘤預后評分體系不斷完善可以更好地幫助臨床醫生判斷CRLM 病人預后,避免過度治療或治療不足,使用更個體化的方法延長患者生命。

