兒童顳葉節細胞膠質瘤的臨床和MRI表現
馬慧靜,王永姣,翟愛國,楊豪,朱小虎,邵劍波
節細胞膠質瘤(ganglioglioma,GG)為顱內少見惰性腫瘤,2016年WHO中樞神經系統腫瘤分類中歸類于神經元和混合型神經元-膠質腫瘤,由膠質細胞和神經元細胞組成,良性程度高,預后好,WHO分級為Ⅰ級,約占中樞神經系統的0.4%~0.9%,GG可發生于任何年齡,從新生兒至80歲,但多見于兒童和30歲以下成人,GG占兒童顱內腫瘤的1%~4%。GG最常見的發生部位是顳葉,其次是額葉、頂葉和枕葉;松果體區、視神經、三叉神經、腦室、小腦、腦干、丘腦、鞍區或橋小腦角也有報道[1]。
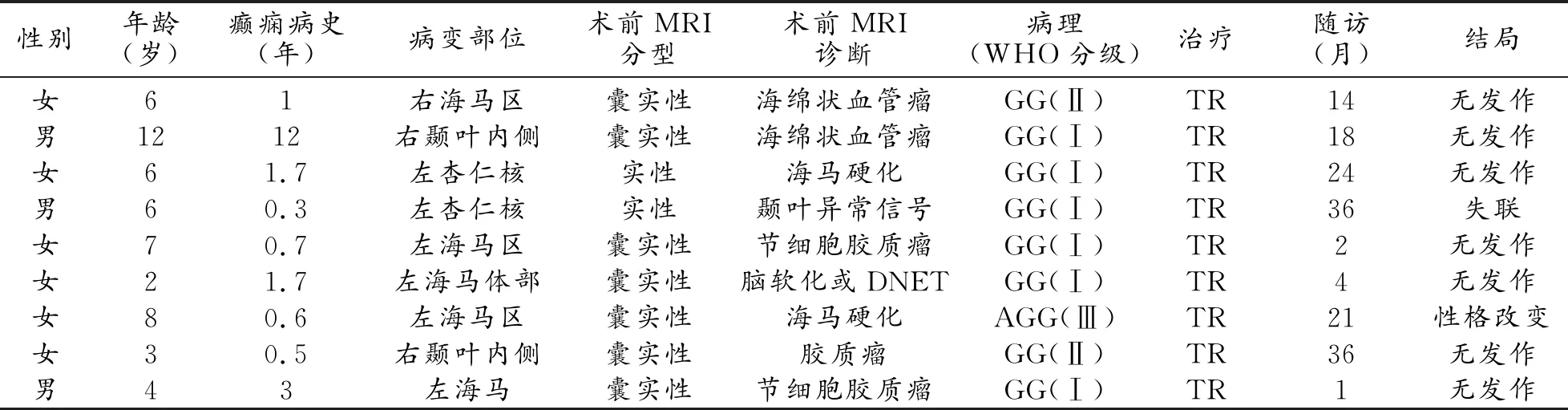
表1 9例GG患兒臨床影像資料
兒童顳葉GG臨床癥狀多表現為頑固性癲癇發作(特別是復雜的部分發作),也是兒童顳葉癲癇的常見原因之一,手術是主要的治療手段,且術后預后良好[2]。但由于顳葉GG影像表現多樣化且無明顯特異性,常常引起影像科醫師的誤診以及漏診,從而導致患兒得不到正確的治療。本文回顧性分析在本院經手術切除病理證實的9例兒童顳葉GG多模態影像表現,旨在提高對該病的診斷符合率。
材料與方法
1.一般資料
搜集2017年1月-2020年12月期間9例經病理證實為GG的患兒臨床及影像資料,男3例,女6例,年齡2~12歲,中位年齡6歲,8例臨床表現為癲癇,1例表現為嘔吐合并癲癇,癲癇病史4個月~12年,其中5例病史超過1年者經服用抗癲癇藥物治療,效果欠佳。
2.檢查方法
采用GE750超導3.0T MR儀 , 9 例均行常規T1WI、T2WI、FLAIR及增強掃描,T1加掃Bravo薄層序列,9例行DWI檢查,6例行磁共振波譜(magnetic resonance spectroscopy,MRS)檢查,6例行三維動脈自旋標記(three dimensional arterial spin labeling,3D ASL)檢查,3例行CT平掃檢查。掃描參數:T1WI(TR 1750 ms,TE 24 ms,層厚6 mm,層間距2 mm,激勵次數(NEX) 1,矩陣320×192),T2WI(TR 3500 ms,TE 102 ms,層厚6 mm,層間距2 mm,NEX 2,矩陣256×256),FLAIR序列(TR 8000 ms,TE 120 ms,層厚6 mm,層間距2 mm,NEX 1,矩陣288×224),Bravo序列(TR 8.4 ms,TE 3.3 ms,Prep Time 450 ms,層厚1.2 mm,NEX 1,矩陣256×256,翻轉角12°),DWI(EPI序列,TR 3000 ms,TE minimum,b值為1000 s/mm2);增強掃描采用對比劑Gd-DTPA,0.1 mmol/kg,MRS采用多體素PRESS序列(TE 144 ms),3D ASL灌注成像(TR 4613 ms,TE 10.6 ms,標記后延遲時間1525 ms)。
3.圖像觀察和分析
由兩名高年資主治以上MRI診斷醫生共同閱片,重點觀察病變部位、大小、形態、信號特點(鈣化、囊性、實性等)及強化方式、 程度[二個等級:輕中度、重度,評判標準:選取病灶最大強化區域作為興趣區(region of interest,ROI)進行測量,增強后信號強度減去增強前信號強度,按照計算值≤300為輕中度強化、>300為重度強化],是否有瘤周水腫(三個等級:無、平均直徑<10 mm為輕度、10~20 mm為中度)及占位效應[三個等級:無、輕中度、重度,評判標準:輕度 (臨近腦溝變淺,不影響形態)、中度(引起正常結構的變形,壓迫鄰近結構或中線結構偏移不超過1 cm)、重度(明顯變形及中線偏移超過1 cm)]。采用Functool軟件包對DWI、MRS、ASL等數據進行處理和分析。ADC值測量腫瘤實性部位,避開鈣化、囊性區域,測量對側正常腦實質的ADC值,測量3次取其平均值。MRS的ROI主要包括病灶實性部分及對側正常實質區。3D ASL的ROI主要測量腦血流量灌注偽彩圖上病灶最大腦血流量值(maximum cerebral blood flow,CBFmax)及對側鏡面區正常腦實質血流量(cerebral blood flow,CBF),計算相對血流量(reletive cerebral blood flow,rCBF),rCBF =CBFmax/CBF,測量三次取其平均值。
結 果
1.臨床表現
9例GG患兒臨床表現見表1。
2.病理

表2 9例GG多模態MRI表現
鏡下見腫瘤組織由相對成熟、腫瘤性膠質細胞和神經節細胞組成,CD34、Syn、NeuN、GFAP陽性染色。
3.MRI多模態表現
9例GG多模態MRI表現見表2及圖1~4。
9例病變均位于顳葉內側,皮層均見受累,3例累及深部白質,鄰近骨質均未見壓迫侵蝕性改變。4例缺乏正常腫瘤形態,無法準確測量大小(圖1)。囊實性7例,實性2例,3例腫塊行CT檢查內見高密度鈣化影(圖2c),MRI表現為短T1短T2信號,實性部分表現為等T1稍長T2信號,FLAIR信號稍高,囊性表現為長T1長T2信號,增強方式多樣(圖3c、4b)。
腫塊最小ADC值為(0.86~1.2)×10-3mm2/s,平均(0.97±0.11)×10-3mm2/s,對側正常腦實質最小ADC值為(0.75~1.16)×10-3mm2/s,平均(0.89±0.11)×10-3mm2/s。
6例行3D ASL檢查,1例WHO Ⅱ級呈高灌注,5例WHOⅠ級,其中3例呈等或低灌注(圖3d),2例呈高灌注(圖1f)。腫瘤CBFmax 32~126 mL/(min·100g),平均79±35 mL/(min·100g),對側正常腦實質區CBF 35~75 mL/(min·100g),平均55±14 mL/(min·100g),rCBF 0.80~2.29,平均1.42±0.58。
MRS:NAA峰降低(圖3e),Cho/Cr、Cho/NAA和NAA/Cr比值均值分別為1.45、1.95和0.75,對側正常區比值均值分別為1.39、0.84、1.16。與對側正常區相比,GG的NAA/Cr比值降低,Cho/Cr和Cho/NAA比值增加。
討 論
GG通常在診斷前有一個良性的臨床過程,癥狀持續時間長,本組中患兒癲癇病史從4個月到12年,其中5例患兒癲癇病史超過1年,經服用抗癲癇藥物治療,效果欠佳。早期認識對治療和患者咨詢具有重要意義。本組僅2例患兒術前考慮GG后神經外科立即進行了顱內腫瘤全切術,余7例患兒中,術前均未能準確診斷,可見誤診率較高。
1.GG的常規MRI特征
GG根據囊內成分一般可分為三種:囊性、囊實性和實性,囊性指腫瘤無實性成分,囊實性指腫瘤內囊實性成分;實性指腫瘤中無囊性成分,以囊實性多見。
腫塊部位是GG較有特征性征象,多位于顳葉內側較表淺部位,皮層或皮層下,以海馬和杏仁核區多見。灶周水腫以輕度為主;術前多次檢查病變范圍無明顯變化,這都是呈良性腫瘤表現[3]。
囊狀影是GG最常見征象[4],發生機制可能與腫瘤的缺血壞死或腫瘤細胞自身分泌囊液有關,多表現為單個,呈小圓形或類圓形,大小不一,部分病例厚層顯示小囊狀影較困難,僅在薄層序列上顯示,本組病例全部加掃薄層以顯示腫瘤內部細微結構。
局限性鈣化是第二常見征象[5],呈片狀、圓形或砂礫狀,MRI上呈短T1短T2信號,經CT平掃驗證為鈣化,非出血、脂肪、其他順磁性物質等。
本研究GG病例未見瘤內出血征象,文獻亦報道GG罕見出血[6]。
實性GG多表現為皮層增厚,周圍腦溝輕度受壓。實性成分多呈等T1稍長T2信號,FLAIR呈稍高信號,與周圍腦實質分界欠清。
必須強調的是,GG的診斷不能僅通過CT或MRI陰性檢查來排除。文獻[7-9]也有報告說,在CT或MRI圖像上,沒有一個可識別的腫瘤,組織學上證實了神經節細胞瘤的存在。本組有2例患兒家長訴早期癲癇時行CT或MRI平掃未見異常征象。
與文獻報道不一致的主要表現為以下三個方面:①強化方式:文獻報道[10-12]GG強化多樣,可呈無強化、片絮狀強化、條紋狀強化、環形強化、明顯不均勻強化以及明顯壁結節樣強化,但以強化多見,本組病例以無強化為主,僅1例為典型的壁結節樣強化。②邊界:文獻報道多較清,本組GG邊界多不清,術中也證實腫塊多與周圍組織分界不清。③對于無明確腫瘤形態者僅表現為小片狀T2WI、FLAIR序列稍高信號影很少見文獻提及,但此類表現在GG中并不少見,術前較易誤診為海馬軟化灶或硬化,此時建議多平面薄層掃描及增加功能序列觀察病變形態及征象以幫助鑒別。

圖1 女,2歲,癲癇病史1年7個月,GG(Ⅰ級)。a)橫軸面T1WI示左海馬體部小片狀長T1信號影;b)T2WI呈稍高信號;c)FLAIR序列呈稍高信號(箭),附近腦溝變淺不明顯;d)矢狀面薄層FLAIR見海馬體部小圓形囊狀影(箭);e)增強病變未見強化;f)ASL序列示左海馬體部較對側灌注高。 圖2 女,6歲,癲癇1年7個月余,左杏仁核實性病灶,GG(Ⅰ級)。a)橫軸面T1WI示左杏仁核皮層增厚,體積變大,呈等T1信號,臨近腦溝變淺,顳角受壓;b)T2WI示左杏仁核內側條形短T2信號;c)CT顯示杏仁核高密度鈣化;d)DWI呈等信號;e)ADC圖顯示較右側杏仁核信號稍高,較對側高。
2.多模態MRI表現
DWI:腫瘤實性成分DWI呈等信號,ADC圖像上為等或稍高信號,平均最小ADC值為(0.97±0.11)×10-3mm2/s,呈等或略高于對側顳葉正常腦實質ADC值,顯示水分子擴散無受限狀態,可能與GG的病理基礎有關,GG的腫瘤間質內液體含量豐富、神經元呈漂浮狀表現及束狀神經軸束附著到少突膠質樣細胞,形成松散的黏液基質,導致腫瘤內未結合水分子運動空間增大、擴散明顯;本組與文獻報道[13]顱內GG的平均最小ADC值(1.45±0.20)×10-3mm2/s有所出入,可能與樣本組年齡、病變部位不一樣有關。
MRS:NAA峰減低,與對側正常區相比,GG的NAA/Cr比值降低,Cho/Cr和Cho/NAA比值增加,與文獻[14]報道一致,文獻亦報道通過MRS可鑒別GG與膠質瘤,GG中Cho/Cr比值低于膠質瘤,NAA/Cr比值高于膠質瘤,證實GG具有腫瘤神經元成分。
3D ASL:作為無創傷灌注成像序列,能客觀反映腦腫瘤的微循環灌注情況、腫瘤組織微血管的生成情況及侵襲程度等,在常見腦腫瘤的診斷及膠質瘤的分級中有很好的應用價值,已經在成人腦腫瘤及部分兒童腫瘤中加以應用,但在本組6例行ASL檢查的患兒中,WHO分級為Ⅰ、Ⅱ級,灌注表現各異,高、等、低灌注均有表現,出現與文獻報道用ASL判斷腫瘤級別不一致的情況,也許腫瘤增強、血管再生與腦灌注之間存在一個復雜的關系或者與本研究樣本量少有關[15],尚需進一步總結研究。
3.鑒別診斷

圖3 男,4歲,癲癇病史3年,左顳葉囊實性病灶,GG(Ⅰ級)。a)橫軸面T1WI示左海馬頭部囊實性病變,可見壁結節;b)T2WI示灶周輕度水腫;c)增強可見壁結節強化;d)ASL是病變呈等低灌注;e)MRS示病變實性成分區CHo升高,NAA峰下降。 圖4 女,6歲,癲癇病史5個月余,GG(Ⅱ級)。a)右顳葉內側較大囊實性腫瘤,多個囊,大小不一,中度水腫,輕中度占位,最小ADC值為0.86×10-3mm2/s; b) 增強可見實性呈環形或結節狀明顯強化。
①海綿狀血管瘤:海綿狀血管瘤T2WI序列上表現為典型的周邊低信號“含鐵血黃素環”,邊緣稍模糊,病灶周圍未見水腫、占位征象,由于病灶反復出血,MRI信號混雜,常見于額、顳葉深部髓質區、皮髓質交界區和基底節區,含鈣化GG容易與血管瘤混淆,兩者好發部位不同;②DNT:位于顳葉皮層內,呈長T1長T2囊性信號,FLAIR序列呈低信號,周圍無水腫及占位表現,內部多見分隔,一般無強化,有時難以鑒別;③顳葉軟化或海馬硬化:部分GG呈小片狀FLAIR稍高信號影,容易與軟化灶混淆,導致病情延誤,建議行薄層掃描,仔細觀察病變有無占位效應來加以鑒別;④多形性黃色星形細胞瘤:常見于青少年,顳葉多見,常表現為囊變伴壁結節,增強示結節強化伴鄰近腦膜增強-腦膜尾征;⑤膠質瘤:周圍水腫和腫瘤分界不清的膠質瘤比GG更常見,MRI或MR灌注成像、MRS結合病變部位有助于鑒別GG和膠質瘤。
本研究不足之處:樣本量小,兒童節細胞膠質瘤相對少見,且兒童在MRI檢查工作中受鎮靜效果限制,難以長時間檢查,故獲取大樣本病例數據及功能MRI較為困難,導致無法進一步行統計學分析。
總之,兒童患者,臨床表現為癲癇,尤其是長期藥物難治性癲癇,MRI表現為發生于顳葉內側皮層區的異常征象,呈囊實性、實性、無水腫或輕度水腫、強化不明顯或結節狀強化,應考慮診斷本病的可能,尤其對于無明確腫瘤形態的顳葉內側FLAIR序列異常征象,更應警惕注意甄別GG的發生,以達到早期診斷并選擇合適的治療方法的目的,從而減少兒童心理及家庭負擔。但最終仍需依賴病理學確診。