荊州地區玉米鞘腐病病原菌鑒定及生物學特性分析
周雙針,王 康,杜何為,2,黃 敏*
(1.長江大學生命科學學院,湖北荊州 434025;2.長江大學主要糧食作物產業化湖北省協同創新中心,湖北荊州 434025)
玉米(Zea maysL.)是我國重要的糧食作物,據國家統計局數據顯示,2019 年我國玉米的年產量為2.61億噸,播種面積為4 128萬公頃,是我國第一大糧食作物[1]。隨著秸稈還田、免耕直播、地膜覆蓋等耕作栽培方式的廣泛運用,玉米品種更新換代及全球氣候變暖,導致玉米病蟲害持續加重,給玉米產量造成嚴重損失[2]。玉米鞘腐病是玉米生長發育過程中的主要病害之一,該病主要在玉米開花期至乳熟期發生,為害玉米葉鞘部位,發病時往往出現不規則形狀的糜爛狀病斑,顏色以褐色為主,嚴重時可蔓延至整個葉鞘,致使葉鞘干腐死亡,嚴重影響玉米的產量[3-4]。分離玉米鞘腐病的致病原菌,探明其生物學特性,對玉米鞘腐病的防治具有重要意義。
玉米鞘腐病最早在美國報道,該病在玉米抽絲期發生,侵染葉鞘[5]。2008年,徐秀德等通過采集遼寧省、吉林省和黑龍江省的自然病株,采用常規的植物病理學和分子生物學相結合的方法,將該病的病原菌鑒定為層出鐮孢菌(Fusarium proliferatum)[6]。隨后,胡蘭等對該病原菌的生物學特性進行了研究,發現其生長的最適溫度為28 ℃,最適pH 值為5~6,分生孢子萌發適溫為25~30 ℃[7]。玉米不同種群對玉米鞘腐病的抗性不同,2019年,渠清等從玉米16個自交系所在的種群中發現,蘭卡斯特群和唐四平頭群對玉米鞘腐病表現為抗病[8]。
近年來,湖北地區玉米鞘腐病的發病程度越來越嚴重。本研究通過采集湖北荊州長江大學試驗地(東經112°14′,北緯30°35′ )中的玉米鞘腐病病株,采用基本的植物病理學方法鑒定病原菌種類,探究荊州玉米鞘腐病病原的生物學特性,為該地區玉米鞘腐病的綜合防治和深入研究提供依據。
1 材料與方法
1.1 樣本采集
2019 年6 月,從湖北省荊州市長江大學玉米試驗地采集表現出典型玉米鞘腐病癥狀的玉米病株,用于病原菌分離。
1.2 培養基
馬鈴薯葡萄糖瓊脂培養基(PDA)[9],查氏培養基(Czapek)[9],綠豆煎汁培養基(LD,用于誘導大型分生孢子的產出)[10]。
1.3 病原菌分離與純化
參考曹興等的方法[11],將采集的玉米葉鞘沿病健交界處剪成2~3 mm2大小,表面消毒后置于PDA平板上,25 ℃恒溫倒置培養3~5 d。挑取組織周圍菌絲,轉接于另一新的PDA 平板上。培養一周后,用無菌水制成孢子懸浮液,進行單孢分離并純化。將純化好的真菌分離物用直徑為5 mm 的打孔器打成菌餅,轉入裝有1 mL 25%甘油的1.5 mL離心管中,置于-70 ℃超低溫冰箱保存備用。
1.4 病原菌鑒定
1.4.1 形態學鑒定
參考盧維宏等的方法[12],將分離的菌株接種在9 mm 的PDA 平板上,25 ℃下培養5 d,觀察菌落形態;在顯微鏡下觀察分生孢子形狀及大小,并拍照記錄。參照孫華等的方法[13],確定菌株的屬和種。
1.4.2 分子生物學鑒定
參考張穎慧等改良的絲狀真菌DNA 提取方法[14],挑取在PDA 平板上生長6 d的病原菌菌絲,采用CTAB法提取真菌DNA。對rDNA-ITS序列進行擴增,選擇的引物為:ITS1(5′ -TTCCGTAGGTGAACCTGCGG-3′ )和ITS4(5′ -TCCTCCGCTTATTGATATGC-3′ )[15]。PCR 產物經純化后送至生工生物工程(上海)股份有限公司測序。測序結果在NCBI 數據庫(http://www.ncbi.nlm.gov)中進行同源性檢索,采用MEGA7.0 軟件的Neighbor-Joining 法構建系統進化樹[16]。
1.5 致病性測定
將普通牙簽高溫滅菌并去除有毒物質后接種,轉入Fg-1 的PDA 平板上,25 ℃培養至真菌長滿整個牙簽備用。根據柯赫氏法則,在玉米試驗田中,采用牙簽接種法[17],以開花期的玉米植株作為接種對象,用無菌穿刺器在其葉鞘部位穿刺后,將長滿菌絲的牙簽直接插入孔中,保濕培養,以沾滿無菌水的牙簽做空白對照,每處理5次重復。3 d后觀察接種部位的發病情況并拍照記錄。將接種真菌和接無菌水(對照)的葉鞘均按照“1.3”節的步驟獲得再分離菌株,并觀察再分離菌株和原接種病菌的形態差異。
1.6 病原菌生物學特性測試分析
1.6.1 溫度對菌絲體生長和大型分生孢子萌發的影響
參考李俊香等的方法[18],將保存在-70 ℃冰箱中的病原菌轉接于PDA 平板上,置于25 ℃恒溫暗培養5 d,沿著菌落的邊緣打取直徑5 mm 的菌餅,接種在9 mm 的PDA 平板中央,依次放入溫度為5、10、15、20、25、28、30、35、40 ℃的恒溫培養箱中,每個處理設3 個重復,從第1 天開始,每天同一時間觀察菌絲的生長情況及菌落的顏色、形態等,第5 天用十字交叉法測量菌落直徑。
將活化后的病原菌用直徑為5 mm 的無菌打孔器沿著菌落邊緣打取菌餅,取5 片菌餅置于100 mL 綠豆煎汁液體培養基中,25 ℃,150 r·min-1暗培養3 d,然后用4 層無菌紗布過濾菌絲,濾液即為分生孢子液[19]。血細胞計數板測定孢子懸浮液的濃度,用無菌水將孢子懸浮液的濃度調至106個/mL。參考李俊香等的方法[18],將孢子懸浮液充滿血細胞計數板的計數區,用顯微鏡觀察并計算計數區的大型分生孢子總數,然后將其放置在溫度為5、10、15、20、25、28、30、35、40 ℃的恒溫培養箱中,保濕培養。每處理3次重復。暗培養8 h 后,用顯微鏡觀察并計算計數區的已萌發的大型分生孢子數目。計算大型分生孢子萌發率,公式如下:

1.6.2 pH對菌絲體生長的影響
參考李俊香等的方法[18],用1 mol·L-1NaOH 溶液和1 mol·L-1HCl 溶液將PDA 培養基的pH 值依次調節為4.0、6.0、7.0、8.0、9.0、11.0。將病原菌菌餅依次接種至不同pH 值的PDA 平板中央,每處理3 次重復。第5 天用十字交叉法測量菌落的直徑,計算菌絲的日生長量,觀察菌絲的生長情況及菌落的顏色、形態等。
1.6.3 碳源對病原菌的影響
參考李俊香等的方法[18],以察氏培養基(Czapek)為基本培養基,分別用等量的可溶性淀粉、麥芽糖、木糖、葡萄糖、乳糖、蔗糖和牛肉膏作為7 種不同的碳源進行碳源替換。將活化的病原菌菌餅依次接種至不同碳源的察氏培養基中央,每處理3次重復。從第1天開始,每天同一時間觀察菌絲的生長情況及菌落的顏色、形態等,第5天用十字交叉法測量菌落直徑。
1.6.4 氮源對病原菌的影響
方法同“1.6.3”節所述,分別用等量的硝酸鉀、硫酸銨、氯化銨、尿素、蛋白胨、酵母膏作為6 種不同的氮源對察式培養基中的氮源進行替換。將活化的病原菌菌餅依次接種至不同碳源的察氏培養基中央,每個處理設3 個重復。從第1 天開始,每天同一時間觀察菌絲的生長情況以及菌落的顏色、形態等,第5天用十字交叉法測量菌落直徑。
2 結果與分析
2.1 病害癥狀
自然條件下,玉米在大喇叭口期開始發病,發病初期,葉鞘出現零星褐色小點,后逐漸擴展,多個病斑匯合形成不規則形斑塊,蔓延至整個葉鞘(見圖1a),葉鞘內側褐變重于葉鞘外側,伴隨著葉片上有零星斑點,主葉脈出現褐色病斑,并不斷延伸,最終布滿整個主葉脈(見圖1b)。在玉米感病植株中,病斑由下至上,發病后期可蔓延至雄穗,導致植株干腐死亡(見圖1c)。
2.2 病原菌分離鑒定
2.2.1 病原菌分離及形態學鑒定

圖1 玉米鞘腐病田間癥狀
通過10 個發病葉鞘樣品的病菌分離,共得到8 個菌株,菌落形態完全一致,經單孢純化后得到1 株鐮孢菌菌株(Fg-1)。Fg-1 在PDA 平板上25 ℃培養5 d,菌落呈圓形,菌絲生長旺盛,分泌粉紅色色素,后期中央菌絲體由白色轉為淡黃色(見圖2a、2b);分生孢子無色,呈鐮刀狀,有2~5個隔膜,中間寬兩頭尖,大型分生孢子大小為(3~6)μm×(14~35)μm,平均4.3 μm×24 μm;沒有觀察到小型分生孢子的出現;無厚垣孢子(見圖2c)。

圖2 Fg-1菌落及分生孢子形態
2.2.2 分子生物學鑒定
采用真菌通用引物ITS1 和ITS4 對Fg-1 的16S rD?NA-ITS 區域進行PCR 擴增,1.0%凝膠電泳后,在500 bp 處得到一條清晰的條帶(見圖3)。經測序,菌株Fg-1 的ITS 片段長度為521 bp,GenBank 中的登錄號為MW133760。將菌株Fg-1的ITS序列與GenBank中的已知序列進行比對,發現與Fusarium graminearum(KY272768.1)相似度為99.42 %。用MEGA 7.0 中的Neighbor-Joining法構建系統發育樹(見圖4),Fg-1 與F.graminearumFUS89(MK630106.1)、F.graminearumHS42(KY426428.1)聚在同一個分支上。綜上所述,明確將菌株Fg-1 鑒定為禾谷鐮孢菌(Fusarium graminearum)。
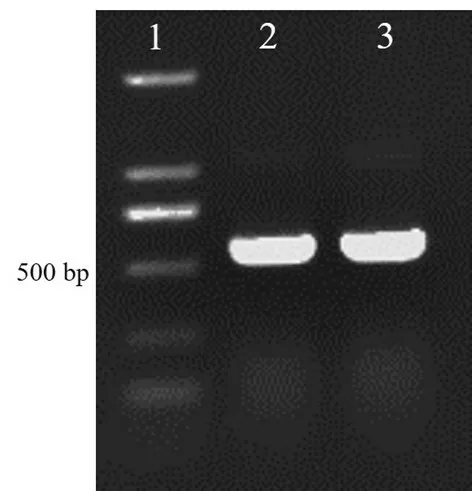
圖3 rDNA-ITS序列PCR結果
2.3 致病性測定
將分離得到的Fg-1菌株經田間活體植株回接至玉米葉鞘上,接種5 d 后,在接種部位均出現發病癥狀,病斑呈褐色不規則形,中央腐爛變干,與田間癥狀類似,對照不發病(見圖5)。從發病組織中均能再次分離得到與初分離菌株相同的分離物,符合柯赫氏法則,證明Fg-1菌株是引起玉米鞘腐病的致病原菌。

圖4 基于rDNA-ITS序列分析構建的系統發育樹

圖5 Fg-1接種至玉米葉鞘的侵染情況
2.4 Fg-1生物學特性測定
2.4.1 溫度對菌絲生長及分生孢子萌發的影響
溫度試驗結果表明,在10~35 ℃范圍內,菌株Fg-1均能生長,在20~30 ℃范圍內生長較快,第5天菌落直徑大于6.0 cm,其中25 ℃菌落直徑為8.5 cm,說明25 ℃時Fg-1生長速度最快(見圖6)。5~10 ℃菌絲體生長緩慢,35~40 ℃基本停止生長。將5 ℃培養5 d 的菌株Fg-1 恢復至25 ℃培養,發現菌絲能繼續生長;而40 ℃下培養5 d 的菌株移至25 ℃培養,發現菌絲停止生長,說明低溫只是延緩菌絲生長,而高溫則容易導致菌株死亡。
在5~35 ℃,菌株Fg-1 的分生孢子均能萌發,在20~28 ℃,萌發率較高(>25%),最適萌發溫度為25 ℃,萌發率達32%;而高于40 ℃時,分生孢子無法萌發。在一定溫度范圍內,升高溫度對Fg-1的孢子萌發有促進作用,但是溫度超過35 ℃,分生孢子的萌發將會受到嚴重抑制(見圖6)。
2.4.2 pH對菌絲生長的影響
試驗結果顯示,病菌在pH 值4.0~11.0 范圍均能生長,在pH 值為6.0~9.0菌絲的生長情況較好,其中最適生長pH 值為7.0,菌落在第5 天直徑為8.37 cm,菌絲日生長量1.67 cm,菌落飽滿,菌絲密度最大;過酸(pH=4.0)與過堿(pH=11.0)時,菌絲生長較CK極顯著減緩,菌落厚度較薄(見表1)。說明菌株Fg-1生長的最適pH值為7.0。

表1 不同pH條件下Fg-1的生長情況
2.4.3 碳源對Fg-1菌絲體生長的影響
由圖7 可以看出,菌株Fg-1 在供試的7 種碳源培養基上均可生長,但生長速度存在顯著差異。以牛肉膏為碳源時,菌絲生長速度最快,菌絲生長最旺盛,第5 天菌落直徑達8.5 cm。以木糖為碳源時,菌絲生長最慢,菌落直徑只有3.75 cm,菌落厚度偏薄。以蔗糖、可溶性淀粉為碳源時,菌絲生長速度較慢,菌落直徑為7 cm 左右,菌落厚度較厚,顏色為白色,色素積累較少。即Fg-1菌株對牛肉膏的吸收效率最高,對木糖的吸收效率最低。

圖7 菌絲在不同碳源培養基上的生長
2.4.4 氮源對Fg-1菌絲體生長的影響
由圖8 可以看出,菌株Fg-1 在供試的6 種氮源培養基上均能生長,其生長速度和菌落形態均存在顯著差異。其中,以酵母膏為氮源的培養基更有利于Fg-1的生長,第5 天菌落直徑達7.9 cm,菌絲生長速度達1.56 cm·d-1,菌絲濃密,菌落較厚,分泌色素為淡粉色;其次是以硝酸鉀為氮源的培養基,其菌落直徑為6.5 cm,菌絲生長速度1.3 cm·d-1,菌絲稀疏,菌落較薄,無色素分泌;以氯化銨為氮源的培養基,菌絲生長速度最慢,只有0.9 cm·d-1,菌落出現水漬狀的形態,且菌絲稀疏,菌落較薄。
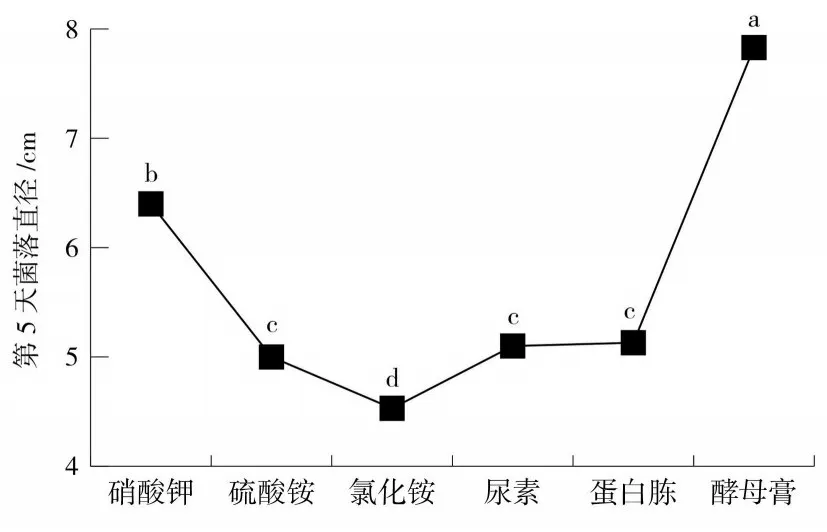
圖8 菌絲在不同氮源培養基上的生長
3 結論與討論
3.1 湖北荊州玉米鞘腐病病原菌的分離與鑒定
本課題組從湖北荊州地區采集到的玉米鞘腐病組織中分離得到1株真菌Fg-1,經致病性驗證、形態學鑒定及分子生物學鑒定,確定為禾谷鐮孢菌(Fusariumgraminearum)。2008 年,徐秀德等從遼寧、吉林和黑龍江等地采集到玉米鞘腐病的病株,首次將玉米鞘腐病的病原菌鑒定為層出鐮孢菌(Fusarium proliferatum),該真菌的氣生菌絲為絨毛狀至粉末狀,培養基背面為橙黃色,有大小型分生孢子[6]。從玉米鞘腐病組織中分離得到禾谷鐮孢菌,本文屬首例報道。據文獻報道,禾谷鐮孢菌分布廣泛,可為害多種植物,在小麥中,禾谷鐮孢菌主要引起赤霉病的發生,在開花期侵染穗部小花,在籽粒灌漿成熟過程中不斷繁殖[20];在玉米中,該菌還可侵染根部[21]、莖部[22]、穗部[13],造成侵染部位的腐爛,影響植株的正常生長,導致產量降低。
3.2 病原菌Fg-1的生物學特性
據報道,引起茭白采后腐爛的禾谷鐮孢菌最適生長溫度為25 ℃,致死溫度為55 ℃,最適產孢pH 值為6.0[23];百合鱗莖禾谷鐮孢菌的最適生長溫度為30 ℃,最適生長pH 值為8.0[24];四川雅安玉米青枯病致病菌禾谷鐮孢菌的最適生長溫度為25~30 ℃,35 ℃生長受到抑制,最適pH 值為7.0,察氏培養基最適碳源為葡萄糖,最適氮源為蛋白胨,其次是以硝酸鉀和尿素為氮源[25]。本研究發現,玉米鞘腐病致病菌禾谷鐮刀菌(Fg-1)的最適生長溫度為25 ℃,致死溫度為40 ℃,最適pH 值為7.0,察氏培養基最適碳源、氮源分別為牛肉膏、酵母膏。由此可見,相同培養條件下的禾谷鐮孢菌,在不同寄主和不同地區,其生物學特性有所不同,可能與該菌的寄主及其地區不同有關。
3.3 病害防治
湖北荊州地區的菌株Fg-1 在5~35 ℃均能存活并且在pH 值為4.0~11.0 的條件下均能生長,說明荊州的禾谷鐮孢菌在玉米鞘腐病病殘體上可以安全越過冬夏,成為下一季植物的侵染源,并且荊州氣候潮濕,在夏季梅雨期更有利于禾谷鐮孢菌的萌發和生長。隨著秸稈還田、免耕直播等技術的廣泛推廣及應用,更會加重病菌在田間的繁殖。建議在發生病害的田間,不要采用秸稈還田、免耕直播等耕作方法。據報道,氰烯菌酯、氟唑菌酰羥胺、丙硫菌唑及氟環唑等殺菌劑均可以對禾谷鐮孢菌產生毒性,但是為了延緩抗藥性的產生,延長殺菌劑的使用年限,高效防治禾谷鐮孢菌病害,建議在防治過程中輪換使用藥劑,或者將不同作用靶標的藥劑混配使用[26]。

