SC-ICP-MS法測定金屬元素的方法研究
傅 霜,趙珍陽,龔子珊,王世功,田中朝,孫傳強,趙玉新,張 勇,汪 曣*
(1.天津大學 精密儀器與光電子工程學院,天津 300027;2.山東東儀光電儀器有限公司,山東 煙臺 264000)
金屬組學[1]被定義為一門研究生物中金屬及類金屬的學科,旨在理解金屬及類金屬元素的生物功能、化學結構和生物用量,是對基因組學、蛋白質組學等學科的必要補充。目前,已有大量文獻報道了使用電感耦合等離子體質譜法(ICP-MS)檢測人體血清、尿液中金屬元素含量[2]。近些年,單細胞內金屬元素含量的檢測逐漸成為研究熱點[3]。針對細胞中目標元素含量少、基質復雜等特點,常采用酸消化細胞后再進行ICP-MS測定。單個細胞的元素含量顯示為細胞群體的平均值[4],但該法無法體現細胞之間在元素含量上的固有差異,掩蓋了可能由基因、蛋白質、代謝物等產生的細胞異質性[5]。隨著ICP-MS在儀器技術和軟件上的發展,探索測定單個細胞中的各元素含量逐漸成為可能,這種方法被稱為單細胞電感耦合等離子體質譜(Single cell ICP-MS,SC-ICP-MS)法[6]。通常以直接霧化的方式將細胞懸液中的細胞引入電感耦合等離子體(ICP)[6-8],此后單個細胞被電離產生一團離子云,在優化后的時間分辨模式下被檢測形成非連續信號,信號的強度與每個檢測到的細胞中目標元素的含量相關,信號的數量與溶液中的細胞密度相關[7]。該法在單細胞內源性元素、細胞吸收或吸附金屬元素和納米粒子等分析研究中應用較多,對醫學、藥學和生物學等具有十分重要的意義。
超聲波在液體中的空化作用可以將細胞擊碎,Li等[9]使用超聲波裂解細菌后檢測到的U+信號強度增加30%,證明細胞破碎后可檢出更多分析物,其操作相對消解細胞更簡便快捷,且樣品中避免了化學試劑的引入。由于缺少細胞標準物質,通常用酸消解細胞后進行ICP-MS檢測得到的元素平均值驗證SC-ICP-MS檢測單細胞元素含量的準確性,驗證方法單一且不完全準確。基于此,本文采用細胞懸液直接進樣、經過超聲波探頭作用的破碎細胞溶液進樣和消解細胞溶液進樣,通過3種樣品前處理方式對SC-ICP-MS定量結果的準確性進行驗證。首先分析了動態反應池參數、進樣速度、細胞密度和駐留時間對SC-ICP-MS準確檢測的重要作用,然后在優化條件下,使用SC-ICP-MS方法測定HeLa細胞中5種金屬元素,并對各元素的單細胞瞬時信號圖和直方圖分布進行詳細分析。最后,從不同角度的總體細胞水平分析SC-ICP-MS方法測量結果的準確性,并證明了缺乏細胞標準物質時對此方法定量結果的多角度驗證是必要的。
1 實驗部分
1.1 儀器與試劑
Perkin Elmer NexION 300D電感耦合等離子體質譜儀(美國Perkin Elmer公司),配Asperon單細胞霧化室及Syngistix納米顆粒應用模塊,可提供對單細胞/單顆粒的分析;BPN-80CRH CO2培養箱(上海一恒科學儀器有限公司);Milli-Q超純水系統(美國Millipore公司);倒置顯微鏡(德國蔡司公司);血球計數板(上海求精生化試劑儀器有限公司);臺式低速離心機(上海托莫斯科學儀器有限公司);BSAI24S電子天平(德國Sedolis公司);HUP-100手持式超聲波細胞破碎儀(天津恒奧科技發展有限公司)。
HeLa細胞系(中原公司);高糖DMEM細胞培養基、胰蛋白酶消化液(0.25% Trypsin-EDTA)和胎牛血清(FBS)(Gibco公司);1xPBS緩沖液(Genview公司);4%多聚甲醛細胞固定液(Thermo Fishier公司);65%濃硝酸(HNO3)(Merck公司);包含Be、Mg、In、Fe、Li、Pb、U和Ce的1.0 μg/L多元素調諧液(Perkin Elmer公司);10 mg/L多元素標準儲備液(Agilent公司);NH3(純度99.999%,天津威斯特氣體公司)。
1.2 細胞培養與樣品前處理
1.2.1 細胞培養與SC-ICP-MS檢測樣品的制備培養HeLa細胞的完全培養基由90%的高糖DMEM和10%(體積分數)的胎牛血清(FBS)配制,且細胞處于含5% CO2的37 ℃培養箱中生長。待細胞貼壁融合超過80%,用胰蛋白酶消化細胞,輕輕吹打使細胞離壁,收集細胞懸液,以1 000 r/min離心5 min后去掉上清液,用4%多聚甲醛固定細胞20 min,固定后離心去掉多聚甲醛溶液,再用PBS溶液重復清洗3次后重懸于超純水中。對細胞懸液進行不同處理前在倒置顯微鏡下用血球計數板對待測溶液中的細胞進行計數,以制備所需細胞密度的樣品。上機測試前,顯微鏡下觀察到細胞懸液中細胞大小不一,近乎圓形且大都處于單一分散狀態(圖1)。
1.2.2 方法驗證樣品的制備3種細胞樣品來自同一批細胞,制備相同細胞密度的細胞懸液。用于直接進樣的細胞懸液稱為完整細胞;將超聲波細胞破碎儀的工作脈沖調整為最低檔,將超聲波探頭間斷作用于細胞懸液中5 min,制備破碎細胞;將細胞懸液離心去掉上清液后加入濃硝酸,靜置過夜,待消解液變得澄清透明后用超純水稀釋,制備消解細胞。并同步制備樣品空白溶液。
1.3 實驗方法
儀器使用前用1 μg/L多元素調諧液校準通過。SC-ICP-MS方法采用細胞懸液直接進樣,儀器工作模式選為納米顆粒(Nano)模塊中的DRC模式。方法驗證中,在ICP-MS常規元素模塊下相同條件的DRC模式中檢測完整細胞、破碎細胞和消解細胞樣品的目標元素,同時在內標管中通入20 μg/L的Rh元素標準溶液。使用逐級稀釋法用超純水配制0、0.1、0.5、1、5、10、50 μg/L的含Cr、Mn、Fe、Cu和Zn的多元素混合標準溶液,建立方法的標準曲線,在標準曲線線性系數(r2)大于0.999的條件下開展實驗。實驗時依次通入標準溶液、樣品空白溶液和樣品溶液進行檢測。
1.4 數據處理
使用Origin 8.5和Excel 2016分析ICP-MS中Syngistix獲得的原始數據。SC-ICP-MS法使用3倍標準偏差(3σ)的迭代算法[10]來區別單個細胞信號與背景噪聲,首先計算整個數據集的平均信號值和標準偏差(σ),并收集高于平均信號值與3σ加和值的數據。然后重新計算剩余數據集的平均信號值和σ,并收集高于平均信號值與3σ加和值的數據點,直到沒有數據點高于3σ和平均信號值的加和值。這些收集到的信號數據為單細胞信號,剩余被去掉的數據代表細胞背景。SC-ICP-MS法中各金屬元素的檢出限(LOD)為細胞背景的3σ。方法驗證中各金屬元素的LOD為檢測樣品空白溶液中分析物11次測量結果的3σ[11]。
2 結果與討論
2.1 NH3流量與極桿抑制參數q(RPq)優化
細胞逐個進入ICP后,被電離產生大量Ar、C、N、H、O等輕質量數的原子,易形成多原子離子干擾,尤其對質量數在40~80的元素檢測造成較大干擾。表1列出了各分析物對應的干擾離子[12]及最有效的反應氣[13-14]。NH3可同時對細胞中待測的52Cr+、55Mn+、56Fe+、63Cu+和66Zn+有效去除多原子離子干擾。合理設置RPq值也可有效消除輕質量數原子的反應副產物,避免二次產生的干擾分子離子對目標檢測元素的影響。在儀器配套的軟件Syngistix的DRC Method Development(DRC MD)模塊中按提示分別引入超純水和1 μg/L的多元素標準溶液各測定一次,以0.1 mL/min的增量從0.5 mL/min至1.2 mL/min優化NH3流量,以0.05的增量從0.45至0.8優化RPq,評估各分析物優化結果的指標基于儀器獲得較低的背景等效濃度(BEC)和較高的信噪比(SBR)。結果顯示,NH3流量為0.7 mL/min,而52Cr+、63Cu+和66Zn+的RPq設置為0.6,55Mn+的RPq設置為0.5,56Fe+的RPq設置為0.45時,可使儀器達到最佳的檢出限。

表1 各分析物的干擾離子及最有效的反應氣
2.2 進樣速度對單細胞元素檢測的影響
實驗考察了進樣速度對細胞傳輸效率(TE)的影響,細胞傳輸效率為一段確定時間內檢出的單細胞信號個數與溶液中含有的細胞個數比值。由于細胞中微量元素的豐度不同,因此選擇合適的元素可較好地探究單細胞信號個數、單細胞信號的平均強度和溶液中分析物濃度的變化,本實驗選用66Zn可取得較好的分析效果。設置駐留時間為0.1 ms并采用細胞密度為2.5×105/mL的細胞懸液,在檢測時長為100 s的條件下,進樣速度與所測單細胞信號個數幾乎呈線性關系。進樣速度在0.12~0.64 mL/min范圍內,單細胞信號個數(y)與進樣速度(x)的線性方程為y=1 961.2x+9.412 9(r2=0.990 1)。而TE基本不發生變化,在0.54%~0.62%之間波動。考慮到進樣量太大會損失較多細胞,進樣量過小又會使檢測的細胞太少,因此最終選擇0.2 mL/min的進樣速度。
2.3 細胞密度對單細胞元素檢測的影響
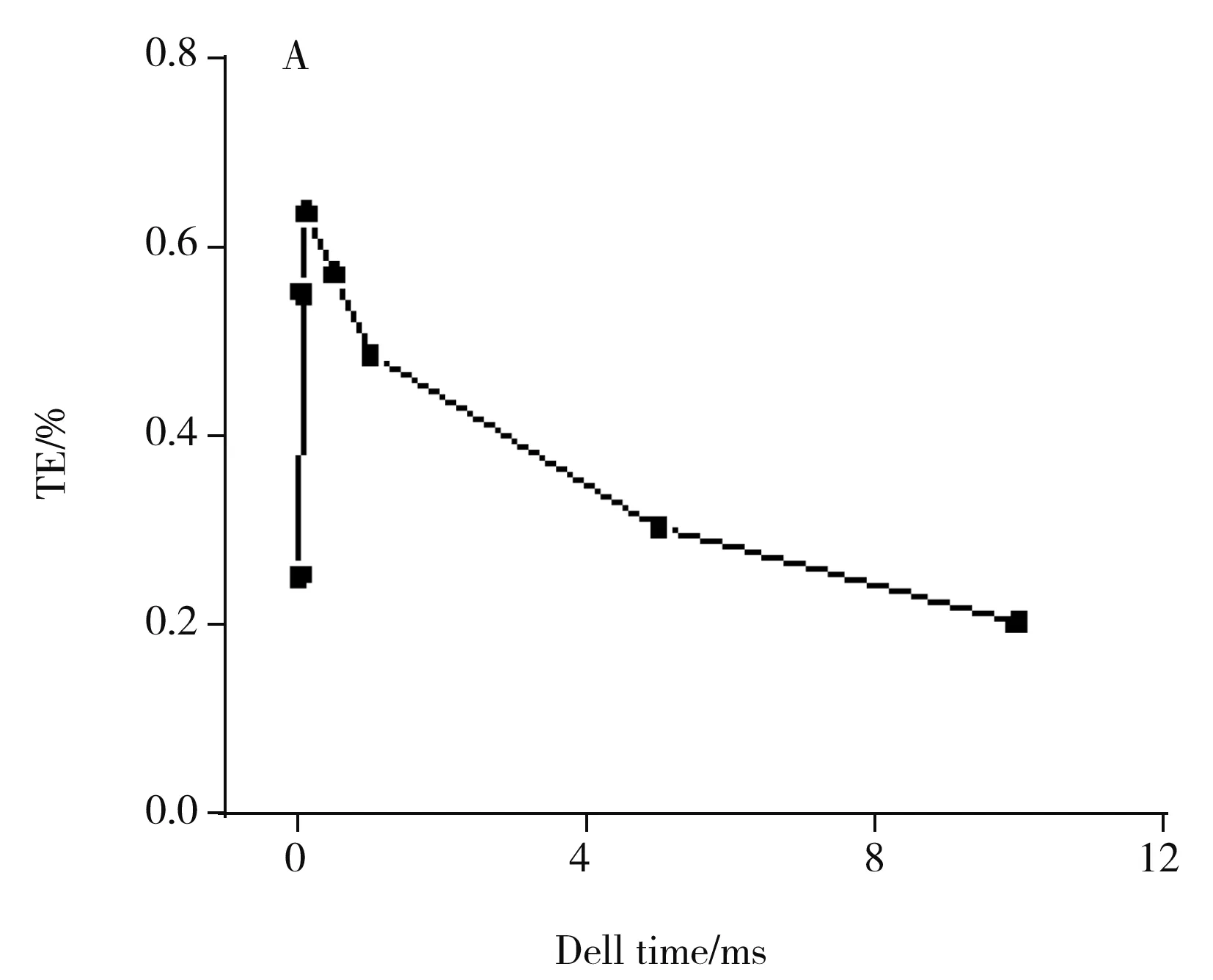
圖2 駐留時間對單細胞檢測的影響(細胞數量密度為2.5×105/mL)
為使SC-ICP-MS檢測獲得準確的單細胞信號,需選擇合適的細胞密度以保證在任何給定的駐留時間下只有一個細胞被檢測[15],研究表明檢測單個細胞的駐留時間應設置在0.1~0.5 ms[8],因此本研究選擇在0.1 ms的駐留時間下優化細胞密度。在0.2 mL/min的進樣速度和100 s的檢測時長下,隨著細胞密度增大,細胞傳輸效率呈先增大后減小的趨勢,即檢測到的單細胞信號個數呈現出先增加后減小的變化趨勢。當細胞密度大于2.5×105/mL時,檢測到的單細胞信號個數顯著降低,即確定最佳的細胞傳輸效率在細胞密度為2.5×105/mL處。此外,當細胞密度從104/mL增加到106/mL時,單細胞信號平均強度和溶液中分析物的濃度均呈現出上升趨勢,但單細胞信號平均強度并未超過低細胞密度的兩倍,而溶液中分析物濃度的強度趨近于低細胞密度時的單細胞信號平均強度。說明細胞密度增大會增加溶液中分析物的濃度,使得脈沖信號淹沒在背景信號中,最終無法區分出單細胞信號。
2.4 駐留時間對單細胞元素檢測的影響
在SC-ICP-MS方法中,由于ICP-MS檢測器直接讀取離子脈沖電流產生的數據點形成單細胞脈沖峰,駐留時間為每個數據點的采集時間,駐留時間需小于單細胞被電離形成的離子云的持續時間以獲得可分辨的單細胞信號[6]。駐留時間越小,單細胞信號越不容易淹沒在背景信號中。因此駐留時間影響著單細胞信號的檢出限和信背比(SBR)[16],也是準確計算單細胞脈沖信號強度的重要影響參數。由圖2A可見,當駐留時間在從0.01 ms增至10 ms時,檢測到的單細胞信號個數呈先增加后減少的趨勢,說明采用合適的駐留時間可檢測到更多的單細胞信號。由圖2B可見,溶液中分析物的信號強度和單細胞信號的平均強度均呈上升趨勢且逐漸靠近,分析物的濃度與駐留時間呈線性關系,表明長的駐留時間極大地增加了背景干擾,降低了單細胞信號的分辨率和靈敏度[17]。而在極短的駐留時間下,分析物的信號也會隨駐留時間的縮短而降低,檢測到的單細胞個數較少且單細胞信號的平均強度較低,不利于進行單細胞分析。綜合考慮,本研究選取0.1 ms的駐留時間作為實驗條件,在此條件下可獲得較多的單細胞信號,且信號的SBR較高。
2.5 SC-ICP-MS對單細胞內5種金屬元素的定量分析
SC-ICP-MS測定單個細胞中Cr、Mn、Fe、Cu和Zn的LOD分別為0.4、0.1、2.4、0.2、0.14 fg。圖3為HeLa細胞中52Cr+、55Mn+、56Fe+、63Cu+和66Zn+的SC-ICP-MS瞬時信號圖,表明使用SC-ICP-MS能夠很好地區分出單細胞信號,真實地反映出細胞之間各元素含量的固有差異。圖4為細胞數量與各元素信號強度的統計直方圖,圖中紅色線為高斯擬合線,將經過高斯擬合的直方圖稱為HeLa細胞的52Cr+、55Mn+、56Fe+、63Cu+和66Zn+的細胞數與信號強度的直方圖分布,圖中反映了不同信號強度上的細胞數量分布,且可獲得最高細胞數量對應的單細胞信號強度值。單個細胞內各元素含量可根據公式[15]計算:m=vtdwη(ISC-Ib)/k;式中,m為單個細胞中目標元素的含量,v為樣品進樣速度,η為標準溶液的傳輸效率,tdw為駐留時間,ISC為單細胞信號強度,Ib為背景信號強度,k為標準曲線的斜率。
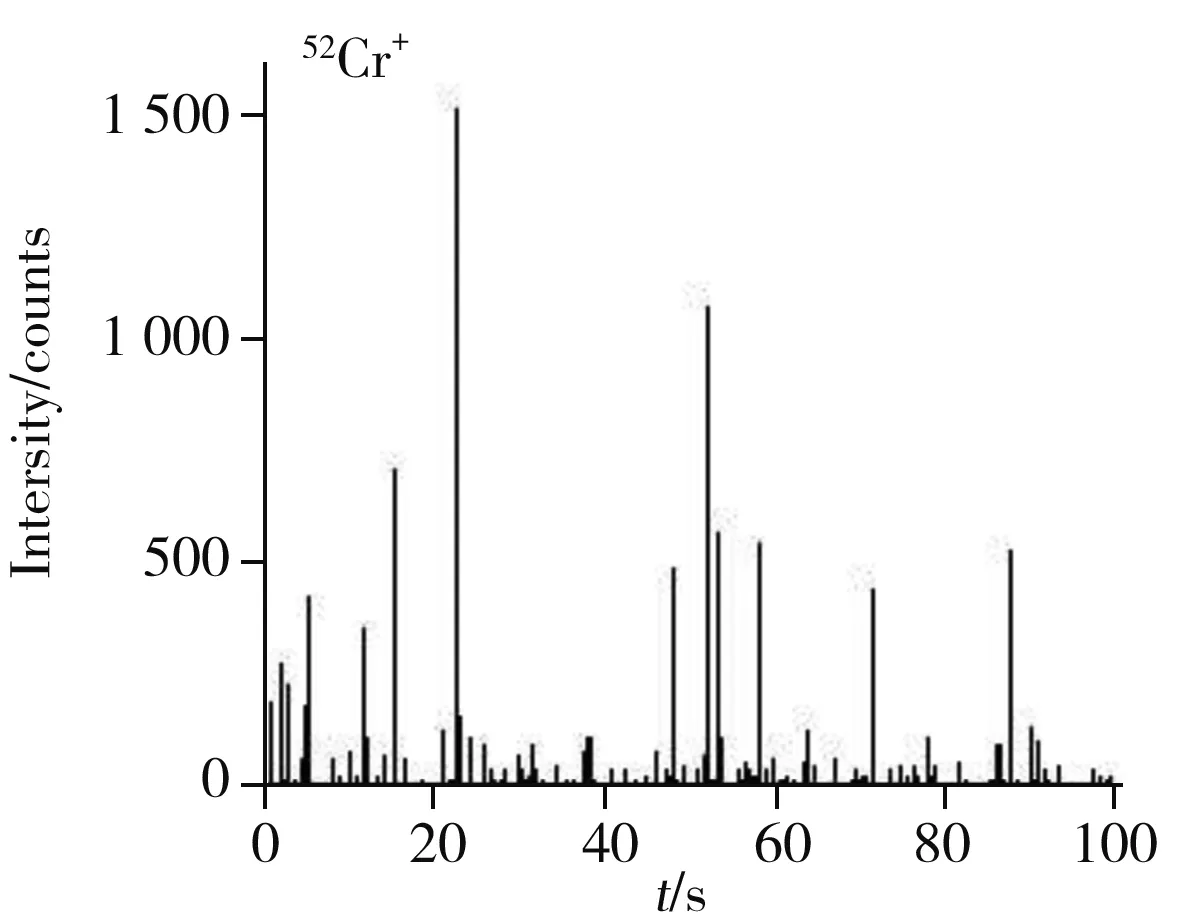
圖3 Hela細胞中52Cr+、55Mn+、56Fe+、63Cu+和66Zn+的SC-ICP-MS瞬時信號圖
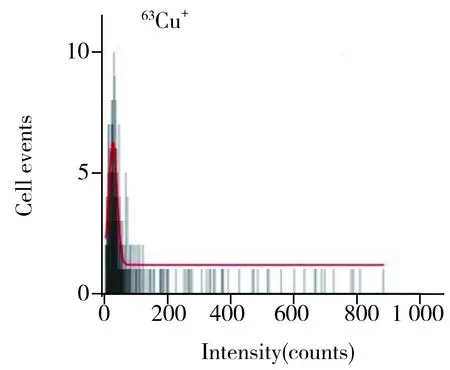
圖4 HeLa細胞中的52Cr+、55Mn+、56Fe+、63Cu+和66Zn+的細胞數量與信號強度的直方圖分布(紅色線為高斯擬合線)
2.6 SC-ICP-MS方法的驗證分析
ICP-MS對Cr、Mn、Fe、Cu和Zn的LOD分別為2.4、5.0、20.7、5.7、1.65 ng/L,滿足定量所需,相對標準偏差(RSD,n=11)為1.3%~4.7%。方法驗證中單個細胞的元素含量參考值為濃度值除以其對應的細胞密度,圖4中紅色線為高斯擬合的作用[8],取細胞數量最高的單細胞信號強度為ISC,計算SC-ICP-MS方法測定的單細胞中Cr、Mn、Fe、Cu和Zn的含量。SC-ICP-MS及方法驗證的定量結果如表2所示,ICP-MS檢測的3種樣品溶液的精密度實驗結果見表3。各元素的RSD均基本符合要求[11],但完整細胞樣品和破碎細胞樣品中多個元素的RSD大于消解細胞樣品的RSD,可能是由于元素在這兩種樣品溶液中不同程度的非均勻性導致的。
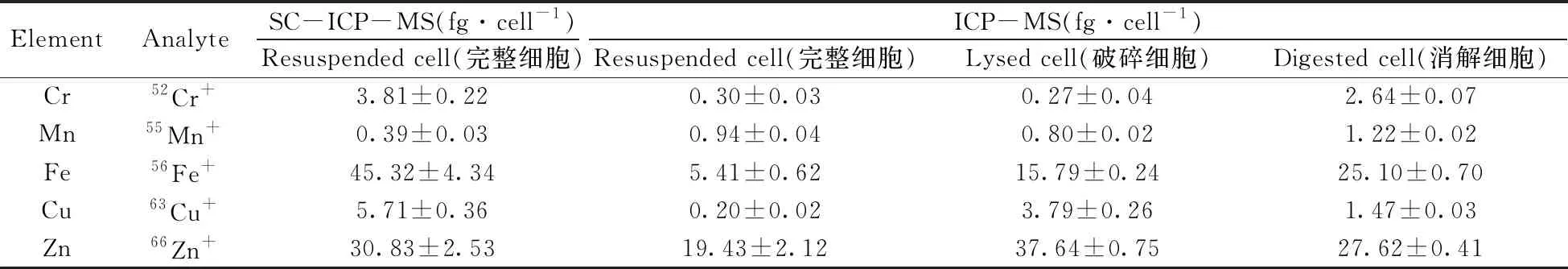
表2 SC-ICP-MS及ICP-MS方法驗證的單細胞內5種金屬元素含量

表3 方法驗證的精密度實驗
方法驗證中,ICP-MS檢測細胞懸液中完整細胞所得單細胞Cr、Fe、Cu和Zn含量比SC-ICP-MS的測定結果低很多,不能反映單細胞內元素含量的真實值。而單細胞Mn含量略高于SC-ICP-MS的測定值,表明SC-ICP-MS測定的單細胞Mn含量偏小。ICP-MS檢測消解細胞所得的單細胞Cr和Fe含量比破碎細胞多,說明細胞中Fe和Cr元素主要以有機結合態的形式存在,濃硝酸徹底分解有機物后Fe和Cr易溶于酸中而被檢出,表明細胞消解后的測定參考值適用于驗證SC-ICP-MS方法測定單細胞Cr和Fe含量的準確性。然而,ICP-MS檢測破碎細胞所得的單細胞Cu和Zn含量比檢測消解細胞的多,因為超聲波釋放了細胞內含Cu和Zn的物質并將這類物質裂解而獲得更大的電離效率[9],所以表明選用超聲波破碎細胞后測定的結果更能準確驗證SC-ICP-MS對大多數單細胞Cu和Zn的定量分析,也說明使用SC-ICP-MS方法測定完整細胞的某些元素時存在基質效應,需對此方法的定量結果進行多角度驗證。
3 結 論
本文使用DRC模式消除了多原子離子干擾并研究了進樣速度、細胞密度、駐留時間等因素對SC-ICP-MS測定單細胞內微量元素的影響。在優化的儀器參數和實驗條件下測定了單細胞的Cr、Mn、Fe、Cu和Zn元素,基于SC-ICP-MS分析細胞異質性的通用策略[5],可以在細胞內多元素監測、金屬藥物代謝動力學、金屬相關疾病診斷、納米毒理學研究等方面實現單細胞水平的精準分析。提出了對SC-ICP-MS方法的多角度驗證方法,可采用超聲波破碎細胞和消解細胞的方法評估SC-ICP-MS測定單細胞不同元素的準確性,這對缺少細胞標準物質且使用SC-ICP-MS方法檢測單細胞內更多元素的研究具有借鑒意義。