聯氨氧化酶初步純化及醌類化合物對其活性影響
李 竺 芯, 張 壽 通, 李 陽, 閻 松
(大連交通大學 環境與化學工程學院,遼寧 大連 116021)
0 引 言
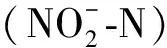
目前已知的厭氧氨氧化菌主要包括5個屬,即CandidatusBrocadia、CandidatusKuenenia、CandidatusScalindua、CandidatusJettenia和CandidatusAnammoxoglobus[6,8],均屬于浮霉菌門(Planctomycetes).厭氧氨氧化反應過程中發揮核心作用的是厭氧氨氧化菌,由于這種菌生長世代長,致使其難以培養,目前僅能獲得其富集培養物,人們對這種菌適宜分離與生長生態條件的研究還很有限[9-10].2007年,Shimamura等從富集有菌株KSU-1的生物反應器中分離純化出一種具有聯氨(N2H4)氧化活性但不具備NH2OH氧化能力的酶,將其正式命名為聯氨氧化酶(hydrazine oxidizing enzyme,HZO)[11-14].聯氨氧化酶是厭氧氨氧化菌的特征代謝酶,它可為厭氧氨氧化菌的多樣性研究提供依據[15-16].厭氧氨氧化菌的代謝途徑并沒有準確的定論,這主要是由于對厭氧氨氧化菌的關鍵代謝酶缺乏深入研究,缺乏對聯氨氧化酶純化的研究,對聯氨氧化酶相關性質的研究也很欠缺.若能根據提取純化的厭氧氨氧化菌關鍵代謝酶來分析其活性和具體功能,將有助于對其代謝模式的確定[17].
本文對厭氧氨氧化菌進行實驗室擴大培養,制備厭氧氨氧化菌的無細胞抽提液,采用超濾、DEAE陰離子層析等方法純化厭氧氨氧化菌的特征代謝酶聯氨氧化酶,檢測酶活性.并研究適宜溫度、pH下厭氧氨氧化菌聯氨氧化酶的性質及外源醌類化合物是否會對厭氧氨氧化反應進行催化,參與到厭氧氨氧化過程.這對確保工藝的長期高效穩定運行具有重要意義.
1 粗酶液的提取測定
1.1 實驗室擴培反應器
實驗采用底面外直徑35 cm、內直徑30 cm、反應器總高度40 cm、內容積高度33 cm的圓柱形有機玻璃反應器,反應器內裝有纖維質無紡布[18],反應器裝置如圖1所示.反應器由蠕動泵控制自動運行,根據厭氧氨氧化菌所需進水配水,加熱器控制進水溫度,對菌種進行反應器培養.
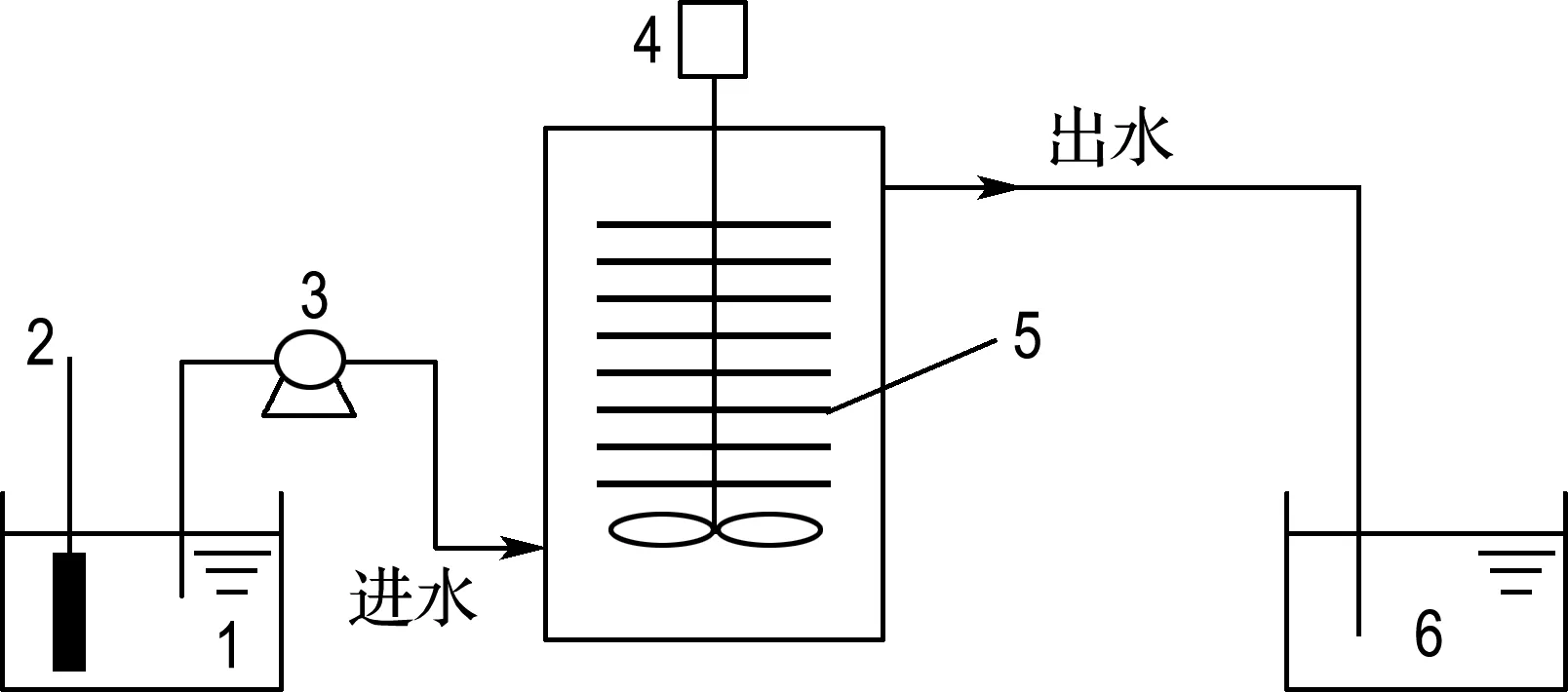
1 進水水箱; 2 加熱器; 3 蠕動泵; 4 攪拌器; 5 無紡布填料; 6 出水水箱
1.2 實驗用水

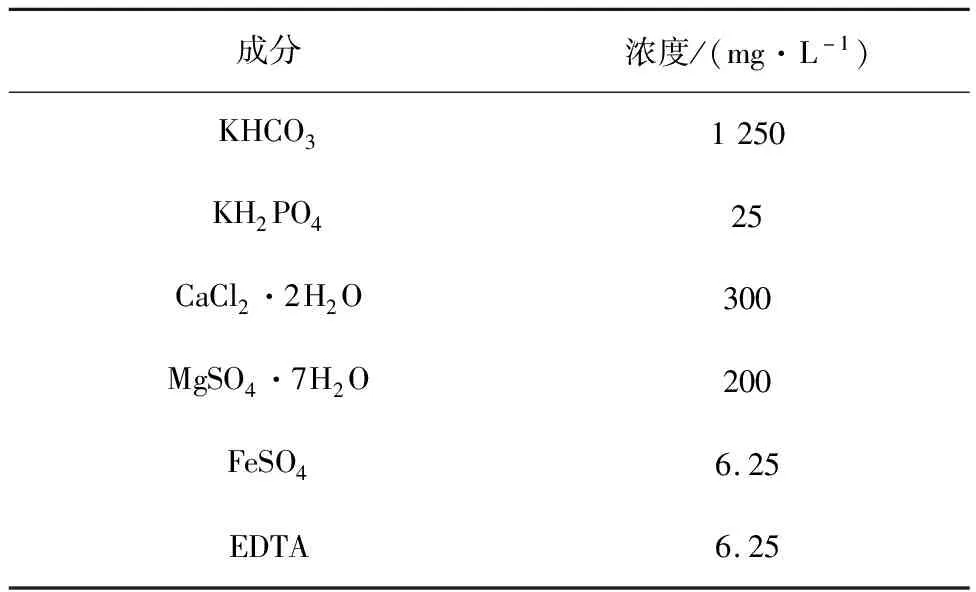
表1 模擬污水的主要成分
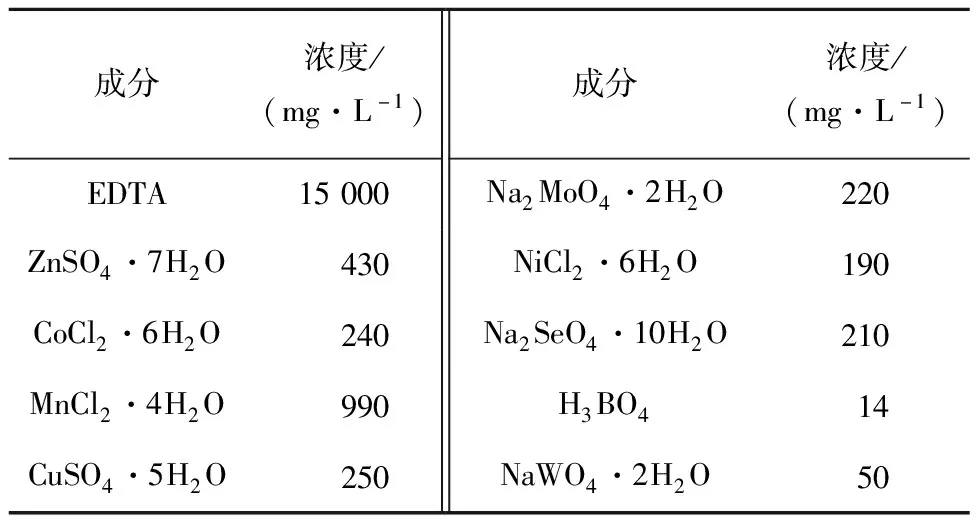
表2 微量元素溶液配方(1.25 mL/L)
1.3 粗酶液的提取
取菌樣于離心管中,離心20 min后倒去上清液,留下沉淀,將沉淀加入配制好的配方(Tris緩沖液,0.1 mmol/L二硫蘇糖醇,1%膽酸鈉,0.5%脫氧膽酸鈉)溶解混合,將混合液倒入燒杯中,放入磁力轉子,于0 ℃下500 r/min的速度攪拌1.5 h,目的是將菌細胞破碎,形成菌懸;攪拌后再次離心20 min,離心后取得的上清液即為粗酶液,舍去沉淀.
1.4 細胞色素C標準曲線的繪制
分別加入細胞色素C(10 mmol/L)4、8、12、16、20、24 μL,用磷酸鹽緩沖液補充至4 000 μL.此時細胞色素C濃度為10、20、30、40、50、60 μmol/L.加入保險粉至顏色變成粉紅色,得到還原態細胞色素C.測得其吸光度,用得到的吸光度作標準曲線.
1.5 聯氨氧化酶活性測定
酶活性強弱表征為550 nm波長下還原態細胞色素C的生成速率.酶促反應體系包含20 mmol/L 磷酸鹽緩沖溶液、50 μmol/L細胞色素C(氧化態)、50 μmol/L肼和200 μL粗酶液,反應溫度為(35±1)℃.聯氨氧化酶活性的單位為μmol/(g·min).
1.6 蛋白濃度測定
BCA蛋白濃度測定試劑盒購自北京索萊寶科技有限公司.在堿性條件下,蛋白將銅離子(Cu2+)還原為亞銅離子(Cu+),Cu+與BCA試劑形成紫藍色的絡合物,測定其在562 nm處的吸光度,并與標準曲線做對比,即可計算待測蛋白的濃度.
2 聯氨氧化酶的初步純化
2.1 層 析
(1)DEAE-Sepharose FF凝膠的處理:凝膠用純凈水反復沖洗直到形成較大顆粒膠體,用Tris緩沖液平衡.
(2)裝柱:將層析柱固定于滴定架上,柱底墊圓形尼龍紗,出口接細塑料管并關閉出水.將浸泡于20 mmol/L、pH8.0 Tris緩沖液中的凝膠沿玻璃棒緩慢倒入柱中(注意不要有氣泡),待凝膠自然沉降將上層蓋子緩慢放入并擰緊.
(3)平衡:松開出水口螺旋夾,以20 mmol/L、pH8.0 Tris緩沖液平衡,控制流速為2.0 mL/min,待流出液的紫外吸光度穩定時,停止平衡.
(4)加樣、洗脫與收集:采用恒流泵以2.0 mL/min 的流速加入樣品,待液體進入柱床后,用初始緩沖液洗脫大約兩個柱體積,再分別用0.1、0.2、0.3、0.4、0.5、1.0、2.0 mol/L的NaCl(平衡緩沖液配制)進行線性洗脫,控制流速為2.0 mL/min.紫外蛋白監測,收集洗脫蛋白.
2.2 透析凍干
將0.2 mol/L NaCl洗脫下來的蛋白質液體進行透析脫鹽,然后進行凍干,凍干的步驟如下:首先按制冷鍵,預冷30 min左右;預冷后將干燥物品放置于干燥盤中,將有機玻璃罩罩上,按下快速充氣閥上的不銹鋼片,將接嘴管拔出,最后按真空泵鍵,顯示999,直到1 000 Pa以下方可顯示實際真空度.
2.3 超 濾
凍干后得到的酶蛋白用Tris緩沖液進行溶解,然后進行超濾過濾,超濾膜的截留相對分子質量分別為50 kDa和100 kDa.經此步驟可得到相對分子質量小于50 kDa、50~100 kDa和大于100 kDa 3部分酶蛋白,超濾后用20 mmol/L Tris緩沖液洗膜,測各部分酶蛋白活性,最后將具有最高比活性的溶液挑選出來,4 ℃保存,備用.
3 醌類化合物對聯氨氧化酶的影響探究
3.1 萃取醌類化合物對聯氨氧化酶活性的影響
以乙醇為溶劑,因此設置乙醇為對照組,通過萃取,將厭氧氨氧化菌聯氨氧化酶粗酶液中的輔酶Q萃取出來,此時測量萃取后聯氨氧化酶的酶活性,并通過分光光度計測量酶活性變化的OD值.再將輔酶Q重新加入聯氨氧化酶粗酶液中,探究此時聯氨氧化酶的酶活性和OD值,對萃取前后的酶活性變化進行比較.
3.2 其他醌類化合物對聯氨氧化酶活性的影響
先分別加入0.03和0.06 mmol/L輔酶Q,測其聯氨氧化酶活性及OD值.再探究2-羥基-1,4-萘醌對聯氨氧化酶活性的影響,分別加入0.03、0.06、0.3和0.6 mmol/L的2-羥基-1,4-萘醌,測量并比較加入不同量的2-羥基-1,4-萘醌后聯氨氧化酶活性及OD值的變化,并對加入量與加入輔酶Q的酶活性變化進行比較.最后探究蒽醌-2-磺酸鈉鹽對聯氨氧化酶活性的影響,分別加入0.03、0.06、0.3和0.6 mmol/L的蒽醌-2-磺酸鈉鹽,同理測量并比較加入不同量的蒽醌-2-磺酸鈉鹽后聯氨氧化酶活性及OD值的變化,并對加入量與加入輔酶Q及加入2-羥基-1,4-萘醌的酶活性變化進行比較.
4 結果與討論
4.1 粗酶液的制備與酶活性探究相關結果
4.1.1 還原態細胞色素C標準曲線的繪制 還原態細胞色素C標準曲線的繪制如圖2所示(波長550 nm).

圖2 細胞色素C標準曲線
4.1.2 BCA標準曲線的繪制 BCA標準曲線的繪制如圖3所示(波長562 nm).
經測量得到粗酶液吸光度為0.477,通過圖3中公式計算得到粗酶液蛋白含量為0.347 mg/mL.

圖3 BCA標準曲線
4.1.3 聯氨氧化酶活性的測定計算 對聯氨氧化酶活性進行測定,其不同時間下對應的吸光度及計算所得的細胞色素C濃度如表3所示.
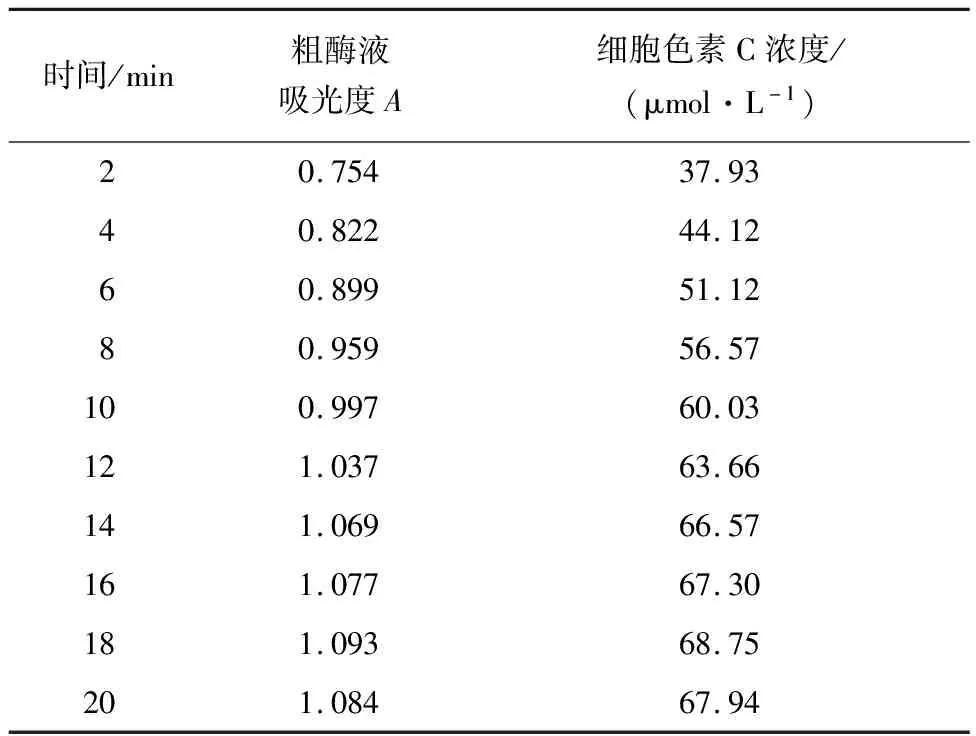
表3 聯氨氧化酶活性的測定
聯氨氧化酶活性a計算公式如下:
a=(c-c0)/(τ×ρ)
其中c為穩定后細胞色素C濃度,c0為初始細胞色素C濃度,τ為達到穩定間隔時間,ρ為粗酶液蛋白含量.
根據以上公式計算聯氨氧化酶活性a=(68.75-37.93)/[(18-2)×0.347]μmol/(g·min)=5.55 μmol/(g·min),得出聯氨氧化酶粗酶液的酶活性為5.55 μmol/(g·min).
4.1.4 溫度對聯氨氧化酶活性的影響 圖4實驗數據表明吸光度隨著溫度的升高先升高后降低,也就是說聯氨氧化酶活性隨著溫度的升高先升高后降低,可以看到35 ℃時聯氨氧化酶活性最高.

圖4 溫度對聯氨氧化酶活性的影響
4.1.5 pH對聯氨氧化酶活性的影響 圖5實驗數據表明不同反應時間下吸光度都是先升高后降低,也就是說聯氨氧化酶活性隨著pH的升高先升高后降低,分析可以得到不同反應時間下pH=7.5時聯氨氧化酶活性最高.
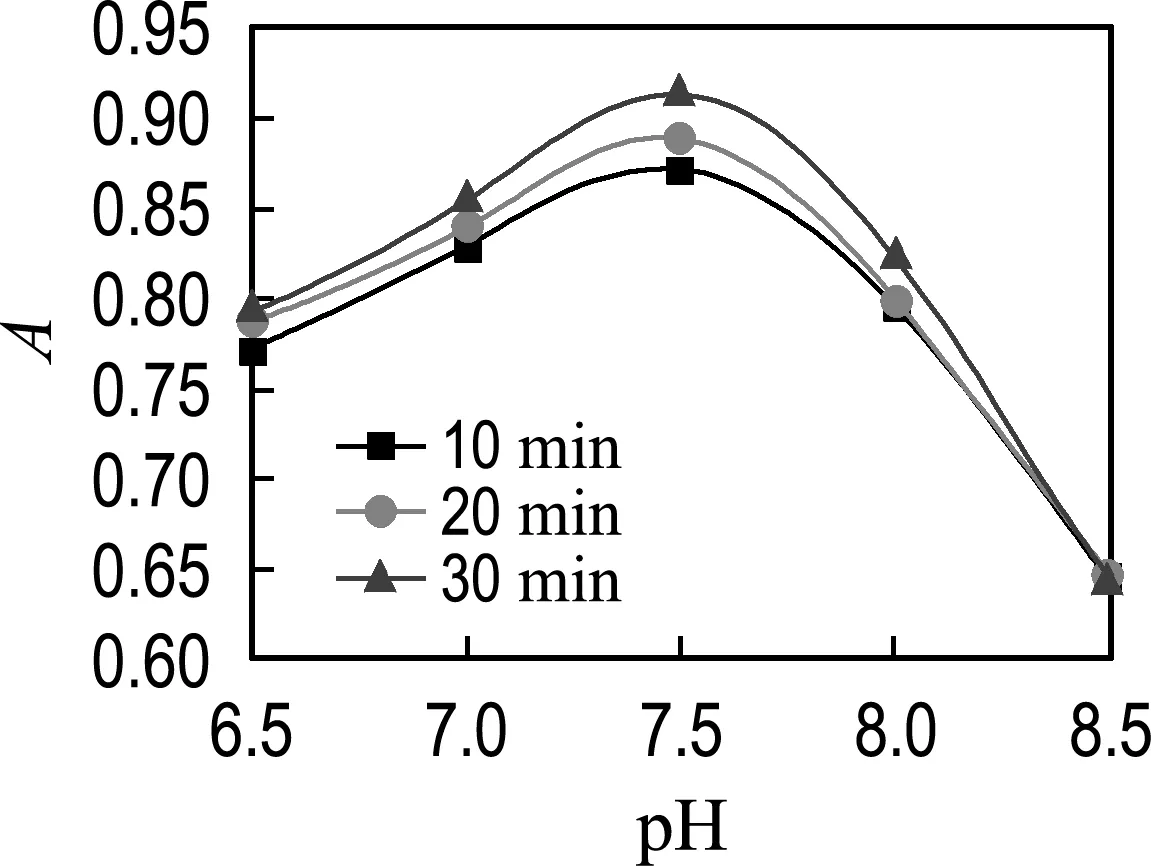
圖5 pH對聯氨氧化酶活性的影響
4.2 聯氨氧化酶的初步純化結果
4.2.1 DEAE陰離子交換層析結果 由表4和圖6結果,通過計算可得經DEAE陰離子交換層析后,聯氨氧化酶集中在0.2 mol/L NaCl洗脫液中,其他濃度的NaCl洗脫液中雖然也有蛋白含量,但是蛋白含量都不高,而且從層析圖譜可以看出其他洗脫液中所含蛋白應該不是聯氨氧化酶蛋白,0.2 mol/L NaCl洗脫液中蛋白酶活性是粗酶液的2.3倍.
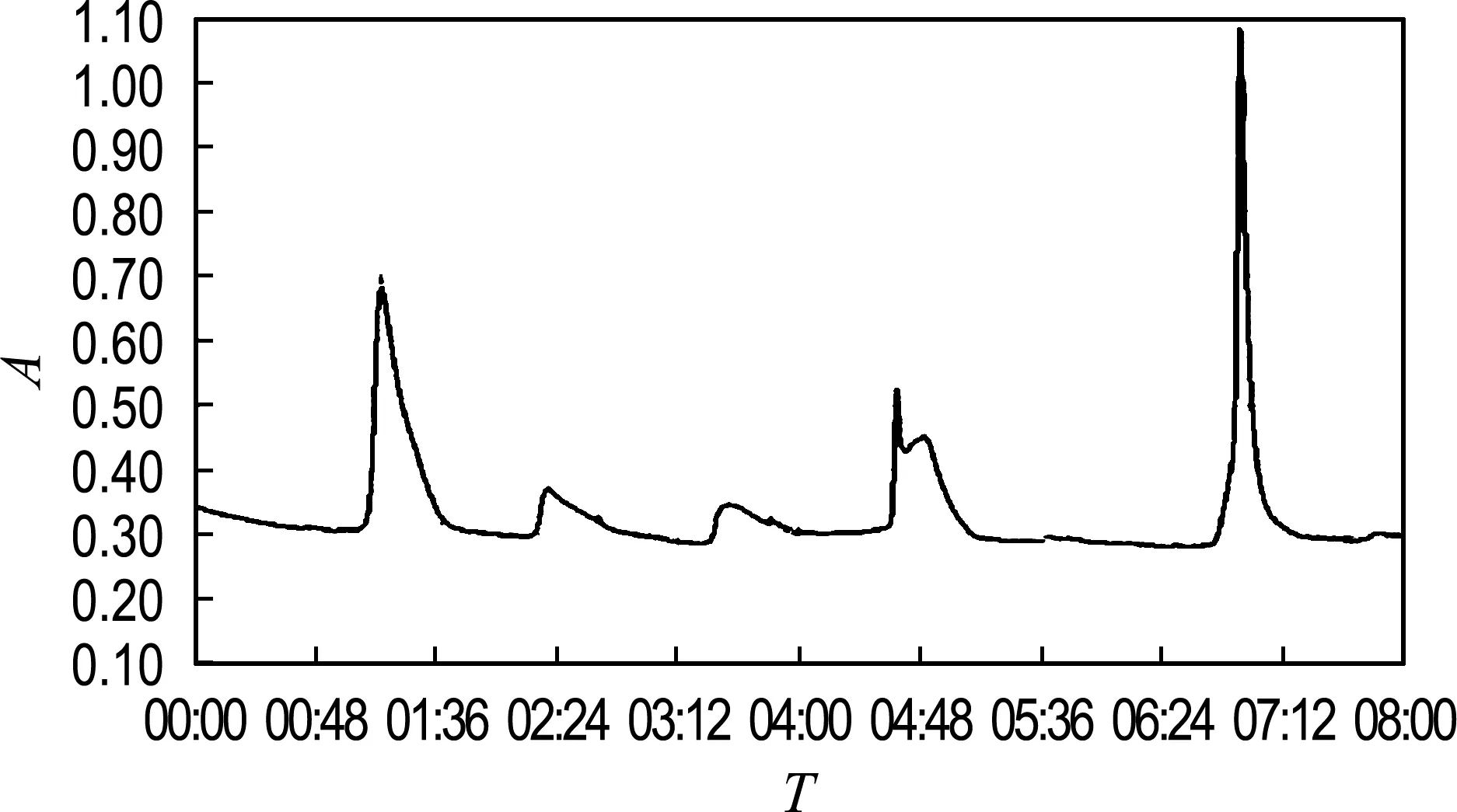
圖6 層析譜圖

表4 不同濃度NaCl洗脫的聯氨氧化酶活性
4.2.2 超濾結果 通過表5可以看出DEAE陰離子交換層析和超濾的方法都能使聯氨氧化酶得到純化,DEAE陰離子交換層析將聯氨氧化酶活性增加到原來的2.3倍,層析后取0.2 mol/L NaCl洗脫下來的蛋白再進行超濾后,將聯氨氧化酶活性增加到原來的6.1倍.表6計算結果表明0.2 mol/L NaCl洗脫下來的聯氨氧化酶活性集中在超濾50~100 kDa的液體中,純化蛋白相對分子質量在50~100 kDa.

表5 聯氨氧化酶初步純化總結
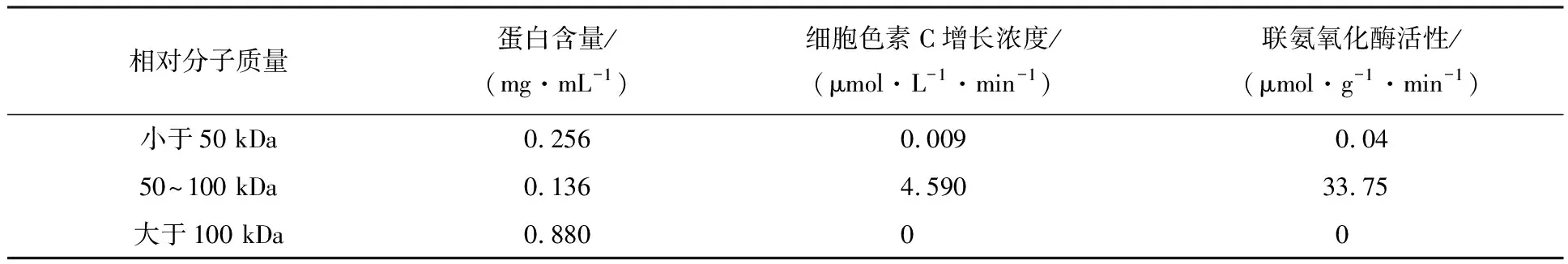
表6 超濾后細胞色素C吸光度測定
4.3 醌類化合物對聯氨氧化酶活性的影響結果
由圖7可知以乙醇為溶劑會使酶活性降低,由5.688 μmol/(g·min)降低到3.886 μmol/(g·min);萃取出輔酶Q,酶活性降低至原來的1/3,重新加入輔酶Q,對提高酶活性效果最好.
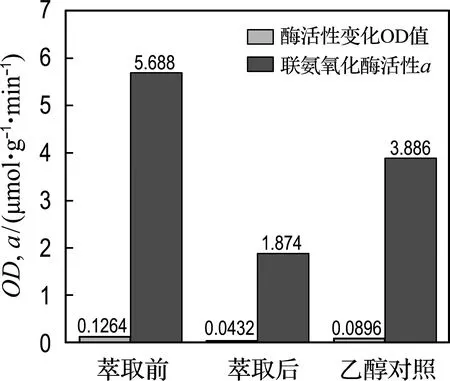
圖7 萃取醌類化合物對聯氨氧化酶活性的影響
由圖8可知,與乙醇對照相比加0.06 mmol/L輔酶Q的酶活性是9.264 mol/(g·min),是乙醇對照的2.38倍;2-羥基-1,4-萘醌對酶活性提高效果稍差,與乙醇對照相比加0.6 mmol/L 2-羥基-1,4-萘醌酶活性是其1.74倍;蒽醌-2-磺酸鈉鹽對酶活性提高基本無影響,與乙醇對照相比加入0.6 mmol/L 蒽醌-2-磺酸鈉鹽的酶活性是其活性的0.96.
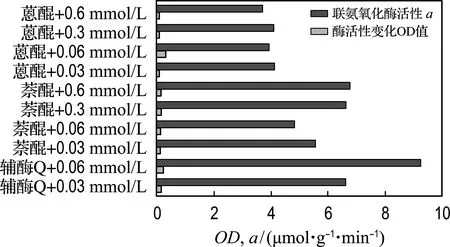
圖8 加入醌類化合物聯氨氧化酶活性測定對比圖
5 結 論
(1)聯氨氧化酶活性最適溫度為35 ℃,最適pH為7.5.
(2)通過DEAE陰離子交換層析可知聯氨氧化酶集中在0.2 mol/L NaCl洗脫液中,酶活性是粗酶液的2.3倍,因此層析法可以進一步純化聯氨氧化酶.
(3)超濾結果表明,純化的聯氨氧化酶蛋白相對分子質量在50~100 kDa,聯氨氧化酶活性提高到原來的6.1倍.
(4)通過正庚烷萃取輔酶Q,粗酶液酶活性降低,投加輔酶Q對提高酶活性效果最好,2-羥基-1,4-萘醌對酶活性提高效果稍差,蒽醌-2-磺酸鈉鹽對酶活性基本無影響.

